Введение
Несмотря на современные достижения в офтальмологии, глаукома остается одной из ведущих медико-социальных проблем во всем мире, являясь лидирующей причиной слабовидения, слепоты и инвалидности [1, 2]. Так, в России ежегодно регистрируется 1 случай заболевания глаукомой на 1000 человек, а количество пациентов увеличивается с возрастом, достигая 14% больных в возрасте старше 80 лет [3].
Поиск новых подходов к лечению глаукомы остается актуальным, несмотря на наличие большого количества фармакологических средств и хирургических методов. Эффективные лекарственные препараты стоят дорого, а сроки их применения, учитывая хронический прогрессирующий характер заболевания, являются длительными. Кроме того, нельзя забывать о комплаентности пациентов, снижению которой способствуют побочные эффекты местной медикаментозной терапии, в том числе ее негативное влияние на глазную поверхность. Хирургическую операцию не всегда позволяет выполнить общее состояние пациента и стадия глаукомы. Лазерное лечение имеет ряд важных преимуществ: обладает хорошей эффективностью, проводится амбулаторно, не требует проведения общего обезболивания, хорошо переносится, сохраняет возможность для выполнения повторных процедур, имеет невысокую себестоимость, как итог — накладывает меньшую финансовую нагрузку на здравоохранение.
Содержание статьи
Роль гониоскопии в выборе вида лазерной операции
Выбор метода лазерной терапии зависит от вида глаукомы, т. е. от патогенетического механизма, лежащего в основе ее развития [4]. Гониоскопия позволяет диагностировать вид глаукомы путем оценки состояния структур угла передней камеры (УПК), являясь необходимым методом для принятия решения о проведении пациенту того или иного вида лазерного вмешательства.
При выполнении гониоскопии с помощью щелевой лампы устанавливается увеличение между 10 и 25, ширина луча 2–3 мм. Световая вилка лучше всего видна в верхнее и нижнее зеркало линзы Гольдмана, осмотр начинают с нижней зоны УПК (т. е. верхнее зеркало) и смещаются по часовой стрелке [5].
При ювенильной и первичной открытоугольной глаукоме (ПОУГ) взрослых во время исследования может быть выявлен симптомокомплекс трабекулопатии: уменьшение качества и количества клеток трабекулярного фильтра, дегенерация трабекулярных пластинок, сужение межтрабекулярных щелей, наличие в УПК эксфолиаций, пигмента, продуктов их распада. Также могут быть обнаружены признаки мезенхимального дисгенеза: остатки мезодермальной ткани в УПК, задний эмбриотоксин, иридотрабекулярные тяжи, переднее (высокое) прикрепление радужки [6, 7].
Синдром пигментной дисперсии, расцениваемый как латентная фаза пигментной глаукомы, характеризуется вымыванием пигмента из эпителия пигментного слоя радужки и его перераспределением в структурах переднего сегмента глаза. При гониоскопии визуализируется открытый УПК с прикорневым пролапсом (характерной вогнутостью) радужки. Выраженная гиперпигментация трабекулы наблюдается по всей окружности УПК, она гомогенна и формирует плотную пигментную полосу. Пигмент накапливается в области линии Швальбе и кпереди от нее в виде единичных или множественных хаотичных линий — так называемая линия Сампаолези, имитирующая для неопытного исследователя передний край трабекулярной сети [5–7].
Кроме пигмента в УПК на развитых стадиях псевдоэксфолиативного синдрома может откладываться псевдоэксфолиативный материал, затрудняющий отток внутриглазной жидкости (ВГЖ), что приводит к подъему внутриглазного давления (ВГД) и развитию глаукомы.
При гиперметропической рефракции, сочетании укороченной переднезадней оси глаза и утолщенного хрусталика при гониоскопии будет визуализироваться узкий УПК. Блокада УПК корнем радужки с образованием гониосинехий является патогенетическим механизмом развития закрытоугольной глаукомы с интермиттирующим течением [5–7].
Во время гониоскопии можно провести пробу Форбса для дифференциальной диагностики функционального и органического блока УПК. Прямое давление на роговицу посредством линзы вызывает ускорение оттока ВГЖ в направлении УПК, и функционально блокированный угол углубляется. Угол, закрытый синехиями, не открывается при надавливании или открывается частично, при этом становятся видны передние синехии к трабекулярной сети или роговице [5, 6].
Изменения, обнаруженные во время гониоскопии, определяют, какой метод лазерного воздействия (тракционный или перфорационный) будет выбран для лечения заболевания.
Лазерные методы лечения глаукомы
Лазерные методы лечения глаукомы обладают патогенетической направленностью (восстановление оттока ВГЖ происходит по естественным путям), малой инвазивностью, позволяют нормализовать ВГД при минимальных риске развития осложнений и периоде реабилитации [8].
Основоположниками лазерной терапии глаукомы в нашей стране являются академики М.М. Краснов и А.П. Нестеров [7, 9].
Выделяют два типа методик: 1) тракционные — лазерная трабекулопластика (ЛТП) (в т. ч. аргонлазерная (АЛТП)), иридогониопластика (ИГП); 2) перфорационные — лазерная иридэктомия (ЛИЭ), гониопунктура (ГАО). Отдельно выделяют лазерные циклодеструктивные процедуры (ЛЦК), которые применяют для лечения рефрактерной глаукомы.
В настоящее время при лечении глаукомы используют два основных типа лазеров, отличающихся по механизму воздействия: импульсные с очень короткой продолжительностью теплового удара (ИАГ) и лазеры с непрерывным излучением, обеспечивающие преимущественно термическое воздействие на ткани (диод-лазер с удвоенной частотой, аргон) [10–13].
В настоящее время особого внимания заслуживают микроимпульсные лазерные вмешательства, что обусловлено широким спектром преимуществ данных методик. Так, следует отметить полную атравматичность данного вида вмешательства, отсутствие интра- и послеоперационных осложнений со стороны переднего и заднего отделов глаза, безболезненность, возможность дозирования гипотензивного эффекта, а также выполнения вмешательства у пациентов с аллергическими противопоказаниями, при наличии тяжелой сопутствующей соматической патологии и рефрактерных противопоказаниях [14, 15].
Недостатками лазерного лечения глаукомы являются: возникновение реактивного синдрома, характеризующегося повышением ВГД в первые часы после лазерного вмешательства и развитием воспалительного процесса в дальнейшем; риск повреждения клеток заднего эпителия роговицы, а также капсулы хрусталика и сосудов радужки; возможность образования синехий в области воздействия; ограниченность эффекта операции, который снижается по мере увеличения срока, прошедшего с постановки диагноза глаукомы; терапия эффективна на ранних стадиях болезни [8, 10].
Лазерная трабекулопластика
Основным видом вмешательств при открытоугольной глаукоме является ЛТП, направленная на улучшение оттока ВГЖ по естественным дренажным путям. Лазерное воздействие на структуры УПК глаза вызывает сморщивание тканей, растяжение трабекулярного аппарата, раскрытие склерального синуса и улучшение оттока ВГЖ [16].
Показания к проведению ЛТП представлены в таблице [17–19].
Противопоказаниями к проведению ЛТП являются: помутнения и отек роговицы, воспалительные заболевания глаза, внутриглазная опухоль, закрытоугольная глаукома, отсутствие вербального контакта с больным или не-адекватное его поведение, высокое ВГД [20].
Процедура выполняется амбулаторно в один (270–360°) или два (по 180°) этапа с интервалом в 2 нед. Показаниями к двухэтапному выполнению процедуры являются единственный зрячий глаз, наличие сочетанной офтальмологической патологии (например, миопия с периферической витреохориоретинальной дистрофией и макулопатией) и коморбидности [18, 19].
Методика АЛТП для лечения ПОУГ была разработана в 1979 г. и представляет собой нанесение лазерных коагулятов в проекции шлеммова канала. Улучшение оттока водянистой влаги происходит за счет фотокоагуляции трабекулярной зоны. Минусом метода является формирование выраженных и необратимых морфологических изменений трабекулярных структур, что приводит к снижению эффективности повторных вмешательств в данной зоне. К осложнениям операции относятся реактивный подъем ВГД, воспалительные реакции со стороны переднего отрезка глаза [13].
Аргонлазерная трабекулопластика по J.B. Wise et al. [21] (514 нм) проводится по следующим параметрам: мощность 500–1200 мВт, диаметр пятна 50 мкм, экспозиция 0,1 с (100 мс), количество импульсов 50–100, объем вмешательства 180–360° (одно-, двухэтапная, поэтапная), шаг 4–5 коагулятов.
Селективная лазерная трабекулопластика (СЛТП) обладает высокоизбирательным механизмом действия, воздействуя исключительно на пигментные клетки дренажной системы глаза, не повреждая окружающие его структуры и тем самым способствуя очищению и ремоделированию дренажной сети, улучшая отток ВГЖ. При СЛТП фототермолизис меланинсодержащих клеток приводит к привлечению макрофагов, которые способствуют само-очищению трабекулярной сети. СЛТП выполняется в качестве самостоятельного лазерного лечения, преимущественно в начальной и развитой стадиях ПОУГ, при офтальмогипертензии, субкомпенсации ВГД, в случаях умеренной и выраженной пигментации трабекулярной зоны, обеспечивая снижение ВГД на 6–8 мм рт. ст. [12, 13, 22]. Техника СЛТП мало отличается от традиционной ЛТП и АЛТП: применяется трехзеркальная гониолинза Гольдмана, нанесение импульсов (обычно около 50) на всю зону трабекулы, не перекрывающих друг друга по площади, по окружности в 180°.
В отличие от СЛТП (АЛТП) при YAG-лазерной активации трабекулы (YAG-ЛАТ) над поверхностью трабекулы образуется ударная волна, которая приводит в движение влагу передней камеры и различные отложения на поверхности трабекулы, осуществляя «промывание» трабекулярных щелей под давлением. При данной методике лазерное воздействие достигает цели вне зависимости от степени пигментации трабекулы. YAG-ЛАТ проводится при следующих параметрах: диаметр пятна 8–10 мкм, энергия 0,8–1,1 мДж, количество импульсов 50–60, наносимых в нижней половине УПК в проекции шлеммова канала на протяжении 180° [12].
К преимуществам микроимпульсной мультиволновой ЛТП следует отнести достижение максимального гипотензивного эффекта в отсутствие фототермических повреждений трабекулы, отсутствие риска роста эпитрабекулярной вторичной мембраны, а также возможность выбора длины волны в зависимости от степени пигментации трабекулы [12, 23]. Параметры микроимпульсной ЛТП на 360° в модификации И.Ю. Мазунина и соавт. [18, 19] представлены в таблице.
Иридогониопластика
Показанием к проведению ИГП является узкий профиль УПК перед трабекулопластикой после проведенной ранее ЛИЭ. Ввиду того, что при данном виде вмешательства коагуляции подвергается корень радужной оболочки и цилиарное тело, вероятность развития осложнения (послеоперационного реактивного синдрома) наиболее высока. До внедрения в офтальмологическую практику микроимпульсных лазеров качественно выполнить ИГП у пациентов с сильно пигментированной радужной оболочкой не представлялось возможным. Характеристики микроимпульсной ИГП представлены в таблице.
Возможно одномоментное выполнение ИГП и ЛТП, что позволяет сократить сроки лечения пациента [15, 24, 25].
Гидродинамическая активация оттока
Еще одним методом лазерной терапии глаукомы в настоящее время является операция гидродинамической активации оттока (ГАО). В отличие от трабекулопластики ее выполняют с помощью импульсного лазера с перфорирующим эффектом — ИАГ-лазера. ГАО вызывает расширение межтрабекулярных пространств, удаляет пигмент и эксфолиации из толщи трабекулы, а также частично приводит к ее истончению. Эффект операции проявляется и в случаях, когда повторные аргонлазерные вмешательства не оказывают гипотензивного действия (методика разработана на кафедре офтальмологии им. А.П. Нестерова) [16].
Иридэктомия
Показаниями к проведению ЛИЭ являются: первичная и вторичная закрытоугольная глаукома, открытоугольная глаукома с узким УПК, парный глаз при закрытоугольной глаукоме с профилактической целью, дополнительное вмешательство после внутриглазных операций при неполной эксцизии радужки или закрытии колобомы пигментом и спайками, узкоугольная и закрытоугольная глаукома при функциональной блокаде УПК, острый приступ глаукомы, профилактика острого приступа на парном глазу при положительных нагрузочных пробах и пробе Форбса, иридовитреальный блок. Противопоказаниями для проведения ЛИЭ служат выраженное помутнение и отек роговицы, щелевидная передняя камера, паралитический мидриаз [5, 6, 9].
Лазерная иридэктомия в классическом виде проводится в зоне от 10 до 14 часов с целью профилактики светорассеяния после операции. Следует выбирать максимально тонкий участок (крипты) радужки и избегать видимых сосудов. При перфорации радужки визуализируется ток жидкости с пигментом в передней камере. Оптимальный размер иридэктомии — 200–300 мкм. Радужка рассекается у корня за 1–3 аппликации. Темные и толстые радужки обычно требуют большей энергии и большего числа аппликаций. Если радужка очень толстая или возможно кровотечение, для предварительной обработки радужки можно применять аргоновый лазер. Цель — добиться сокращения стромы и формирования углубления. Повреждение капсулы хрусталика возможно при превышении мощности в 2 мДж. Рекомендуется использовать минимально возможное количество энергии при достаточной эффективности. Параметры ЛИЭ: мощность 1–6 мДж, диаметр пятна 50–70 μм (константа для каждой модели лазера), количество импульсов 1–7 [9, 26].
На кафедре офтальмологии им. А.П. Нестерова разработана собственная методика ЛИЭ для лечения закрытоугольной глаукомы. В отличие от стандартных методик импульсы наносятся в нижней части радужной оболочки, что обусловлено более выраженной сенильной кератопатией в верхней части радужной оболочки, а также с целью сохранения «хирургического окна» для антиглаукомных операций. В качестве предоперационной подготовки пациента мы применяем пилокарпин, что способствует нанесению импульсов у корня радужной оболочки, снижая риск возникновения двоения зрения после процедуры. Еще одним преимуществом проведения процедуры при узком зрачке является использование лазера меньшей мощности и меньшее количество производимых коагулятов, что способствует минимизации послеоперационных осложнений [5].
Лазерная микроимпульсная иридэктомия проводится в два этапа: коагуляционный и перфорационный, особенности которых перечислены в таблице.
![Таблица. Методы микроимпульсного лазерного лечения глаукомы [5, 6, 19, 25, 26, 32, 33] Table. Micropulse laser treatment options for glaucoma [5, 6, 19, 25, 26, 32, 33] Таблица. Методы микроимпульсного лазерного лечения глаукомы [5, 6, 19, 25, 26, 32, 33] Table. Micropulse laser treatment options for glaucoma [5, 6, 19, 25, 26, 32, 33]](https://medblog.su/wp-content/uploads/2022/11/lazernoe-lechenie-glaukomy-sovremennye-podhody-i-prakticheskie-rekomendatsii-rabadanova-m-g-oganezova-zh-g-egorov-e-a-kats-d-v-novoderezhkin-v-v.png)
Лазерная динамическая диодная транссклеральная циклофотокоагуляция
Диодлазерная транссклеральная циклофотокоагуляция применяется в основном на последних стадиях глаукомы. Воздействие оказывается на цилиарное тело с целью снижения продукции водянистой влаги, что вызывает анальгетический, гипотензивный эффект и позволяет сохранить глазное яблоко как орган. Механизмом, ведущим к снижению ВГД, является деструкция цилиарного эпителия и снижение сосудистой перфузии в цилиарных сосудах, что ведет, в свою очередь, к атрофии цилиарных отростков, увеличению оттока за счет транссклеральной фильтрации или увеасклерального оттока [27–31].
При лазерной динамической микроимпульсной диодной транссклеральной циклофотокоагуляции диодный лазер излучает серию микросекундных повторяющихся импульсов [32, 33]. В качестве интраоперационного метода обезболивания применяется ретробульбарная анестезия. Показания к использованию данного метода представлены в таблице. Метод может применяться также для лечения врожденной глаукомы при остаточных зрительных функциях на глазах с некомпенсированным ВГД. К преимуществам такого вида терапии относятся высокая эффективность (до 70%) и стойкий эффект, значительное снижение ВГД, полное отсутствие коагуляционных повреждений и риска развития субатрофии глазного яблока, отсутствие болевых ощущений у пациента при менее инвазивной анестезии, возможность проведения повторного дополнительного аналогичного сеанса лазерного лечения при недостаточном гипотензивном результате. Параметры лазерного излучения имеют прямую зависимость от исходного уровня ВГД и степени пигментации радужной оболочки. Проведенные недавно исследования подтвердили эффективность и безопасность данного метода лечения рефрактерной глаукомы [34–36].
Сводная характеристика методов микроимпульсного лазерного лечения представлена в таблице.
Предоперационная подготовка и послеоперационная терапия
Успех лазерного лечения глаукомы во многом зависит от адекватной предоперационной подготовки. При выборе конкретного метода лечения важно учитывать наличие сопутствующей соматической патологии, аллергологического анамнеза, обязательным является уточнение у пациента информации обо всех применяемых лекарственных препаратах. Например, при наличии у пациента ревматологического заболевания необходимо системное назначение НПВП (если пациент еще не принимает данную терапию), а при сахарном диабете — ангиопротекторов и антиоксидантов [37, 38]. Одним из важных факторов является уровень ВГД: при высоком ВГД необходима его компенсация с помощью местных гипотензивных препаратов (ингибиторы карбоангидразы, β-адреноблокаторы и их комбинации). Наличие у пациента блефарита, конъюнктивита или синдрома «сухого глаза» является временным противопоказанием к проведению лазерной терапии. Необходима коррекция указанных заболеваний/состояний соответствующими препаратами [39].
В послеоперационном периоде для снижения риска развития и выраженности реактивного синдрома (наиболее частого побочного эффекта лазерного лечения) целесообразно назначение противовоспалительных и антибактериальных препаратов, кератопротекторов и слезозаменителей. Продолжительность послеоперационной терапии определяется индивидуально для каждого пациента.
В своей практической деятельности для профилактики реактивного синдрома мы назначаем за 1 нед. до лазерного вмешательства и на 1 нед. после него НПВП местно. Предпочтение отдаем бромфенаку 0,09% (Накван®) в связи с его обширной доказательной базой эффективности и безопасности, минимальным содержанием консерванта, удобным режимом дозирования (2 р/сут), проникновением в более глубокие структуры глаза по сравнению с другими НПВП [40].
Таким образом, алгоритм ведения пациента с глаукомой, направленного на лазерное лечение, можно представить следующим образом (см. рисунок).
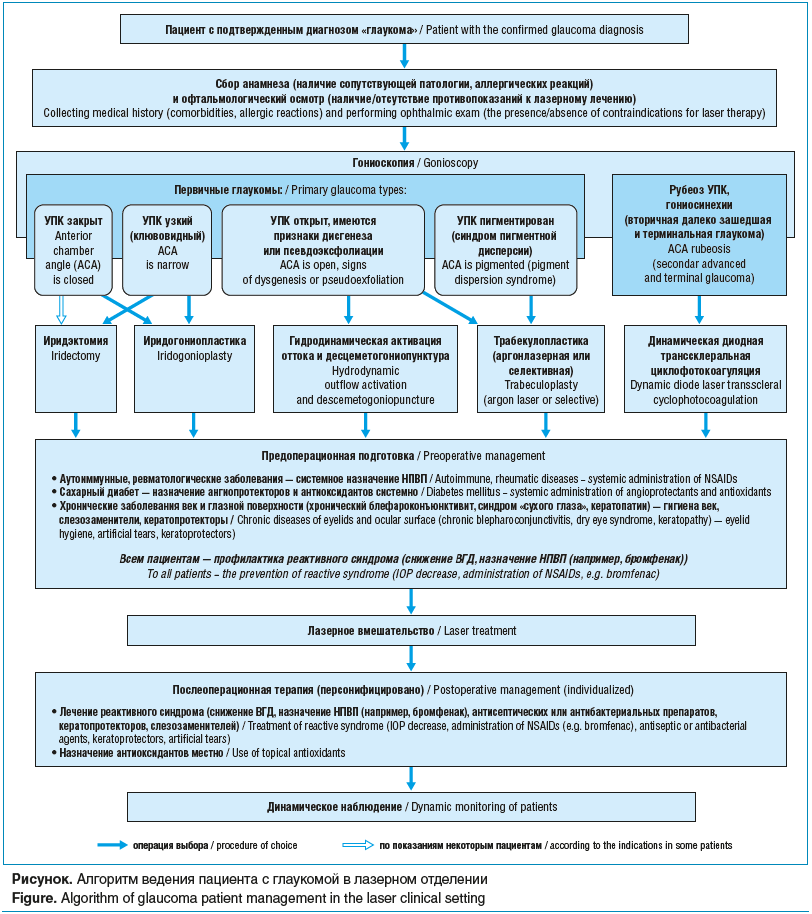
Заключение
Лазерное лечение глаукомы является патогенетически ориентированным, эффективным и безопасным вмешательством при соблюдении адекватных алгоритмов его проведения и своевременности назначения. Для выбора оптимального метода лазерного лечения необходимо понимание устройства лазера и его механизма действия, знание параметров воздействия конкретного типа лазерного излучения. Обязательным исследованием для определения типа лазерного вмешательства для конкретного пациента является гониоскопия. Результат лечения глаукомы с помощью лазерных процедур и длительность эффекта зависят от вида и стадии заболевания, соблюдения протокола операции, возраста пациента, коморбидности и ряда других факторов. Для достижения оптимальных результатов необходима адекватная персонифицированная предоперационная подготовка пациента и послеоперационная терапия. Дальнейшие исследования должны быть направлены на совершенствование имеющихся методик терапии глаукомы, разработку четких интраоперационных алгоритмов лазерного лечения и схем местной и общей фармакотерапии в пред- и послеоперационном периодах для предупреждения возможных осложнений лазерной гипотензивной терапии.
Сведения об авторах:
Рабаданова Мадина Гусейновна — к.м.н., доцент кафедры офтальмологии им. акад. А.П. Нестерова лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; врач-офтальмолог лазерного отделения ГКБ № 15 им. О.М. Филатова ДЗМ; 111539, Россия, г. Москва, ул. Вешняковская, д. 23; ORCID iD 0000-0003-2847-3670.
Оганезова Жанна Григорьевна — к.м.н., доцент кафедры офтальмологии им. акад. А.П. Нестерова лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; доцент кафедры офтальмогенетики Института ВиДПО ФГБНУ «МГНЦ»; 115522, Россия, г. Москва, ул. Москворечье, д. 1; ORCID iD 0000-0002-4437-9070.
Егоров Евгений Алексеевич — д.м.н., профессор, заведующий кафедрой офтальмологии им. акад. А.П. Нестерова лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-6495-7173.
Кац Дмитрий Васильевич — к.м.н., заведующий офтальмологическим отделением ГКБ № 15 им. О.М. Филатова ДЗМ; 111539, Россия, г. Москва, ул. Вешняковская, д. 23; ORCID iD 0000-0003-4768-3892.
Новодережкин Владимир Владимирович — к.м.н., врач-офтальмолог лазерного отделения ГКБ № 15 им. О.М. Филатова ДЗМ; 111539, Россия, г. Москва, ул. Вешняковская, д. 23. Контактная информация: Оганезова Жанна Григорьевна, e-mail: jannaogan@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 05.09.2022.
Поступила после рецензирования 27.09.2022.
Принята в печать 14.10.2022.
About the authors:
Madina H. Rabadanova — C. Sc. (Med.), associate professor of the Academician A.P. Nesterov Department of Ophthalmology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ophthalmologist in the Laser Department, Municipal Clinical Hospital No. 15 named after O.M. Filatov; 23, Veshnyakovskaya str., Moscow, 111539, Russian Federation; ORCID iD 0000-0003-2847-3670.
Janna G. Oganezova — C. Sc. (Med.), associate professor of the Academician A.P. Nesterov Department of Ophthalmology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; associate professor of Department of Ophthalmogenetics of the Institute of Higher and Additional Professional Education, Research Center for Medical Genetics; 1, Moskvorechye str., Moscow, 115522, Russian Federation; ORCID iD 0000-0002-4437-9070.
Evgeniy A. Egorov — Dr. Sc. (Med.), Professor, Head of the Academician A.P. Nesterov Department of Ophthalmology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-6495-7173.
Dmitry V. Katz — C. Sc. (Med.), Chief of Department of Ophthalmology, Municipal Clinical Hospital No. 15 named after O.M. Filatov; 23, Veshnyakovskaya str., Moscow, 111539, Russian Federation; ORCID iD 0000-0003-4768-3892.
Vladimir V. Novoderezhkin — C. Sc. (Med.), ophthalmologist in the Laser Department, Municipal Clinical Hospital No. 15 named after O.M. Filatov; 23, Veshnyakovskaya str., Moscow, 111539, Russian Federation.
Contact information: Janna G. Oganezova, e-mail: jannaogan@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 05.09.2022.
Revised 27.09.2022.
Accepted 14.10.2022.
материал rmj.ru
