Введение
Актуальность проблемы саркопении и саркопенического ожирения (СО) характеризуется их высокой распространенностью среди пациентов с сердечно-сосудистыми заболеваниями (ССЗ). Изначально саркопения рассматривалась преимущественно как гериатрический синдром, связанный со старением и инвалидизацией, однако в последние годы установлено, что саркопенический фенотип встречается и у пациентов среднего возраста, в том числе при наличии ожирения, метаболического синдрома и ССЗ [1, 2].
Термин «саркопеническое ожирение» был впервые предложен в начале 2000-х годов после установления взаимного негативного влияния избытка жировой ткани и дефицита мышечной массы на прогноз [3]. Согласно результатам метаанализа 2024 г. [4] с наибольшим числом участников, составившим более 70 000 человек, СО ассоциируется со значительным повышением риска общей смертности (ОШ 1,21, 95% ДИ 1,10–1,33), сердечно-сосудистых событий, ухудшением гликемического профиля и снижением физической работоспособности.
Критерии СО, согласно Европейскому консенсусу обществ ESPEN и EASO 2022 [1], включают в себя сочетание ожирения (ИМТ≥25 кг/м2), сниженной мышечной силы (по данным кистевой динамометрии) и/или массы (по данным биоимпедансометрии, рентгеновской денситометрии и др.), а также наличие функциональных нарушений или хронических заболеваний.
В клинической практике диагностика СО затруднена вследствие ограниченного доступа к инструментальным методам оценки состава тела, особенно в условиях амбулаторного звена. В этом случае возрастает значение более простых скрининговых методик, таких как опросник SARC-F, тест «сесть/встать» и кистевая динамометрия, которые, в свою очередь, могут служить эффективными инструментами выявления пациентов с СО.
Цель исследования: оценить распространенность СО у пациентов с ССЗ и ИМТ≥25 кг/м2 с помощью доступных методов скрининга.
Содержание статьи
Материал и методы
Дизайн исследования. Выполнено одноцентровое поперечное кросс-секционное скрининговое исследование на базе отделения сердечно-сосудистой патологии, кардиореабилитации и диетотерапии Клиники лечебного питания ФГБУН «ФИЦ питания и биотехнологии».
Критерии включения:
-
возраст от 20 до 80 лет;
-
ИМТ≥25,0 кг/м2 или окружность талии (ОТ) более 80 см у женщин и 94 см у мужчин;
-
наличие хронического ССЗ, включая гипертоническую болезнь, и/или ишемическую болезнь сердца, и/или хроническую сердечную недостаточность.
-
Критерии исключения:
-
наличие острых или хронических заболеваний пищеварительной системы, ассоциированных с нарушением всасывания пищевых веществ, острой саркопении или кахексии;
-
наличие почечной или печеночной недостаточности, острой или хронической в стадии декомпенсации;
-
прохождение химиотерапии, лучевой терапии или срок после хирургического лечения онкологической патологии менее 6 мес.;
-
пациенты, не способные или не желающие выполнять требования протокола, включая подписание информированного согласия (неспособность дать такое согласие из-за умственной недостаточности или языкового барьера), лица, не способные самостоятельно принять решение и подписать информированное согласие;
-
регулярный прием психоактивных веществ;
-
беременность и лактация.
Обследуемая выборка. В исследовании приняли участие 523 пациента с ССЗ и ИМТ≥25кг/м2, мужского пола — 23,9%, женского пола — 76,1%. Средний возраст составил 59,71±12,28 года, мужчины были моложе: 54,75±14,21 года, возраст женщин 61,71±11,12 года (p=0,000).
Методы оценки:
-
антропометрия: масса тела, рост, ИМТ (кг/м2) — проводилась на стандартизированном медицинском оборудовании;
-
опрос: наличие жалоб на функциональные нарушения;
-
опросник SARC-F: суммарный балл ≥4 интерпретировался как повышенный риск саркопении;
-
кистевая динамометрия: силу сжатия кисти измеряли с использованием динамометра электронного ДМЭР-120 (ОАО «Тулиновский приборостроительный завод «ТВЭС», РФ). Выполняли два измерения на ведущей стороне тела; фиксировалось наибольшее значение. В качестве отрезных использовались значения <35,5 даН для мужчин и <20,0 даН для женщин;
-
оценку композиционного состава тела проводили методом биоимпедансометрии (InBody 770 (InBody Co.), Корея) с учетом в том числе доли жировой массы и мышечной массы.
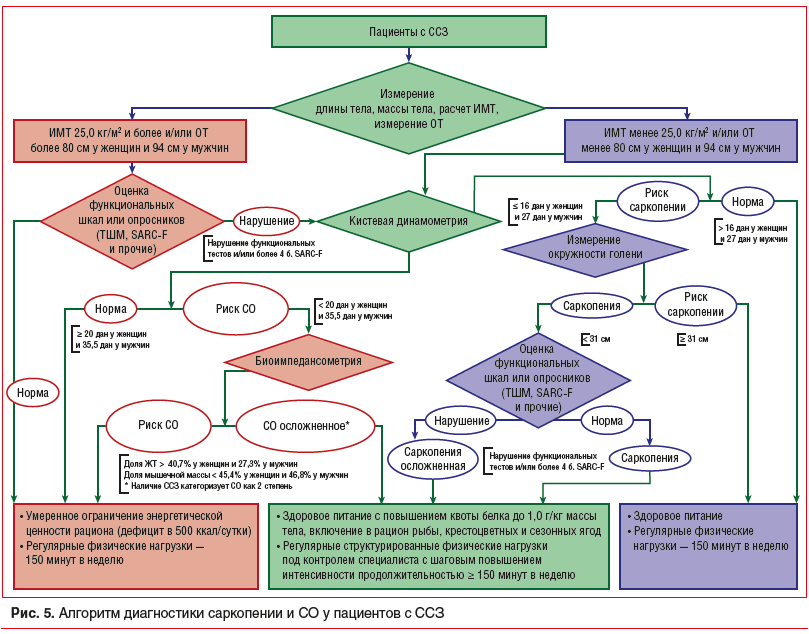
Алгоритм диагностики СО. Диагноз СО устанавливался при наличии избыточной массы тела (ИМТ≥25 кг/м2), функциональных нарушений и/или 4 и более баллов по опроснику SARC-F, сниженной мышечной силы (по данным динамометрии согласно указанным выше пороговым значениям), изменения состава тела (повышение доли жировой ткани более 27,3% у мужчин и 40,7% у женщин и снижение доли мышечной массы менее 31,5% у мужчин и 27% у женщин) (рис. 1).

Учитывая наличие ССЗ у всех участников исследования, все случаи выявленного СО определялись как СО 2-й степени [1].
Статистическая обработка. Статистическая обработка данных проводилась с использованием программы IBM SPSS Statistics 20.0 (SPSS Inc., США). Оценка распределения количественных данных осуществлялась с помощью критерия Колмогорова — Смирнова с поправкой Лиллиефорса. Данные представлены как среднее (М), стандартная ошибка среднего (SEM), стандартное отклонение (SD). Качественные показатели представлены в виде абсолютных и относительных (%) частот. За критический уровень статистической значимости принимались значения ниже 0,05 (p<0,05).
Результаты и обсуждение
Основные результаты скринингового обследования участников представлены в таблице 1. Среди 523 пациентов с ССЗ и ИМТ≥25 кг/м2, принявших участие в исследовании, менее четверти (22,75%, 119 человек) составили мужчины. При этом мужчины были младше женщин, отличались большими значениями роста, массы тела, силы сжатия кисти, жировой массы, мышечной массы и меньшим количеством баллов по SARC-F и меньшей долей жировой массы.
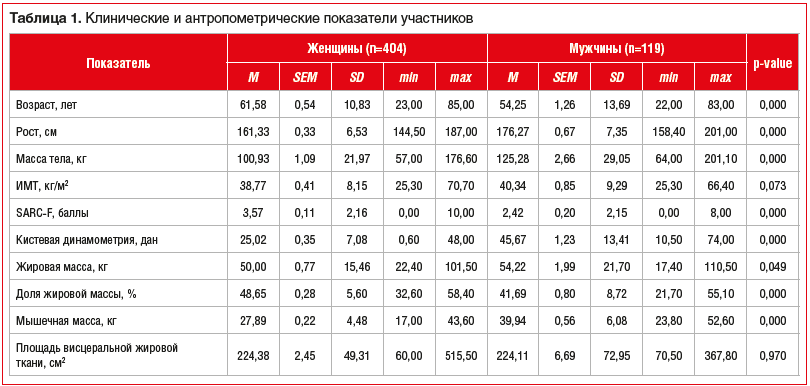
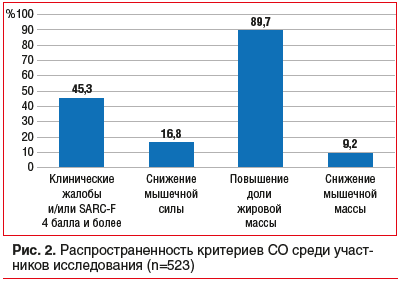
При проведении категориального анализа полученных данных (рис. 2, табл. 2), согласно представленному алгоритму, установлено, что у 9,2% пациентов с ССЗ и избыточной массой тела / ожирением может быть диагностировано СО (рис. 3).
При сравнении различных показателей, применяемых для диагностики СО, между мужчинами и женщинами различия были выявлены только по баллам SARC-F. Среди женщин чаще встречалось снижение физической работоспособности (4 и более балла) (см. табл. 2). Остальные критерии СО, как и его встречаемость среди пациентов с избыточной массой тела, ожирением и ССЗ были сопоставимы между полами, несмотря на то, что абсолютная сила кистевого сжатия была значимо больше у мужчин. Это подчеркивает важность применения различных пороговых значений в зависимости от пола и возраста при проведении динамометрии.
Изменение состава тела (повышение доли жировой ткани более 27,3% у мужчин и 40,7% у женщин и снижение доли мышечной массы менее 31,5% у мужчин и 27% у женщин) имелось у 46,5% пациентов (45,4% мужчин и 46,8% женщин), что свидетельствует о наличии у данной группы пациентов не только функциональных нарушений мышц, но и снижения мышечной массы.
Диагноз СО 2-й степени, который устанавливался по критериям ESPEN/EASO 2022, был подтвержден у 9,2% пациентов, что сопоставимо с результатами других исследований. Например, согласно данным метаанализа N. Veronese et al. [4], средняя распространенность СО во взрослых когортных выборках была от 5 до 17% в зависимости от методов диагностики и возраста популяции. Также при обследовании женщин пожилого возраста с артериальной гипертензией и хронической сердечной недостаточностью встречаемость СО составила 16,8% [5]. Однако стоит учесть, что большинство исследований, посвященных саркопении и СО, касаются популяции лиц пожилого и старческого возраста [6]. Полученные в представленной работе результаты обследования пациентов в возрасте старше 20 лет сопоставимы с результатами других исследований СО, в том числе и с недавней крупномасштабной работой, проведенной в Южной Корее, где распространенность СО среди молодых мужчин составила 9,09% [7]. Таким образом, СО выходит за пределы возраст-ассоциированной патологии и требует своевременной диагностики среди пациентов всех возрастных групп.
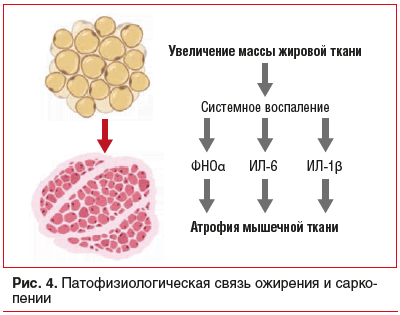
Исследование демонстрирует значимое распространение снижения мышечной силы в популяции людей с ССЗ. Современные научные данные свидетельствуют о наличии патофизиологической связи СО и хронического системного воспаления (рис. 4) [8]. Гипертрофия адипоцитов сопровождается повышенным синтезом адипокинов, активирующих М1-макрофаги и провоспалительные Th1/Th7-лимфоциты. Это реализуется в виде избыточной активации провоспалительных цитокинов, таких как интерлейкин (ИЛ) 1β, ИЛ-6 и фактор некроза опухоли α (ФНО-α) [9]. В свою очередь ИЛ-6 и ФНО-αингибируют работу фосфоинозитид-3-киназы (PI3K), протеинкиназы В (Akt) и протеинкиназы mTOR, подавляя анаболический эффект инсулина и снижая синтез белков в скелетных мышцах [10], что приводит к усугублению воспалительного ответа и снижению функции мышц. Данные процессы также сопровождаются снижением продукции иризина и мионектина, что способствует прогрессированию инсулинорезистентности и дальнейшему накоплению жировой ткани [8]. С точки зрения практикующего врача, выявление даже пограничных форм снижения мышечной силы и/или дефицита мышечной массы у лиц с ССЗ имеет важное клиническое значение. Саркопения и ожирение приводят к значимому ухудшению динамики течения многих заболеваний: артериальной гипертензии, сердечной недостаточности, а также к снижению толерантности к физическим нагрузкам, что значимо ухудшает качество жизни пациентов данной группы и может приводить к преждевременной летальности [11–13]. Особую ценность представляет ранняя диагностика СО среди пациентов молодого возраста, так как помимо повышения риска развития и прогрессирования неинфекционных заболеваний СО ассоциируется с высоким риском раннего биологического старения организма [14].
Дефицит витамина D, по данным литературы, также является одним из важнейших звеньев в патогенезе СО. Данные крупнейшего (более 300 тыс. участников) исследования менделевской рандомизации данных UK Biobank подтвердили причинно-следственную связь между витамином D и здоровьем мышечной ткани [15]. Уровни витамина D, С-реактивного белка, провоспалительных маркеров крови, а также соотношения холестерина липопротеинов высокой плотности (ХС-ЛПВП) с холестерином липопротеинов низкой плотности (ХС-ЛПНП) и креатинина с цистатином С (саркопенический индекс) рассматриваются рядом авторов в качестве дополнительных биомаркеров СО [16]. В данной работе не проводилось оценки лабораторных показателей, что является перспективным направлением для дальнейших исследований. Важно отметить, что повсеместное использование доступных инструментов скрининга, в особенности таких, как кистевая динамометрия, позволяет выявлять пациентов с возможной саркопенией, даже если невозможно проведение инструментальных методов оценки состава тела. Актуальность этого сложно переоценить, так как далеко не всегда есть возможность проводить углубленные исследования, а недиагностированная потеря мышечной силы может сопровождаться неполноценным лечением и ухудшением прогноза [2, 17].
Полученные данные подтверждают большую значимость применения простых и доступных инструментов (динамометрия) для первичной оценки мышечной силы в клинической практике, в том числе среди пациентов молодого возраста. Своевременное выявление СО у лиц с ССЗ позволяет формировать группы повышенного риска и оптимизировать профилактическую и лечебную тактику, особенно в отношении метаболических нарушений и сердечно-сосудистых исходов.
Таким образом, раннее выявление и лечение СО необходимо рассматривать как проблему, которая требует особого внимания. Ее решение позволит повысить качество и ожидаемую продолжительность жизни пациентов с избыточной массой тела / ожирением и ССЗ. В связи с этим с учетом результатов исследований, проведенных на базе ФГБУН «ФИЦ питания и биотехнологии», был разработан алгоритм диагностики и диетической коррекции саркопении и СО у пациентов с ССЗ (рис. 5).
Заключение
Результаты настоящего скринингового исследования демонстрируют высокую распространенность признаков снижения мышечной силы, мышечной массы и СО среди пациентов с ССЗ и ожирением. Почти половина пациентов имели снижение физической работоспособности по опроснику SARC-F и изменения состава тела по данным биоимпедансометрии, а каждый шестой — снижение мышечной силы по данным динамометрии. Диагноз СО 2-й степени был установлен у 9,2% обследованных.
Разработка и внедрение алгоритмов скрининга СО с учетом национальных референтных значений мышечной массы и силы может повысить точность диагностики и способствовать более раннему началу интервенционных мероприятий.
Источник финансирования. Научно-исследовательская работа проведена за счет средств субсидии на выполнение государственного задания, тема № FGMF-2025-0003.
Информация с rmj.ru


