Введение
Сердечно-сосудистые заболевания (ССЗ) остаются ведущей причиной смертности во всем мире и представляют собой существенную нагрузку для систем здравоохранения. Несмотря на значительный прогресс в области неотложной помощи и фармакотерапии, частота повторных сердечно-сосудистых событий остается высокой, при этом на ССЗ приходится около трети всех летальных исходов [1]. В этом контексте вторичная профилактика, в том числе кардиореабилитация (КР), имеющая рекомендацию класса I в клинических руководствах, приобретает ключевое значение для снижения заболеваемости и смертности. КР представляет собой комплексный междисциплинарный подход, направленный на стабилизацию, замедление или частичное замедление прогрессирования ССЗ [2]. Хотя традиционные программы КР ориентированы на физические тренировки, отказ от курения и коррекцию липидного профиля, все больше данных указывает на то, что этих вмешательств недостаточно для достижения целевых показателей. Это обусловливает необходимость более глубокого понимания метаболических и молекулярных механизмов, лежащих в основе ССЗ [3–5].
В последнее десятилетие активно изучается роль дисбиоза кишечного микробиома как фактора риска развития ССЗ [6]. Ось «кишечник — сердце» представляет собой интегрированную систему двунаправленных функциональных, метаболических, нейрогуморальных и иммуновоспалительных взаимодействий между кишечником (прежде всего его микробиотой и эпителиальным барьером) и сердечно‑сосудистой системой (ССС) [7, 8]. В этом контексте кишечный микробиом может рассматриваться как своеобразный орган, превращающий компоненты пищи в биологически активные соединения, способные как поддерживать сердечно‑сосудистый гомеостаз, так и способствовать прогрессированию заболевания [9]. Такой сдвиг парадигмы смещает акцент с количественных характеристик рациона (энергетическася ценность, содержание насыщенных жиров) на качественные молекулярные взаимодействия между пищевыми субстратами и микробным метаболизмом. Ключевую роль в этих процессах играют два функционально противоположных класса метаболитов: триметиламин-N-оксид (ТМАО), образующийся из холина и карнитина, и короткоцепочечные жирные кислоты (КЦЖК), преимущественно формирующиеся в результате бактериальной ферментации пищевых волокон [10].
У пациентов, проходящих программу КР, нередко выявляется выраженный дисбиотический профиль кишечного микробиома, существенно отличающийся от такового у здоровых лиц [11]. Данный тип дисбиоза ассоциирован со снижением микробного разнообразия и характерным метаболическим сдвигом, проявляющимся повышением системного уровня ТМАО и снижением продукции КЦЖК [12]. Подобная «метаболическая дезадаптация» указывает на то, что успешная вторичная профилактика ССЗ должна включать не только восстановление функциональных возможностей организма, но и целенаправленную коррекцию дисбиотических изменений кишечной микросреды [13].
В данной публикации приведены обобщенные данные о том, как диетические вмешательства, модулирующие соотношение ТМАО/КЦЖК и метаболическое равновесие кишечного микробиома, могут быть интегрированы в программы КР для улучшения долгосрочных клинических исходов.
Молекулярные механизмы опосредованного ремоделирования миокарда
Триметиламин‑N‑оксид
Неблагоприятное воздействие кишечного микробиома на ССС в значительной степени опосредовано ТМАО — стабильным аминоксидом с выраженными проатерогенными свойствами, выступающим в роли метаболического медиатора в сосудистой стенке [14]. Биосинтез ТМАО инициируется поступлением пищевых веществ, богатых четвертичными аммонийными соединениями, прежде всего холина, L-карнитина и фосфатидилхолина, которые в повышенных концентрациях содержатся в красном мясе, яйцах и жирных молочных продуктах [15].
В дистальных отделах кишечника эти соединения подвергаются деградации под действием специализированных микробных ферментов, преимущественно холинлиаз CutC/D и карнитиноксидазного комплекса CntA/B, с образованием триметиламина (ТМА). Последний всасывается в воротный кровоток и поступает в печень, где подвергается быстрой оксидации флавинсодержащими монооксигеназами, главным образом изоформой FMO3, с формированием ТМАО [16]. Зависимость данного этапа от активности фермента FMO3 подчеркивает значимость генетических, гормональных и метаболических факторов хозяина, включая полиморфизмы гена FMO3, особенности эндокринного статуса и наличие инсулинорезистентности [17, 18].
Попадая в системный кровоток, ТМАО оказывает многоуровневое воздействие, способствуя атерогенезу и прогрессированию сердечной недостаточности. На уровне эндотелия он активирует сигнальный путь NF-κB и снижает биодоступность оксида азота, что ускоряет развитие эндотелиальной дисфункции и усиливает адгезию лейкоцитов [19, 20]. Одновременно ТМАО стимулирует экспрессию рецепторов CD36 и SR-A1 на макрофагах, что приводит к накоплению окисленных липопротеинов низкой плотности и образованию пенистых клеток — ключевого признака раннего атерогенеза [14, 21]. Кроме того, ТМАО обладает протромботическими свойствами, усиливая реактивность тромбоцитов за счет повышения внутриклеточной концентрации кальция и увеличения их чувствительности к агрегационным стимулам [22]. В условиях сердечной недостаточности повышенные уровни ТМАО ассоциированы с неблагоприятным ремоделированием и фиброзом миокарда вследствие активации сигнального пути TGF-β/Smad3, что приводит к повышению жесткости экстрацеллюлярного матрикса и нарушению диастолической функции [23].
Содержание статьи
Короткоцепочечные жирные кислоты
В противоположность ТМАО, КЦЖК выполняют протективную функцию в рамках оси «кишечник — сердце», формируя противовес провоспалительным и проатерогенным эффектам. Их продукция осуществляется в результате анаэробной микробной ферментации неусвояемых полисахаридов — растворимых и нерастворимых пищевых волокон с образованием ацетата, пропионата и бутирата [24]. Бутират рассматривается как один из основных энергетических субстратов для колоноцитов, тогда как ацетат и пропионат преимущественно поступают в системный кровоток, где могут оказывать метаболическое и иммуномодулирующее влияние на периферические ткани. Концентрация и соотношение КЦЖК в значительной степени зависят от состава микробиоты и доступности субстратов с пищей [25, 26]. Кардиопротективные эффекты КЦЖК реализуются посредством активации рецепторов, сопряженных с G-белком, в частности GPR41 (FFAR3) и GPR43 (FFAR2), экспрессируемых в эндотелии, жировой ткани и иммунных клетках. Это приводит к модуляции секреции ренина и снижению активности симпатической нервной системы, способствуя регуляции артериального давления [27–29]. Кроме того, бутират и другие КЦЖК ингибируют активность гистондеацетилаз, обеспечивая эпигенетическое подавление экспрессии провоспалительных цитокинов, включая интерлейкин 6 и интерлейкин 12, тем самым снижая выраженность хронического системного воспаления [30]. Важным механизмом кардиопротекции является также укрепление кишечного эпителиального барьера. КЦЖК повышают экспрессию белков плотных контактов, включая окклюдин и зонулин, что препятствует развитию повышенной кишечной проницаемости и транслокации липополисахаридов в системный кровоток [31].
Таким образом, КЦЖК обеспечивают многоуровневую защиту ССС от поддержания гомеостаза кишечного барьера до модуляции воспалительных и фибротических процессов в миокарде.
Питание как модификатор метаболизма кишечной микробиоты
Питание является ключевым детерминантом микробного метаболизма в кишечнике, определяя спектр и интенсивность образования КЦЖК и TMAO через изменение доступных субстратов и структуры микробиоценоза [32]. Средиземноморская диета рассматривается как «золотой стандарт» диетического вмешательства в КР не только благодаря выраженному гиполипидемическому эффекту, но и вследствие способности модулировать кишечный метаболизм в направлении кардиопротективного профиля [33]. Эффективность средиземноморской диеты обусловлена ее уникальным составом макронутриентов, богатым сложными углеводами, полифенолами и ненасыщенными жирными кислотами, которые селективно стимулируют рост сахаролитических бактерий. В частности, строгая приверженность такой диете устойчиво ассоциируется с увеличением численности Faecalibacterium prausnitzii — ключевого продуцента бутирата, основной КЦЖК [34]. Высокое содержание пищевых волокон и полифенолов в рационе создает благоприятную экосистему для бактерий — продуцентов КЦЖК, действуя как пребиотический субстрат и подавляя рост патогенных и протеолитических таксонов [35]. Одновременно средеземноморский тип питания ограничивает поступление предшественников синтеза ТМАО. Снижение потребления красного мяса (основного источника L-карнитина) и яиц (богатых холином) уменьшает доступность субстрата для микробной продукции триметиламина [36] (см. табл.). Клинические данные демонстрируют, что данное ограничение коррелирует со значительно более низкими уровнями ТМАО в плазме у приверженцев средиземноморской диеты по сравнению с лицами с «западным» типом питания, что указывает на целевую депривацию проатерогенного метаболического пути на фоне одновременной стимуляции благоприятной сахаролитической ферментации [37].

Потребление неперевариваемых пищевых волокон, пектина и инулина находится в прямой дозозависимой связи с концентрациями ацетата, пропионата и бутирата в системном кровотоке [38]. Предполагается, что данный эффект связан с механизмом «переключения субстрата»: при достаточном поступлении пищевых волокон микробный метаболизм смещается от преимущественно протеолитической ферментации (с образованием аммиака, фенольных соединений и разветвленных жирных кислот) к преимущественно сахаролитической. Такой сдвиг ассоциирован с увеличением продукции КЦЖК и относительным снижением активности протеолитических микроорганизмов, участвующих в образовании ТМАО, что, в свою очередь, может способствовать уменьшению синтеза ТМАО [39, 40]. В исследовании с быстрым чередованием средиземноморской и «западной» диеты у здоровых добровольцев было продемонстрировано, что уровни микробных метаболитов (включая КЦЖК) реагируют в течение нескольких дней, а изменения в значительной степени обратимы при возвращении к исходному рациону [41].
Короткоцепочечные жирные кислоты и ТМАО в контексте КР
В контексте реабилитационных программ высокий исходный уровень ТМАО может отражать наличие метаболической резистентности к стандартным дието-логическим вмешательствам. У пациентов с высоким уровнем ТМАО часто выявляются признаки дисбиоза кишечной микробиоты, сопровождающегося повышенной провоспалительной активностью, что способно ослаблять сосудистую адаптацию и вегетативную регуляцию, индуцируемую регулярными физическими тренировками [42, 43]. Идентификация таких пациентов на ранних этапах КР обосновывает внедрение различных диетологических стратегий, включая строгое ограничение пищевых источников карнитина и холина, а также целевое применение пребиотических субстратов [44]. Подобный подход позволяет индивидуализировать траекторию реабилитации и преодолевать феномен метаболической инертности, который в условиях стандартных рекомендаций может оставаться нераспознанным.
Интеграция метаболомного анализа в клиническую практику формирует принципиально новый подход к стратификации риска у пациентов, участвующих в программах КР [45]. Повышенный уровень ТМАО в плазме крови стабильно рассматривается как независимый предиктор неблагоприятных сердечно-сосудистых исходов, включая инфаркт миокарда, инсульт и смерть, даже после статистической коррекции традиционных факторов риска [46].
В отличие от ТМАО, КЦЖК в настоящее время все чаще рассматриваются как положительные метаболические маркеры функционального восстановления и физической работоспособности [47]. Эффективность КР в значительной степени определяется улучшением функциональной емкости организма, в частности повышением пикового потребления кислорода (VO2 max), и накапливающиеся данные указывают на прямую связь между концентрацией циркулирующих КЦЖК и биоэнергетическим потенциалом скелетной мускулатуры [48]. Бутират и ацетат, являясь ключевыми представителями КЦЖК, способствуют усилению митохондриальной функции и активации процессов окислительного фосфорилирования в мышечных волокнах, тем самым повышая энергетическую эффективность при продолжительной физической нагрузке [49, 50].
В экспериментальных моделях in vivo, а также по данным клинических наблюдений установлено, что повышенные уровни КЦЖК ассоциированы с усиленной экспрессией коактиватора 1α рецептора, активируемого пролифератором пероксисом γ (PGC-1α), являющегося центральным регулятором митохондриального биогенеза [51, 52]. В результате у пациентов, характеризующихся стабильным преобладанием бактерий — продуцентов КЦЖК, отмечаются более высокая толерантность к физической нагрузке и снижение степени мышечной утомляемости в ходе программ реабилитации [53]. Эти данные подкрепляют концепцию «оси кишечник — мышцы», согласно которой направленное воздействие на микробиом посредством питания способно потенцировать физиологические эффекты лечебных физических тренировок и трансформировать микробиоту в функциональный эргогенный фактор восстановления у пациентов с сердечно-сосудистой патологией [54, 55].
С учетом антагонистических физиологических эффектов ТМАО и КЦЖК их соотношение (TMAO/КЦЖК) представляется многообещающим интегративным биомаркером для мониторинга эффективности терапевтических вмешательств и прогнозирования долгосрочного исхода [56]. Повышенное значение отношения TMAO/КЦЖК может интерпретироваться как маркер «двойного удара», сочетающего усиленную проатерогенную сигнализацию и подавление противовоспалительного потенциала. Последовательный мониторинг этого показателя в ходе КР может выполнять по меньшей мере две ключевые функции: во-первых, служить объективным индикатором соблюдения диетических рекомендаций, поскольку он чувствителен к изменению потребления пищевых волокон и продуктов животного происхождения; во-вторых, выступать в качестве прогностического маркера развития серьезных неблагоприятных сердечно-сосудистых событий (MACE) [57, 58].
Несмотря на очевидную перспективность диетологической модуляции оси «кишечник — сердце», существенным ограничением современных программ терапии остается их опора на универсальные рекомендации по питанию. Традиционные подходы, ориентированные на снижение потребления насыщенных жиров и увеличение потребления пищевых волокон, в значительной степени игнорируют выраженную межиндивидуальную вариабельность микробиомного состава, определяющую характер метаболизма пищевых субстратов [63]. Данный феномен может частично объяснять явление «отсутствия ответа» на стандартные диетические вмешательства, когда идентичные рекомендации приводят к принципиально различным метаболическим результатам у разных пациентов. Так, биосинтез ТМАО из карнитина зависит от наличия в микробиоте специфических таксонов, экспрессирующих гены кластера cntA/B. У лиц, лишенных этих функциональных микробных групп, употребление красного мяса не сопровождается сопоставимым увеличением уровня ТМАО, что, в свою очередь, снижает клиническую значимость строгого ограничения данных продуктов именно в этой подгруппе [64, 65].
В связи с этим дальнейшее развитие КР должно быть ориентировано на внедрение персонализированных диетологических стратегий, основанных на результатах метагеномного секвенирования микробиоты и функциональном профилировании ее метаболического потенциала. Определение индивидуального «энтеротипа», характеризующегося, например, доминированием родов Prevotella или Bacteroides, может позволить прогнозировать метаболический ответ пациента на различные источники пищевых волокон и белка [66]. Включение микробиом-основанной стратификации в стандартные протоколы оценки пациентов, проходящих КР, представляет собой качественно новый этап развития персонализированной вторичной профилактики ССЗ (см. рис.).
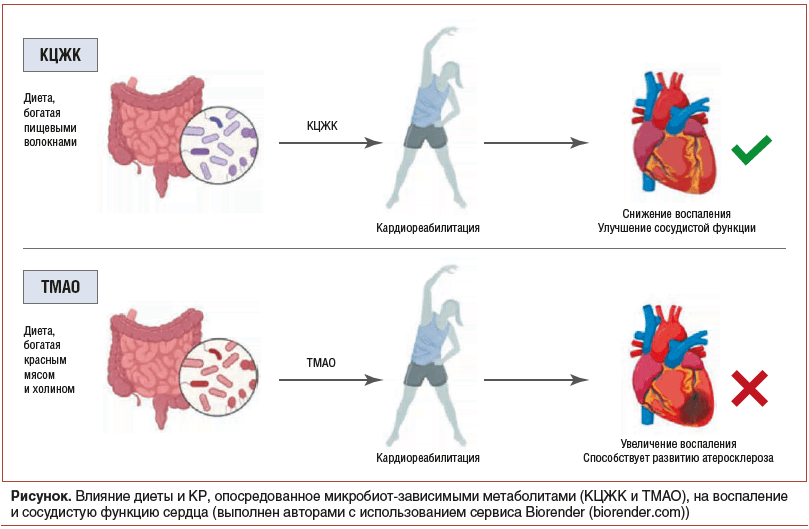
С учетом того, что изолированные диетические вмешательства не всегда оказываются достаточными для коррекции выраженного дисбиоза, особенно у лиц пожилого возраста или пациентов, получающих комплексную медикаментозную терапию, перспективным направлением считается использование синбиотических препаратов, сочетающих пробиотики и пребиотики [67]. В то время как диета обеспечивает микробиоту питательными веществами, пробиотические микроорганизмы способны восполнять утраченные функциональные звенья дисбиотической экосистемы [68]. Ряд исследований указывает на потенциальную эффективность таких штаммов, как Lactobacillus rhamnosus и Bifidobacterium animalis, обладающих способностью к колонизации кишечника и активной регуляции метаболических процессов. Некоторые из них демонстрируют активность гидролазы желчных солей, что может способствовать снижению уровня холестерина в плазме, в то время как другие способны вытеснять бактерии — продуценты ТМА за счет механизмов конкурентного исключения [69–71].
Концепция «синбиотической терапии» в контексте КР предполагает применение комплексного «метаболического коктейля», включающего диету, обогащенную пребиотическими волокнами, в сочетании с целевыми пробиотическими штаммами, направленными на усиление продукции КЦЖК и снижение образования ТМАО [72]. В частности, восполнение дефицита Faecalibacterium prausnitzii — одного из ключевых продуцентов бутирата, численность которого часто снижена при ССЗ, в комбинации с потреблением неперевариваемых пищевых волокон, теоретически способно ускорить восстановление противовоспалительного и метаболически благоприятного профиля кишечной микробиоты [73]. Дополнительным инновационным направлением является разработка так называемых «археобиотиков» — использование метаногенных архей для утилизации ТМА с образованием инертного метана до его всасывания в системный кровоток [74]. Исследование данных комбинированных стратегий в рамках структурированных программ КР может сформировать мощный мультимодальный инструментарий для снижения остаточного метаболического риска и улучшения долгосрочного прогноза у пациентов с ССЗ.
Заключение
Накопленные данные убедительно свидетельствуют о том, что дисбаланс между проатерогенным ТМАО и кардиопротективными КЦЖК представляет собой модифицируемый фактор риска, который может быть скорректирован посредством целенаправленных диетологических вмешательств в рамках программ КР. Дальнейший прогресс в данной области связан с переходом от универсальных рекомендаций к персонализированным стратегиям, основанным на индивидуальном профиле кишечной микробиоты, что позволит повысить эффективность вторичной профилактики и оптимизировать долгосрочный прогноз у пациентов с ССЗ.
Источник финансирования. Научно-исследовательская работа по подготовке рукописи проведена за счет средств субсидии на выполнение государственного задания, тема № FGMF-2025-0003.
Информация с rmj.ru


