Введение
Двигательная функция желудочно-кишечного тракта (ЖКТ) — важная составляющая пищеварительного процесса, обеспечивающая захват пищи, ее механическую обработку и продвижение. Замедление моторики ЖКТ, в том числе его верхних отделов, представляет собой значимую клиническую проблему, оказывающую серьезное влияние на качество жизни пациентов ввиду прямой взаимосвязи с развитием симптомов диспепсического характера, таких как боль и дискомфорт в эпигастрии, чувство переполнения, раннее насыщение, тошнота и рвота, а также изжога и отрыжка [1].
Содержание статьи
Моторная функция верхних отделов ЖКТ
В норме акт проглатывания пищи представляет активную cкоординированную деятельность сфинктеров и стенки пищевода. Пищевой комок поступает в просвет пищевода при расслаблении верхнего пищеводного сфинктера, после чего инициируется первая перистальтическая волна. Через 0,5 с после глотка начинается расслабление нижнего пищеводного сфинктера (НПС) длительностью от 7 до 12 с — за это время пища поступает в желудок. Каждый раз после прохождения пищи НПС плотно закрывается, препятствуя рефлюксу желудочного содержимого [2]. Далее начинается фаза адаптивного расслабления желудка, которая запускается в ответ на механическое растяжение его стенок поступающей пищей и продолжается от нескольких минут до нескольких часов [3, 4]. В дистальной части тела и антральном отделе желудка возникают перистальтические волны, приводящие к перемешиванию и измельчению содержимого желудка. Затем эти волны появляются в двенадцатиперстной кишке (ДПК) — сначала слабые, они усиливаются при поступлении содержимого желудка маленькими порциями через пилорический сфинктер. Перистальтические волны ДПК возникают координированно с деятельностью антрально-пилорической зоны — эта синхронизация называется антродуоденальной координацией [5]. Нормальную моторику также поддерживают медленные волны деполяризации, источником которых являются клетки Кахаля, регулирующие ритм и последовательность двигательной активности желудка [6].
Нарушение моторной функции верхних отделов пищеварительного тракта является одним из ведущих механизмов развития симптомов диспепсического характера и выступает важным патогенетическим фактором таких заболеваний, как гастроэзофагеальная рефлюксная болезнь (ГЭРБ), диспепсия функционального или органического характера. Этот факт подтверждают данные метаанализа, показавшего, что замедленное опорожнение желудка ассоциировано с повышением риска возникновения тошноты, рвоты и боли в эпигастрии [7–9]. Также, по данным опроса 205 врачей-терапевтов амбулаторного звена из 33 городов России, каждый второй пациент с жалобами на гастроэнтерологические симптомы испытывает проявления замедленной моторики желудка: тяжесть в эпигастральной области, боль в эпигастрии, тошноту, раннее насыщение [10].
Нарушение моторики верхних отделов ЖКТ в патогенезе ГЭРБ
На сегодняшний день одной из наиболее частых причин посещения пациентами поликлиники является ГЭРБ. Согласно определению Российской гастроэнтерологической ассоциации ГЭРБ — это хроническое заболевание, характеризующееся первичным нарушением моторно-эвакуаторной функции верхних отделов ЖКТ, функции пищеводно-желудочного перехода и наличием патологического гастроэзофагеального рефлюкса. Вследствие патологического воздействия гастроэзофагеального рефлюктата на слизистую оболочку пищевода развивается соответствующая клиническая симптоматика, а при длительном воздействии в многослойном плоском эпителии могут развиваться воспалительные, дистрофические, эрозивно-язвенные и метапластические изменения [11]. По данным крупного российского метаанализа 6 исследований с участием 34 192 человек, обобщенная распространенность ГЭРБ (частота изжоги и/или регургитации 1 раз в неделю и чаще) составила 25,6% (95% доверительный интервал (ДИ) 17,9–34,1) [12].
К числу основных патогенетических факторов возникновения ГЭРБ относятся [13–15]:
нарушение антирефлюксного барьера;
замедление клиренса пищевода, как объемного, так и химического;
наличие патологических рефлюксов — кислых и некислых (слабокислых и слабощелочных);
снижение резистентности слизистой оболочки пищевода к повреждающим агентам.
Нарушение антирефлюксного барьера преимущественно реализуется за счет снижения тонуса НПС, учащения и удлинения преходящих расслаблений НПС (ПРНПС). ПРНПС контролируются ваговагальным рефлексом и реализуются через проводящие пути, которые опосредуют перистальтику пищевода и расслабление НПС. Механорецепторы верхней части желудка реагируют на повышение давления внутри органа и далее передают сигналы в задний мозг по афферентным волокнам блуждающего нерва, где происходит формирование структурированных моторных программ ПРНПС, по нисходящим путям достигающих НПС [16]. Таким образом, увеличение частоты ПРНПС и снижение его базального тонуса происходят под влиянием оксида азота и вазоактивного интестинального пептида (VIP), нарушенной вагусной регуляции [17]. Важно отметить, что в большинстве случаев эпизоды рефлюкса при ГЭРБ возникают преимущественно во время ПРНПС.
Грыжа пищеводного отверстия диафрагмы (ГПОД), выявляемая у части пациентов, является дополнительным фактором несостоятельности антирефлюксного барьера: НПС смещается из зоны высокого внутрибрюшного давления в зону низкого внутригрудного [11]. Вследствие этого происходит разобщение внутреннего и наружного компонентов антирефлюксного барьера, что также нарушает его нормальное функционирование. При ГПОД нарушен пищеводный клиренс, происходит увеличение частоты ПРНПС и формирование «кислотного кармана» [18].
Защитный механизм, представленный пищеводным клиренсом, устраняет изменения интраэзофагеального рН в сторону как низких (<4), так и высоких показателей. Очищение пищевода происходит за счет объемного и химического клиренса, включающих двигательную активность и саливацию соответственно, а нарушения этих звеньев способствуют снижению клиренса пищевода от попавшего в него кислого или щелочного содержимого [11].
Основные составляющие патологического рефлюктата у пациентов с ГЭРБ представлены соляной кислотой и пепсином, а у части пациентов с сопутствующим дуоденогастральным рефлюксом — также желчными кислотами, трипсином и лизолецитином. Среди них именно соляная кислота играет ключевую роль в возникновении клинических симптомов (в особенности изжоги), эндоскопических и морфологических изменений. За последние годы появилось большое количество данных, свидетельствующих о роли дуоденогастроэзофагеального рефлюкса (ДГЭР) в повреждении слизистой оболочки пищевода. Недостаточность сфинктерного аппарата ЖКТ, нарушения запирательной способности привратника, повышенное интрадуоденальное давление, антродуоденальная дисмоторика, а также агрессивный рефлюктат могут провоцировать развитие ДГЭР [19]. В такой ситуации патогенетическое значение приобретают панкреатические ферменты, желчные кислоты, воздействующие на слизистую оболочку желудка, пищевода и ротовой полости, что приводит к разрушению защитного муцинового барьера. Повреждение желчными кислотами рефлюктата мембран клеток эпителия повышает чувствительность клеток к факторам агрессии — соляной кислоте, пепсину. Смешанный рефлюктат вызывает более выраженное повреждение слизистой оболочки пищевода и желудка за счет синергетического действия кислоты, пепсина, ферментов и желчи, повышая риски развития эрозивного эзофагита, пищевода Барретта и аденокарциномы. Также необходимо принять во внимание, что сопутствующий ДГЭР у пациентов с ГЭРБ ухудшает течение заболевания и дальнейший прогноз [20, 21].
Таким образом, нарушение моторики верхних отделов ЖКТ играет значимую роль в патогенезе ГЭРБ, так как создает условия для контакта агрессивного желудочного содержимого со слизистой оболочкой пищевода, возникновения морфологических изменений и клинических проявлений болезни [22].
Также у части пациентов с ГЭРБ присутствует феномен висцеральной гиперчувствительности, который влияет на развитие нарушений моторики и объясняет перекрест ГЭРБ с функциональными расстройствами ЖКТ [18].
Нарушение моторики верхних отделов ЖКТ в патогенезе синдрома диспепсии
Симптомы диспепсии, такие как боль, жжение, чувство переполнения в эпигастрии после еды и раннее насыщение, часто встречаются в амбулаторной практике — на их долю приходится 20–40% всех гастроэнтерологических жалоб, с которыми пациенты обращаются к врачам общей практики и гастроэнтерологам [23–25]. Вместе с тем выявление причины диспепсии во время первичного осмотра является сложной клинической задачей ввиду широкого круга заболеваний, которые могут вызывать данную симптоматику. Дальнейшее дообследование пациентов позволяет выявить органическую (вторичную) или функциональную причину беспокоящего состояния.
Вторичную диспепсию диагностируют в случае выявления органических заболеваний пищеварительной системы: например, хронического гастрита (ХГ), язвенной болезни желудка и ДПК, хронического панкреатита, заболеваний желчевыводящих путей, различных новообразований [26, 27].
Хронический гастрит — группа заболеваний, развивающихся вследствие различных причин и морфологически характеризующихся воспалением и дистрофическими изменениями слизистой оболочки желудка [28, 29]. Несмотря на то, что ХГ является морфологическим диагнозом, у части больных развиваются диспепсические симптомы, которые могут быть связаны с различными патофизиологическими процессами. Так, у ряда пациентов симптомы диспепсии ассоциированы с инфицированием H. pylori — в этом случае после эрадикационной терапии отмечается их стойкое исчезновение [30]. Присутствующее при гастрите нарушение моторики желудка может быть ассоциировано с воспалением слизистой оболочки, которое запускает цепочку реакций: от нарушения функции интерстициальных клеток Кахаля и гладких мышц до нарушения баланса секреции гастрина и соматостатина и активации макрофагов-резидентов в стенке желудка, тучных клеток и сенсорных нейронов [31–33]. Наряду с этим интерес представляют данные отечественного исследования, продемонстрировавшие, что нарушение эвакуаторной функции желудка имеют 90% пациентов с хроническим атрофическим гастритом и 80,6% пациентов с хроническим неатрофическим гастритом [34], что позволяет сделать вывод о значимой роли нарушений моторики верхних отделов ЖКТ в патогенезе диспепсических жалоб у данной категории пациентов.
Еще одна распространенная нозология, на долю которой приходится до 22% случаев ХГ и этиология которой тесно связана с моторными нарушениями, — билиарный гастрит. При этом вопросы подхода к диагностике и подбору персонализированной терапии для данного заболевания остаются дискутабельными [35]. При билиарном гастрите происходит повреждение слизистой оболочки желудка вследствие повторяющегося заброса в него содержимого ДПК, включая желчь и панкреатические ферменты. К факторам риска относятся желчнокаменная болезнь, анатомические изменения в зоне дуоденогастрального перехода, а также моторные нарушения верхних отделов пищеварительного тракта. Моторная дисфункция гастродуоденальной области и сфинктерного аппарата может приводить к развитию некоординированной антродуоденальной моторики, что в результате создает предпосылки для заброса дуоденального содержимого в полость желудка.
В отличие от ХГ, функциональная диспепсия (ФД) является клиническим диагнозом, в основе которого лежит комплекс симптомов: боли и чувство жжения в эпигастрии, ощущение переполнения после еды и раннее насыщение в течение последних 3 мес. при общей продолжительности не менее 6 мес., которые не могут быть объяснены органическими заболеваниями [36]. Согласно эпидемиологическим данным распространенность ФД в западной популяции составляет 9,8–20,2%, в восточной — 5,3–12,8%. Вместе с тем, несмотря на существенное снижение качества жизни у пациентов с ФД, к врачу обращается лишь каждый второй — четвертый пациент с данным состоянием [37, 38].
Патогенез диспепсии функционального генеза является сложным многофакторным процессом, центральное место в формировании которого занимают нарушения моторики [39–41]. Так, у 40–60% больных с ФД отмечается снижение способности фундального отдела желудка к расслаблению после приема пищи — нарушение аккомодации. Это приводит к быстрому попаданию пищи в антральный отдел желудка, его растяжению и появлению чувства раннего насыщения [38]. Данный процесс опосредован как блуждающим нервом, так и внутренней нитрергической активностью нейронов с участием оксида азота [42]. У 36–66% пациентов с ФД обнаруживают нарушения миоэлектрической активности желудка, кроме того, фиксируют ослабление моторики антрального отдела желудка, нарушения антродуоденальной координации, которые, в свою очередь, приводят к замедлению опорожнения желудка и появлению чувства переполнения в эпигастрии [38]. В основе развития нарушений координации антродуоденальной моторики лежит нарушение согласованной работы сенсорной системы ЖКТ, центральных и энтеральных нейронных сетей и моторных звеньев — интерстициальных клеток Кахаля [6].
Важное место в патогенезе ФД занимает висцеральная гиперчувствительность, которую выявляют у 34–65% больных и которая взаимосвязана с выраженностью симптомов диспепсии — так, у данной категории пациентов боли в эпигастральной области возникают при значительно меньшем повышении внутрижелудочного давления, чем у здоровых [38].
На скорость опорожнения желудка оказывает влияние и химический состав химуса. К примеру, если химус слишком кислый, выделяется секретин и, как следствие, происходит замедление опорожнения желудка, при этом снижается выработка желудочного сока и увеличивается секреция щелочного панкреатического сока в ДПК. Если содержание жиров в химусе слишком велико, выделяется холецистокинин, который стимулирует сокращение желчного пузыря и выделение желчи в ДПК, что также замедляет опорожнение желудка. Если содержание аминокислот в химусе слишком велико, выделяется гастрин, который усиливает сокращение пилорического сфинктера и моторику желудка и в целом замедляет его опорожнение. Гипертонический химус распознается осморецепторами ДПК и также замедляет опорожнение желудка [43].
Вышеописанные нарушения моторики желудка приводят к возникновению характерных для ФД симптомов, которые могут быть объединены в два подтипа: постпрандиальный дистресс-синдром (ППДС) и синдром эпигастральной боли (СЭБ) [44]. В недавнем исследовании, включавшем 54 127 респондентов из 26 стран мира, было отмечено, что глобальная распространенность ФД, определяемой в соответствии с Римскими критериями IV пересмотра, составила 7,2% (диапазон от 2,2 до 12,3%), встречалась значительно выше у женщин и снижалась с возрастом. Наиболее часто был диагностирован ППДС — у 66,6%. При этом функциональная изжога и хроническая тошнота и рвота были выявлены у 9,0 и 7,0% пациентов соответственно [45].
С учетом значительного бремени диспепсии, в том числе и ее функционального варианта, одним из ключевых аспектов является не только своевременная постановка диагноза, но и ведение пациента с возможностью эмпирического подбора подходящей терапевтической схемы уже при первом обращении, до завершения диагностического поиска.
Диагностические мероприятия при моторных нарушениях верхних отделов ЖКТ
Наличие широкого спектра заболеваний, которые могут проявляться диспепсией, подчас затрудняет проведение быстрого дифференциально-диагностического поиска [10]. Клинические проявления расстройств моторики верхних отделов ЖКТ также неспецифичны — на основании данных анамнеза можно предположить различную этиологию, в том числе воспалительного или злокачественного генеза. Например, боль в эпигастрии, чувство быстрого насыщения и переполнения после еды могут быть связаны как с ФД, так и с язвенной болезнью желудка, ДПК или раком желудка [8]. Поэтому важно исключать органическую природу жалоб с помощью соответствующих исследований, таких как эзофагогастродуоденоскопия (ЭГДС), неинвазивное исследование моторики и лабораторные исследования, в том числе тестирование на наличие инфекции H. pylori [8, 10].
В большинстве международных консенсусов ЭГДС обязательна при наличии «красных флагов», к которым можно отнести: диспепсию постоянного или прогрессирующего характера; возникновение симптомов после 45 лет; дисфагию; повторную рвоту; рвоту с кровью; мелену, гематохезис; лихорадку; необъяснимое снижение массы тела (5% и более за 6 мес.); ночные симптомы, вызывающие пробуждение; отягощенный семейный анамнез по онкологическим заболеваниям [46]. Вместе с тем Российская гастроэнтерологическая ассоциация предлагает единый подход к ведению пациентов с симптомами диспепсии: проведение ЭГДС показано всем пациентам с необследованной диспепсией, в том числе лицам молодого возраста без симптомов тревоги. По мнению экспертов, это способствует своевременному выявлению и лечению органической патологии [10, 11].
Основной целью эндоскопического исследования является выявление структурных изменений пищевода, желудка и ДПК. Однако в ряде случаев можно идентифицировать признаки, которые с высокой долей вероятности характеризуют и нарушения моторно-эвакуаторной функции [47]. Так, при соблюдении правил подготовки к исследованию обнаружение остатков пищи в просвете желудка в отсутствие рубцово-стенозирующих изменений может свидетельствовать о гастропарезе — подобная картина встречается в 27% случаев заболевания [48]. У пациентов с ГЭРБ и ФД нередко можно обнаружить эндоскопические признаки дуоденогастрального рефлюкса (ДГР). Однако при исследовании не всегда можно отличить патологический ДГР от физиологического, который возникает в ранние утренние часы, на фоне длительного голодания, а также на фоне инвазивной процедуры. Длительно существующий патологический ДГР характеризует не просто наличие желчи в просвете желудка, а желчное окрашивание стенок из-за наложений желчи, а также билиарная рефлюкс-гастропатия (эритема в виде «красных полос», геморрагические петехии) [49].
Также при осмотре кардиоэзофагеальной зоны оценить замыкательную функцию при ЭГДС достаточно сложно, поскольку кардия открывается рефлекторно в ответ на введение эндоскопа и инсуффляцию воздуха [16]. Таким образом, недостаточность кардии и признаки гастроэзофагеального рефлюкса, выявленные во время проведения эндоскопии, могут быть спровоцированы самой процедурой, а эндоскопически объективно выявить ведущий механизм нарушений моторики при ГЭРБ — нарушение функции НПС крайне затруднительно.
Для оценки скорости опорожнения желудка «золотым стандартом» считается сцинтиграфия с изотопами технеция или индия. Исследования, в которых проводилась сцинтиграфия желудка с определением скорости прохождения и эвакуации твердой пищи, показали положительную корреляцию между скоростью опорожнения желудка и выраженностью тошноты, рвоты, боли в животе и раннего насыщения. Однако методика имеет ограничения, в частности, из-за радиационной нагрузки [50]. Капсульные системы, обеспечивающие оценку моторики всего ЖКТ без радиационного облучения, требуют соблюдения строгих показаний и противопоказаны при риске обструкции, недостаточно доступны в широкой клинической практике [50].
С целью оценки миоэлектрической активности желудка используется транскутанная электрогастрография (ЭГГ). Доминирующая мощность ЭГГ коррелирует с антральными сокращениями, а аномальные медленные волны связаны с задержкой опорожнения желудка. Это позволяет использовать ЭГГ в качестве альтернативного неинвазивного метода оценки моторики желудка [50]
Для снижения риска ложноотрицательных результатов диагностических исследований пациентов с диспепсическими жалобами следует учитывать возможное влияние лекарственных препаратов на проводимые тесты. Так, назначение ингибиторов протонной помпы (ИПП), антацидов, антибиотиков или препаратов висмута может привести к диагностической ошибке и, как следствие, несвоевременному лечению [51]. При первичном подозрении на ГЭРБ оценку наличия патологического рефлюкса рекомендуется проводить как минимум через 2 нед. после отмены ИПП [11, 52]. При проведении тестов на H. pylori также следует отменять ИПП за 2 нед. до исследования, а для антибиотиков и препаратов висмута интервал между окончанием приема и диагностикой H. pylori должен составлять не менее 4 нед. [53]. Таким образом, выявление причин диспепсии требует интеграции эндоскопических и функциональных методов, временной отмены ряда лекарственных препаратов, комплексного учета лекарственной нагрузки и имеющихся коморбидных состояний [50].
В условиях реальной клинической практики важно не только купирование диспепсии, но и применение высокоинформативных тестов для выявления инфекции H. pylori без снижения их диагностической ценности. В соответствии с актуальными нормативными документами[1] [54], одним из вариантов терапии является назначение препаратов группы прокинетиков, которые благодаря воздействию на факторы патогенеза диспепсии позволяют облегчить ее симптомы, сохраняя при этом информативность диагностических тестов.
Подходы к терапии моторных нарушений верхних отделов ЖКТ и роль прокинетиков
При первичном обращении пациента с диспепсическими жалобами подтверждение или исключение диагнозов ГЭРБ, ФД или ХГ, в том числе ассоциированного с H. pylori, не является обязательным условием для начала лечения, направленного на облегчение состояния. С учетом большого вклада моторных нарушений желудка в возникновение симптомов диспепсического характера в клинической практике патогенетически обоснованным подходом к терапии моторных нарушений верхних отделов ЖКТ является использование препаратов из группы прокинетиков, что согласуется с рекомендациями по лечению ГЭРБ, гастрита и ФД от ведущих научных сообществ1 [11, 38]. Прокинетики усиливают и координирует мышечные сокращения пищеварительного тракта, в том числе между различными сегментами кишечника, ускоряя продвижение содержимого [55].
Известно, что ГЭРБ является кислотозависимым заболеванием, в связи с чем стандартом медикаментозной терапии является назначение ИПП, которые снижают скорость секреции соляной кислоты и объем желудочного сока, что способствует уменьшению повреждающего потенциала рефлюктата [56]. Вместе с тем недостаточное внимание к патогенезу заболевания зачастую приводит к снижению эффективности терапии. Важная роль нарушений моторики в патогенезе заболевания является основанием для назначения прокинетиков пациентам с ГЭРБ, в том числе в качестве стартовой терапии заболевания [38], что связано со способностью препаратов указанной группы повышать тонус НПС, снижать частоту и продолжительность гастроэзофагеальных рефлюксов, нормализовывать моторную активность желудка и антродуоденальную координацию, тем самым опосредованно восстанавливая физиологическое состояние пищевода и действуя на основные звенья патогенеза ГЭРБ [18].
С данным подходом согласуется и мнение практикующих врачей, которые выделяют замедление моторики как важную составляющую патогенеза ГЭРБ. Так, в результате опроса, проведенного среди 135 врачей (гастроэнтерологов, терапевтов, врачей общей практики и других специалистов), было выявлено следующее (рис. 1):
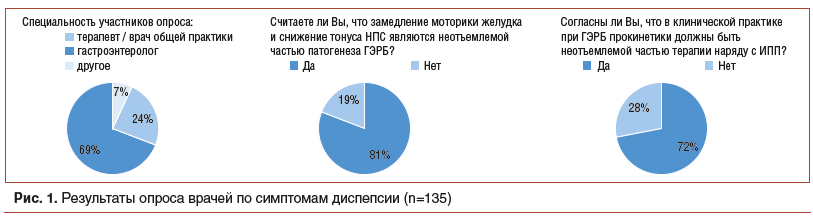
более 80% врачей считают замедление моторики желудка и снижение тонуса НПС обязательной частью патогенеза ГЭРБ;
72% врачей уверены, что прокинетики должны быть неотъемлемой частью терапии ГЭРБ наряду с ИПП.
Подход к терапии пациентов с ХГ зависит от этиологии, стадии и особенностей его патогенеза. Основная задача, которая стоит перед врачом, — снижение риска развития онкологического процесса, что достигается посредством эрадикации H. pylori. Вместе с тем имеющиеся при ХГ жалобы диспепсического характера не всегда купируются посредством элиминации инфекционного агента. В таких случаях, а также при других типах ХГ (например, при билиарном рефлюкс-гастрите) оправдана терапия диспепсии с помощью антисекреторных средств, гастропротекторов и прокинетиков1. Важную роль последних подчеркивает многоцентровое исследование с участием 8892 пациентов с ХГ, согласно которому симптомы, ассоциированные с нарушением моторики ЖКТ, были вторыми по встречаемости [57]. Высокую распространенность симптомов диспепсии при ХГ подтверждают и результаты проведенного опроса, согласно которому 82% врачей отмечают их наличие более чем у половины пациентов, а 95% врачей включают прокинетики в схемы лечения гастрита при его сочетании с симптомами диспепсии (рис. 2). Таким образом, для пациентов с ХГ прокинетики являются патогенетически обоснованным лечением симптомов диспепсии.
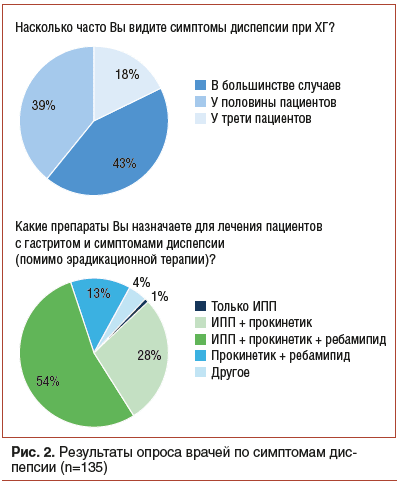
Важная роль нарушений моторной функции желудка и ДПК в патогенезе ФД является основанием для использования прокинетиков, которые воздействуют на основные звенья патогенеза нарушения двигательной функции желудка и гастродуоденальной координации1. Основными эффектами прокинетиков у данной категории пациентов является стимуляция сократительной способности желудка, ускорение его опорожнения, устранение антродуоденальной дискоординации, а также повышение тонуса сфинктеров пищевода, желудка и верхних отделов кишечника [58]. Помимо коррекции двигательных нарушений, подходы к терапии пациентов с ФД также заключаются в эрадикации H. pylori и антисекреторной терапии ИПП [27].
Обоснованность включения прокинетиков в базовую терапию моторных нарушений верхних отделов ЖКТ при различных заболеваниях подкрепляется также данными систематического обзора и метаанализа, включавшего 29 исследований прокинетических агентов у пациентов с ФД. Данная группа препаратов показала статистически значимо более высокую эффективность по сравнению с плацебо: общее улучшение симптомов наблюдалось у 40% пациентов с ФД против 26% в группе плацебо [51]. Эффективность прокинетиков у пациентов с ФД была подтверждена результатами метаанализа с участием 1053 пациентов и составила 61%, значительно превысив эффективность плацебо (41%) [24]. Наиболее выраженный эффект прокинетики оказывают при сочетании ГЭРБ с ФД [11]. Вместе с тем важно учитывать разнородность механизмов действия лекарственных средств, входящих в данную группу [59], что может влиять в том числе и на соотношение эффективности и безопасности лекарственной терапии.
В сетевом метаанализе 25 исследований, включившем 4473 пациента с ФД, было подчеркнуто, что при выборе прокинетиков необходимо учитывать частоту побочных эффектов лекарственной терапии [60]. Так, применение антагониста дофаминовых рецепторов домперидона сопряжено с повышенными сердечно-сосудистыми рисками — согласно данным метаанализа, прием препарата повышал риск желудочковой аритмии и внезапной сердечной смерти на 70% [61]. Также при назначении домперидона важно избегать одновременного применения препаратов, удлиняющих интервал QT, и мощных ингибиторов CYP3A4 [60]. На сегодняшний день на территории Российской Федерации домперидон зарегистрирован только c показанием «симптомы тошноты и рвоты», а длительность его применения ограничена 7 днями [53], что может существенно сужать терапевтические возможности.
Другим препаратом из группы прокинетиков является акотиамид. Механизм его действия связан с ингибированием активности ацетилхолинэстеразы и усилением постпрандиальной моторики антрального отдела желудка. Вместе с тем, согласно инструкции по применению, препарат показан только для лечения таких симптомов ФД, как чувство переполнения в желудке после приема пищи, вздутие верхней части живота, чувство раннего насыщения. Эффективность акотиамида при изжоге, боли в эпигастральной области, ассоциированной с ФД, не подтверждена, а перед применением препарата необходимо исключить наличие органического поражения[2]. Ограниченные показания к применению акотиамида значительно сужают возможность использования лекарственного средства в качестве препарата первого выбора для стартовой терапии пациентов с диспепсическими симптомами.
Еще одним представителем группы прокинетиков является итоприд, который обладает двойным механизмом действия. Препарат является[3]:
антагонистом D2-дофаминовых рецепторов, таким образом:
предотвращает ингибирующее действие дофамина на моторный нейрон, улучшая сокращения желудка и кишечника и повышая скорость эвакуации содержимого желудка;
проявляет противорвотный эффект, взаимодействуя с D2-дофаминовыми рецепторами в хеморецепторной триггерной зоне продолговатого мозга;
ингибитором ацетилхолинэстеразы, активизируя высвобождение и замедляя разрушение ацетилхолина, который является основным медиатором, отвечающим за сокращение и тонус НПС:
повышает тонус НПС;
усиливает моторику желудка;
ускоряет опорожнение желудка;
улучшает гастродуоденальную координацию.
Итоприд улучшает эвакуацию пищи из желудка и препятствует забросу кислого содержимого в пищевод, действуя, таким образом, на все звенья патогенеза симптомов диспепсии, обусловленных нарушением моторики3. Молекула итоприда характеризуется высокой полярностью, что минимизирует ее проникновение через гематоэнцефалический барьер, в связи с чем препарат не вызывает экстрапирамидных нарушений [62]. Также итоприд не влияет на натриевые каналы и не обладает кардиотоксичностью, не удлиняет интервал QТ, что подтверждают результаты ряда исследований, продемонстрировавших благоприятный профиль безопасности итоприда [62, 63].
Важным отличием итоприда от других прокинетиков является его метаболизм в печени под действием флавин-зависимой монооксигеназы3, что открывает широкие возможности его назначения в комбинации с другими препаратами, в том числе метаболизирующимися с помощью ферментов системы цитохрома Р450. Данное свойство является особенно актуальным в свете комплексной терапии пациентов, которым требуется совместное назначение ИПП и прокинетика [64].
Обоснованность применения итоприда для коррекции симптомов, связанных с нарушениями моторики верхних отделов ЖКТ у пациентов при ГЭРБ, ХГ и ФД, подтверждена большим количеством научных данных. Так, в систематическом обзоре и метаанализе 15 РКИ (n=1422) было продемонстрировано преимущество комбинированной терапии ГЭРБ прокинетиком и ИПП по сравнению с монотерапией ИПП [65]. В недавно опубликованном ретроспективном исследовании пациентов с ГЭРБ, резистентной к ИПП, при добавлении к терапии итоприда по 50 мг 3 р/сут на протяжении 8 нед. отмечалось значительное снижение доли пациентов с ранее имевшимися симптомами изжоги, регургитации, жжения, чувства переполнения после еды и тошноты (p<0,001) [66]. Таким образом, добавление к лечению итоприда может существенно повышать эффективность у пациентов, резистентных к монотерапии ИПП.
В другом исследовании было показано, что комбинированная терапия итопридом и пантопразолом в течение 4 нед. способствует большей частоте разрешения симптомов (74,5% против 62,5%, p<0,001) у пациентов с ГЭРБ. Исследователи отметили в группе комбинированной терапии тенденцию к меньшей частоте нежелательных явлений (22% против 30%, p=0,172) [67].
В одном из ранних исследований эффективности итоприда у пациентов с ГЭРБ средней тяжести была отмечена тенденция к снижению числа кислых рефлюксов, 2–3-кратному снижению числа длительных (>5 мин) рефлюксов, 25–50% сокращению общего времени с pH <4 в просвете пищевода [68]. Также значимо уменьшались тяжесть изжоги и баллы выраженности всех симптомов после лечения по сравнению с исходными уровнями (p<0,0001).
Эффективность и безопасность итоприда у пациентов с подтвержденным диагнозом неязвенной диспепсии или ХГ изучались в открытом несравнительном исследовании 2003 г. Было показано, что назначение итоприда по 50 мг 3 р/сут в течение 2 нед. обеспечило полное или умеренное облегчение симптомов в 73% случаев. При этом переносимость препарата была признана «отличной» в 93% случаев и «хорошей» у 7% пациентов. Также важно подчеркнуть, что ни у одного из пациентов не наблюдалось удлинения интервала QT на электрокардиограмме [69].
В когорте пациентов с ФД итоприд подтвердил эффективность и безопасность в сравнительных исследованиях по отношению как к плацебо, так и к другим прокинетикам. При сравнении итоприда с плацебо или другими прокинетиками (домперидоном, цизапридом, метоклопрамидом) итоприд показал наилучшую эффективность в устранении ППДС (ОР 1,21, 95% ДИ 1,03–1,44, p=0,02), чувства раннего насыщения (ОР 1,24, 95% ДИ 1,01–1,53, p=0,04). Авторы анализа отметили, что итоприд имел благоприятный профиль безопасности: частота побочных эффектов была сопоставима с показателями контрольной группы, особенно в отношении экстрапирамидных реакций [70]. В другом многоцентровом двойном слепом плацебо-контролируемом исследовании с участием 523 пациентов итоприд приводил к значительному уменьшению выраженности симптомов у пациентов с ФД и продемонстрировал более высокую частоту ответа по сравнению с плацебо [71].
Одним из самых продолжительных исследований итоприда стала работа, изучавшая его применение у 798 пациентов с ФД в течение 1 года [62]. Ответ на терапию, по глобальной оценке, возрастал с увеличением длительности терапии, составив 61,7% на 8-й неделе лечения и 77,9% на 52-й неделе терапии. В ходе исследования подтвердилось отсутствие значимого повышения уровня пролактина и отсутствие изменений на электрокардиограмме. Таким образом, итоприд можно применять длительно, что особенно актуально при хронических состояниях, требующих продолжительной терапии, — срок применения препарата прямо не ограничен инструкцией, а курс лечения в исследованиях составлял до 8 нед.3.
Итоприд также продемонстрировал более высокие показатели эффективности по сравнению с акотиамидом в рамках сравнительного ретроспективного исследования реальной клинической практики с участием 79 пациентов с ФД [72]. По прошествии 8 нед. терапии симптомы тяжелой степени были зарегистрированы реже в группе итоприда по сравнению с группой акотиамида (в т. ч. 1,75% против 13,64%, p=0,003 для боли в эпигастрии). Было отмечено значимое снижение тяжести эпигастральной боли, жжения, раннего насыщения и чувства постпрандиального переполнения. Доля пациентов с полным разрешением симптомов в группе итоприда почти в 2 раза превосходила долю таковых в группе акотиамида (61,4% против 31,82%). При этом акотиамид не показал статистически значимого уменьшения выраженности ни одного из симптомов диспепсии. Наряду с более высокими показателями эффективности итоприд имел сопоставимый с акотиамидом профиль безопасности.
Действие итоприда на полный спектр симптомов диспепсии, изжогу и отрыжку, а также широкие показания к применению наряду с благоприятным профилем без-опасности делают его универсальным препаратом с прокинетическим действием в арсенале практикующего врача. На отечественном фармацевтическом рынке итоприд представлен рядом торговых названий, в том числе оригинальным препаратом Ганатон® (производство Япония)[4]. Препарат имеет сбалансированный состав вспомогательных веществ и прогнозируемую биодоступность — в исследовании по сравнительной оценке биофармацевтических свойств оригинального итоприда и дженериков было отмечено, что изменение оригинальной технологии производства может приводить к значительным изменениям в характере распадаемости таблеток, влияя тем самым на этап высвобождения действующего компонента. В дальнейшем это может влиять и на распределение действующего вещества в организме, т. е. на связанные с ним диффузионные процессы, что может, в свою очередь, отразиться на показателях клинической эффективности [73]. Немаловажно, что многочисленные данные, подтверждающие высокую эффективность и благоприятный профиль безопасности итоприда, также были продемонстрированы в исследованиях именно на оригинальном препарате [10].
Заключение
Нарушение моторики верхних отделов ЖКТ является одним из основных патофизиологических механизмов ГЭРБ, ХГ и ФД, а также лежит в основе возникновения симптомов, которые побуждают пациента обратиться за врачебной помощью. Ввиду необходимости проведения дополнительных диагностических тестов для установления окончательного диагноза подход к выбору стартовой терапии при наличии жалоб диспепсического характера должен заключаться в применении патогенетически обоснованной группы лекарственных средств — прокинетиков.
Таким образом, можно выделить ключевые подходы к ведению пациентов с заболеваниями верхних отделов ЖКТ, сопровождающихся нарушением моторики:
Нарушение моторики верхних отделов ЖКТ является ведущим фактором в патогенезе развития симптомов диспепсии, сопровождающих такие заболевания, как ГЭРБ, ФД и ХГ.
Диспепсические симптомы, являющиеся общей точкой пересечения для указанных заболеваний, значительно снижают качество жизни пациента. На этапе диагностического поиска прокинетики могут использоваться без риска искажения результатов исследований. Ввиду этого при обращении пациента с диспепсическими жалобами важно сразу назначать терапию прокинетиками для облегчения состояния.
Препараты группы прокинетиков следует рассматривать наряду с ИПП в качестве базисной терапии для пациентов с симптомами диспепсии при ГЭРБ, ФД и ХГ ввиду действия на патогенетические механизмы данных заболеваний.
Препаратом выбора среди прокинетиков является оригинальный итоприда гидрохлорид (Ганатон®), который имеет наиболее широкие показания к применению в своем классе, воздействует на полный спектр диспепсических симптомов, а также подтвердил эффективность и безопасность в многочисленных клинических исследованиях.
[1] Клинические рекомендации. Гастрит и дуоденит. 2024. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/view-cr/708_1 (дата обращения:16.10.2025).
[2] Общая характеристика лекарственного препарата Диспевикт®, таблетки, покрытые пленочной оболочкой, 100 мг. (Электронный ресурс.) URL: https://lk.regmed.ru/Register/EAEU_SmPC (дата обращения: 16.10.2025).
[3] Инструкция по медицинскому применению препарата Ганатон®, таблетки, покрытые пленочной оболочкой. (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=beba7b45-6fc9-479e-8e6f-d7dd839e02c7 (дата обращения: 16.10.2025).
[4] https://grls.rosminzdrav.ru/GRLS.aspx?RegNumber=&MnnR=итоприд&lf=&TradeNmR=&…
Информация с rmj.ru


