Введение
Глаукома — это группа офтальмологических заболеваний, приводящих к медленно прогрессирующей атрофии зрительного нерва. При глаукоме развивается глаукомная оптическая нейропатия — приобретенная патология зрительного нерва, ведущая к структурному и функциональному его повреждению, нарушению зрительных функций и слепоте1 [1, 2]. Ключевым фактором патофизиологии всех видов глаукомы является гибель ганглиозных клеток сетчатки (ГКС). Это группа нейронов центральной нервной системы (ЦНС), тела которых находятся в сетчатке, а аксоны составляют передний зрительный путь: зрительный нерв, хиазму, зрительный тракт и доходят до латеральных коленчатых тел (ЛКТ). В ЛКТ аксоны ГКС образуют синапсы с нейронами, которые, в свою очередь, проецируются в зрительную кору. Зрительные пути составляют довольно большую часть белого вещества головного мозга.
Современные методы лучевой диагностики предоставляют широкие возможности для исследований структурных и функциональных характеристик головного мозга. С помощью таких технологий, как компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) возможно диагностировать большой спектр нарушений мозгового вещества. Однако использование рутинных МРТ-протоколов не всегда позволяет оценить структурно-функциональные изменения в головном мозге, ассоциированные с глаукомой, они применяются для исключения иных структурных изменений. Рутинная МРТ при глаукоме показывает атрофические изменения зрительных нервов и зрительного перекреста, появление в их структуре очагов повышенной интенсивности сигнала по данным Т2-взвешенных изображений, причем степень выраженности данных нарушений положительно коррелирует со степенью тяжести глаукомы [3–5]. Однако на начальных стадиях глаукомного процесса указанные изменения могут отсутствовать или быть минимальными, что требует использования инновационных методов количественной структурно-функциональной МРТ-визуализации.
Содержание статьи
Использование инновационной МРТ-визуализации при исследовании глаукомы
Инновационные методы МРТ-визуализации, которые могут быть использованы для оценки и мониторинга поражений ЦНС при глаукоме, можно разделить на структурные и функциональные. Структурные методы позволяют оценивать макро- и микроструктурные характеристики серого и белого вещества головного мозга. К ним относят: магнитно-резонансную (МР) морфометрию серого и белого вещества, диффузионно-тензорную и диффузионно-куртозисную визуализацию с последующей реконструкцией проводящих путей и их количественной оценкой — трактометрией. К методам функциональной МРТ-визуализации относят функциональную МРТ (фМРТ), МР-перфузию (контрастную и бесконтрастную), а также метаболическую визуализацию (МР-спектроскопию, CEST-визуализацию), позволяющие оценивать наличие функционального дефицита в веществе головного мозга даже при отсутствии его структурных изменений.
Структурная МРТ-визуализация при глаукоме
Магнитно-резонансная морфометрия серого вещества проводится с использованием стандартизированных программных пакетов на основе данных Т1-взвешенных изображений и позволяет получить информацию об абсолютном объеме определенных структур головного мозга и о пространственном расположении участков уменьшения объема серого вещества. На сегодняшний день имеется крупный пласт морфометрических исследований пациентов с глаукомой, где показано уменьшение объема серого вещества в пределах зрительной коры, которое положительно коррелирует со степенью тяжести глаукомы [6–9]. При этом нейродегенеративный процесс может распространяться и за пределы первичной зрительной коры, например на островковые доли и подкорковые ядра [10]. В исследованиях с использованием поверхностной морфометрии (англ.: surface-based morphometry) уменьшение площади поверхности затылочной области коррелировало с периметрическими индексами и стадией глаукомы [11, 12].
Диффузионно-тензорная визуализация позволяет оценивать движение молекул воды вдоль нервных волокон проводящих путей головного мозга, на основании которого возможно получение ряда параметров, характеризующих микроструктурные свойства проводящих путей, их целостность, а также получение данных об их объеме. Многочисленные публикации последних 10 лет описывают уменьшение толщины и объема зрительного нерва, хиазмы, зрительного тракта и ЛКТ при глаукоме, коррелирующее со стадией и тяжестью заболевания [13–15]. На основе диффузионно-тензорной визуализации возможна 3D-реконструкция проводящих путей — МР-трактография. В результате анализа диффузии воды вдоль аксонов создаются изображения, которые показывают ход, направление и целостность нервных волокон. Таким образом получают 3D-реконструкцию проводящих путей (рис. 1).
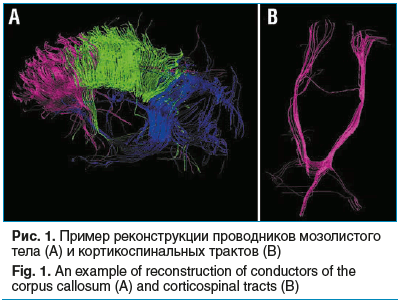
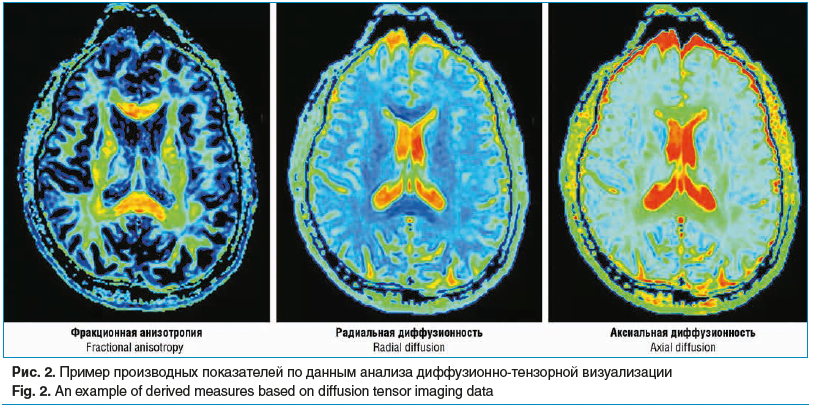
На основе данных диффузионно-взвешенной визуализации работают методы диффузионно-тензорной визуализации, диффузионно-куртозисной визуализации (англ.: diffusion kurtosis imaging, DKI), позволяющие получать количественные показатели, отражающие микроструктурные характеристики проводящих путей головного мозга и получившие название МР-трактометрии. Одним из основных параметров, получаемых при анализе диффузионно-тензорной визуализации, является фракционная анизотропия (ФА), представляющая собой степень ограничения диффузии молекул воды в различных тканях и являющаяся интегративным индексом целостности проводящих путей. При нарушении структурной целостности проводящих путей вследствие патологического процесса показатель ФА для пораженных волокон будет снижаться. Другими производными показателями являются аксиальная и радиальная диффузионности, отражающие степень диффузии молекул воды вдоль проводящих путей и перпендикулярно им, а также средняя диффузионность, являющаяся степенью диффузии, усредненной по всем направлениям. Считается, что показатель аксиальной диффузионности в большей мере коррелирует со степенью аксонального повреждения, тогда как радиальная диффузионность может отражать степень повреждения миелиновой оболочки [16]. Примеры карт фракционной анизотропии, аксиальной и радиальной диффузионности представлены на рисунке 2. Целостность нервного волокна может быть оценена по индексу плотности волокон, поперечному сечению пучка волокон, соотношению плотности волокон к поперечному сечению (насколько плотно волокна упакованы в пучки). Еще один важный показатель, получаемый при трактометрии, — коэффициент целостности миелина, также указывающий на процессы демиелинизации [17].
Систематический обзор, в котором оцениваются возможности трактометрии при глаукоме, был выполнен учеными из Новой Зеландии. В выборку вошли исследования, основанные на когортах пациентов с первичной открытоугольной глаукомой (ПОУГ), первичной закрытоугольной глаукомой (ПЗУГ) и глаукомой низкого давления (ГНД). В общей сложности анализировались результаты диффузионной МР-трактометрии 1051 пациента с глаукомой и 5445 контрольных лиц. Изменения количественных параметров визуализации были зарегистрированы при всех формах глаукомы. Наиболее существенные сдвиги касались фракционной анизотропии — показателя, определяющего направление движения молекул воды. Выраженное снижение фракционной анизотропии свидетельствует о деградации миелиновой оболочки. Также на процессы демиелинизации при глаукоме указывают увеличение средней диффузионности и увеличение радиальной диффузионности [18]. Признаки деградации аксонов и миелина были зафиксированы в зрительных нервах, трактах и зрительной лучистости [19, 20]. У пациентов с глаукомой индекс плотности волокон, поперечное сечение пучка волокон, а также соотношение плотности к поперечному сечению значительно снижены по сравнению с таковыми в контрольной группе, что указывает на потерю аксонов и развивающуюся атрофию зрительных путей. Степень выраженности этих изменений коррелирует с толщиной слоя нервных волокон сетчатки и периметрическими индексами. Исследователи считают, что количественные показатели МР-трактометрии могут быть надежными биомаркерами глаукомной дегенерации [21].
J. Kruper et al. [22] проанализировали результаты диффузионной МРТ белого вещества головного мозга у 905 пациентов с глаукомой (в возрасте 49–80 лет) и 5292 здоровых лиц (в возрасте 45–80 лет) из Британского биобанка (ресурс открытого доступа для выявления причин широкого спектра сложных заболеваний среднего и пожилого возраста). Целью исследования было сравнить глаукомные и возрастные изменения мозга. Для анализа использовались алгоритмы глубокого машинного обучения. Результаты исследования показали существенные отличия глаукомных изменений и физиологических процессов старения. Трактометрия демонстрировала специфичные для глаукомы свойства белого вещества, которые, по мнению исследователей, не связаны с ускоренным старением.
Однако использование показателей МР-трактометрии для характеристики глаукомы может быть затруднено по ряду причин. Во-первых, данные маркеры не являются специфичными для глаукомного процесса и могут изменяться при множестве других патологических состояний головного мозга. Во-вторых, использование методов диффузионно-взвешенной визуализации для оценки зрительного пути ограничено вследствие артефактов визуализации, возникающих из-за неоднородности магнитного поля на границе сред (в частности, с воздухоносными пазухами) [23]. В-третьих, отсутствие стандартизированных подходов к оценке, сегментации передних отделов зрительного пути значительным образом затрудняет имплементацию данного метода нейровизуализации в практику офтальмолога для оценки глаукомы [24, 25].
Функциональная нейровизуализация при глаукоме
Установлено, что фМРТ позволяет оценить функциональное состояние коры in vivo на основе церебральных метаболических изменений, вызванных изменением ее активности. Во время исследования регистрируется сигнал, зависящий от концентрации кислорода в крови (англ.: blood-oxygen level-decedent, BOLD), косвенно отражающий локальную активность нейронов при выполнении определенного тестового задания (активационная фМРТ) или характеризующий спонтанную нейрональную активность в состоянии оперативного покоя (фМРТ в состоянии покоя). Помимо оценки уровня локальной нейрональной активности в ответ на выполнение тестового задания или предъявление стимула, на основании данных фМРТ возможен расчет различных показателей, отражающих функциональное состояние головного мозга, таких как функциональная связность, амплитуда низкочастотных колебаний BOLD-сигнала или региональная гомогенность.
Многие исследования последних лет регистрируют при глаукоме значительные изменения связей между проводящими путями, зрительными и незрительными областями мозга [26–31]. У пациентов с различными формами глаукомы имеет место выраженное снижение функциональной активности первичной зрительной коры, что коррелирует с данными оптической когерентной томографии о толщине слоя нервных волокон сетчатки [32, 33]. У больных ПОУГ были обнаружены изменения функциональной связности между зрительной корой и другими незрительными областями головного мозга [34]. У пациентов с ПЗУГ также были обнаружены обширные аномальные функциональные связи в состоянии покоя между таламусом, зрительными и экстравизуальными областями мозга [35, 36]. У пациентов с глаукомой регистрируются изменения амплитуды низкочастотных колебаний, аномальная спонтанная активность, снижение корковой активности в зрительной коре, что может быть использовано в качестве потенциальных клинических индикаторов глаукомы [37–41].
Недавние исследования пациентов с глаукомой подтверждают наличие дегенеративных поражений, затрагивающих обширные области мозга за пределами зрительного пути. L. Shu et al. [42] выполнили двунаправленный менделевский рандомизированный анализ связи между глаукомой и функциональными сетями мозга. Исследователи оценивали результаты фМРТ покоя у 20 906 глаукомных и 391 275 контрольных пациентов. Изменения функциональной активности, вызванные глаукомой, локализуются в мозжечке, височных и затылочных областях. Авторы предполагают, что это может быть связано с антероградной транссинаптической дегенерацией, вызванной гибелью ганглиозных клеток сетчатки.
Современные возможности МР-визуализации позволяют интегрировать структурные и функциональные данные для более точного комплексного анализа изменений в мозге при глаукоме. Мультимодальный подход к диагностике, предполагающий сопоставление данных различных модальностей МРТ, клинические данные о состоянии сетчатки и поля зрения, методы статистики (например, независимый компонентный анализ) и алгоритмы машинного обучения позволяют получить более полную информацию [43–46].
Заключение
Глаукома традиционно считалась офтальмологическим заболеванием, характеризующимся оптической нейропатией и потерей поля зрения. В настоящее время накапливается все больше данных, свидетельствующих о том, что это многофакторное нейродегенеративное заболевание с распространенным поражением мозга. Данные нейровизуализации могут быть потенциальными биомаркерами как для диагностики, так и для прогнозирования течения глаукомы. Однако для изучения конкретных механизмов нейродегенеративных процессов при глаукоме необходимы дополнительные исследования. Определение маркеров глаукомных изменений головного мозга поможет более ранней диагностике, разработке таргетной терапии, профилактике зрительных и когнитивных нарушений. Мультимодальный подход значительно расширяет возможности клинической офтальмологии и нейронаук в диагностике и мониторинге глаукомы, позволяя объединять структурные и функциональные показатели для комплексного понимания патогенеза болезни, и дает надежду на оптимизацию лечения в будущем.
Благодарность
Авторы выражают глубокую признательность и благодарность заведующему лабораторией нейровизуализации междисциплинарных исследований мозга ИМЧ РАН, ведущему научному сотруднику, к.м.н. А.Д. Короткову и младшему научному сотруднику лаборатории нейровизуализации междисциплинарных исследований мозга ИМЧ РАН врачу-рентгенологу А.Д. Мызникову за предоставленную информацию и помощь в подготовке статьи.
Acknowledgement
The authors gratefully acknowledge to A.D. Korotkov, Head of the Neuroimaging Laboratory of N.P. Bekhtereva Institute of the Human Brain, Leading Scientific Officer, C. Sc. (Med.), and A.D. Myznikov, Junior Scientific Officer at the Neuroimaging Laboratory of N.P. Bekhtereva Institute of the Human Brain, Radiotherapist, for providing data and assistance in the paper preparation.
Сведения об авторах:
Корелина Виктория Евгеньевна — к.м.н., врач-офтальмолог, доцент отдела образовательных программ ИМЧ РАН; 197376, Россия, г. Санкт-Петербург, ул. Академика Павлова, д. 9; доцент кафедры семейной медицины ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0003-2022-5912
Куроедов Александр Владимирович — д.м.н., заведующий кафедрой офтальмологии им. акад. А.П. Нестерова Института клинической медицины ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; начальник офтальмологического центра (с дневным стационаром) ФКУ «ЦВКГ им. П.В. Мандрыка» Минобороны России; 107014, Россия, г. Москва, ул. Б. Оленья, д. 8А; ORCID iD 0000-0001-9606-0566
Чередниченко Денис Владимирович — д.м.н., первый заместитель директора ИМЧ РАН; 197376, Россия, г. Санкт-Петербург, ул. Академика Павлова, д. 9; ORCID iD 0000-0002-8957-8970
Контактная информация: Корелина Виктория Евгеньевна, e-mail: viktoriakorelinanana@gmail.com
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 15.08.2025.
Поступила после рецензирования 09.09.2025.
Принята в печать 02.10.2025.
About the authors:
Victoria E. Korelina — C. Sc. (Med.), Ophthalmologist, Assistant Professor of the Department of Educational
Programs, N.P. Bekhtereva Institute of the Human Brain; 9, Academician Pavlov str., St. Petersburg, 197376, Russian Federation; Assistant Professor of the Department of Family Medicine, North Western State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0003-2022-5912
Alexander V. Kuroyedov — Dr. Sc. (Med.), Head of the Academician A.P. Nesterov Department of Ophthalmology, Institute of Clinical Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; Head of the Ophthalmological Center (with a Day Hospital), P.V. Mandryka Military Clinical Hospital; 8A, Bolshaya Olenya str., Moscow, 107014, Russian Federation; ORCID iD 0000-0001-9606-0566
Denis V. Cherednichenko — Dr. Sc. (Med.), the First Deputy Director of N.P. Bekhtereva Institute of the Human Brain; 9, Academician Pavlov str., St. Petersburg, 197376, Russian Federation; ORCID iD 0000-0002-8957-8970
Contact information: Victoria E. Korelina, e-mail: viktoriakorelinanana@gmail.com
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 15.08.2025.
Revised 09.09.2025.
Accepted 02.10.2025.
1Клинические рекомендации. Глаукома первичная открытоугольная. 2024. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/view-cr/96_2?ysclid=mhnm8f1td5562234384 (дата обращения:10.08.2025).
материал rmj.ru
