Введение
Эндогенный эндофтальмит (ЭЭ) представляет собой редкое, но крайне тяжелое офтальмологическое заболевание, характеризующееся инфекционным поражением внутренних структур глаза вследствие гематогенного распространения патогенных микроорганизмов из системных очагов воспаления в паренхиматозных органах. Это состояние требует немедленной диагностики и интенсивной терапии, поскольку может привести не только к полной и необратимой потере зрения, но и к летальному исходу [1].
Согласно данным Национального департамента неотложной помощи США (NEDS) частота ЭЭ увеличилась более чем в 2 раза — с 0,1 на 100 000 населения в 2006 г. до 0,25 в 2017 г. [2]. ЭЭ составляет приблизительно 2–8% всех зарегистрированных случаев эндофтальмита [3].
Развитию ЭЭ способствуют состояния, сопровождающиеся иммунодефицитом: сахарный диабет, онкологические заболевания, хронические инфекции, наркотическая зависимость, ВИЧ-инфекция, а также применение инвазивных медицинских вмешательств, включая длительное использование внутривенных катетеров [4]. Наличие центрального венозного катетера остается одним из ведущих факторов риска ЭЭ. Эти устройства, широко применяемые в реанимации, онкогематологии и при хронической почечной недостаточности, служат потенциальным источником бактериемии. Связь между катетерами и развитием ЭЭ была подтверждена в нескольких работах, включая наблюдение катетер-ассоциированного сепсиса с последующим бактериальным эндофтальмитом у пациентов на диализе [5, 6]. Согласно клиническим рекомендациям Минздрава России (2017)[1] при подозрении на катетер-ассоциированную инфекцию необходимо немедленно удалить катетер, начать эмпирическую антибактериальную терапию и провести микробиологическое обследование. Эти меры напрямую применимы к ведению пациентов с подозрением на ЭЭ, особенно при наличии системных признаков сепсиса.
В основе патогенеза ЭЭ лежит гематогенное проникновение микроорганизмов в сосудистую систему глаза. Наиболее часто инфекция распространяется через хориоидальные сосуды, что объясняет преимущественное поражение заднего сегмента. Инфицирование хориоидеи бактериальными или грибковыми агентами активирует воспалительный процесс, нарушение гематоофтальмического барьера и быстрое вовлечение стекловидного тела и сетчатки. Инфекционный процесс начинается с образования хориоидальных абсцессов, которые вскрываются в стекловидное тело, провоцируя витриит и массивное внутриглазное воспаление [4].
Эндогенный эндофтальмит может быть как бактериальной, так и грибковой природы. Среди бактериальных возбудителей наиболее часто встречаются Staphylococcus aureus и Streptococcus spp., ассоциированные с системными инфекциями, включая сепсис и эндокардит. В азиатских странах преобладает Klebsiella pneumoniae, что связывают с высокой частотой печеночных абсцессов [7]. Грибковыми агентами чаще всего являются Candida albicans, реже — Aspergillus spp. и Fusarium spp. Грибковый ЭЭ чаще развивается у пациентов с иммуносупрессией, либо получающих длительное внутривенное лечение антибиотиками, либо перенесших хирургические вмешательства [8]. В ряде случаев катетеры становятся воротами для инвазивных патогенов — S. aureus, K. pneumoniae, C. albicans. Такие возбудители продемонстрировали высокую агрессивность при инфицировании глазного яблока [9, 10].
Клиническая симптоматика ЭЭ может быть как острой, так и подострой и зависит от вирулентности возбудителя и иммунного статуса пациента. Офтальмологические проявления включают резкое снижение зрения вплоть до амавроза, боль, усиливающуюся при движении глаза, смешанную инъекцию глаза, отек век, светофобию, появление «плавающих» помутнений, гипопион и ослабление рефлекса с глазного дна [7]. Системные симптомы нередко включают лихорадку, озноб, потливость, клинические признаки сепсиса и проявления первичного очага инфекции, например при абсцессе печени, вызванном K. pneumoniae [7].
Ранняя диагностика критически важна для сохранения не только зрительной функции, но и жизни пациента. Она должна включать в себя детальный сбор анамнеза, выявление факторов риска и проведение комплекса лабораторно-инструментальных исследований. Культуральный метод исследования крови и стекловидного тела остается «золотым стандартом», несмотря на ограниченную чувствительность (50–70%). Метод полимеразной цепной реакции (ПЦР) обладает высокой чувствительностью и специфичностью при идентификации ДНК возбудителей [3]. Среди инструментальных методов применяются оптическая когерентная томография — для визуализации инфильтратов, а также флуоресцентная ангиография — для выявления зон воспаления и ишемии в сосудистой оболочке и сетчатке. При нарушении прозрачности оптических сред необходимо проводить ультразвуковое исследование (УЗИ) глаза в В-режиме — для оценки структуры стекловидного тела [3].
Следует учитывать, что грибковый ЭЭ может протекать в хронической форме с медленным нарастанием симптомов, что дополнительно затрудняет своевременную диагностику [8].
Лечение ЭЭ должно быть неотложным и комплексным, включая системную и местную антибактериальную или противогрибковую терапию, а при необходимости — хирургическое вмешательство. Даже при раннем начале лечения полное восстановление зрения наблюдается редко, однако возможно сохранение остаточной зрительной функции. Задержка в терапии существенно повышает риск полной потери зрения и нередко приводит к необходимости энуклеации глазного яблока [11].
По данным литературы, смертность среди пациентов с ЭЭ достигает 5% [12]. Раннее выявление заболевания и междисциплинарный подход, включающий офтальмолога, инфекциониста и хирурга, позволяют существенно повысить эффективность лечения и улучшить как зрительный, так и жизненный прогноз [13].
С учетом редкости ЭЭ, сложности их диагностики и лечения представляем серию собственных наблюдений.
Содержание статьи
Клиническое наблюдение 1
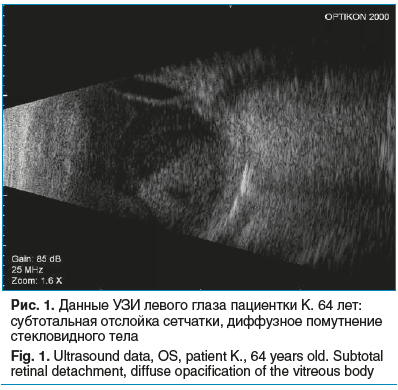
Пациентка К., 64 года. В июле 2024 г. пациентка отметила внезапное появление «черных точек» и сетки перед левым глазом. Уже на следующий день она обратилась в частную клинику, где было назначено местное антибактериальное и противовоспалительное лечение. Однако в течение последующих 3 сут состояние продолжило ухудшаться: появились боли в глазу, усиливающиеся при движении, гипопион, снижение зрения. Через 4 дня после появления первых офтальмологических симптомов пациентка была экстренно госпитализирована в ГБУЗ МО «Балашихинская больница» с диагнозом: гнойный эндофтальмит, субтотальный гипопион левого глаза. Проводилось консервативное лечение, однако из-за нарастающих симптомов и соматической нестабильности в начале августа она была переведена по экстренным показаниям в офтальмологическое отделение ГБУЗ МО МОНИКИ им. М.Ф. Владимирского (далее МОНИКИ). На момент поступления: Visus OS — 0. По данным УЗИ глаза (рис. 1): типичная картина эндофтальмита, субтотальная отслойка сетчатки. В этот же день пациентка пожаловалась на острую боль в животе. При компьютерной томографии (КТ) брюшной полости выявлен острый гнойно-деструктивный пиелонефрит левой почки с паранефритом и отсутствием выделительной функции. Пациентка в тяжелом соматическом состоянии была переведена в урологическое отделение, где экстренно проведена нефрэктомия. Интраоперационно — массивно увеличенная почка с множественными абсцессами. Одновременно выполнена энуклеация левого глазного яблока. В послеоперационном периоде в левую конъюнктивальную полость были назначены инстилляции безифлоксацина по капле 3 раза в день. Уровень прокальцитонина при поступлении составил 0,4 нг/мл — показатель, указывающий на системное воспаление и начало септического процесса. В моче выделена C. albicans, в раневом отделяемом — K. pneumoniae. Среди сопутствующих заболеваний выявлен сахарный диабет 2 типа, что подтверждает наличие фонового иммунодефицитного состояния.
Клиническое наблюдение 2
Пациент Д., 47 лет, доставлен бригадой СМП в ГБУЗ Московской области «Солнечногорская больница» с жалобами на спутанность сознания и дезориентацию, с подозрением на острое нарушение мозгового кровообращения. После обследования был переведен в инфекционное отделение с диагнозом: острый гнойный менингит. Диагноз установлен на основании исследовании ликвора, в котором обнаружен плеоцитоз и белок 4,8 г/л. Этиология гнойного менингита не была установлена. По результатам обследования выявлены анемия и впервые диагностированный сахарный диабет 2 типа в стадии декомпенсации. На протяжении госпитализации пациент неоднократно сообщал о болях в левом глазу, однако офтальмологического осмотра своевременно проведено не было. После выписки, через 7 дней с момента появления офтальмологических жалоб, он самостоятельно обратился в МОНИКИ. На приеме у дежурного офтальмолога было зафиксировано отсутствие правильной светопроекции слева. Пациент экстренно госпитализирован в офтальмологическое отделение. По данным УЗИ: признаки гнойного энд-офтальмита с тотальной отслойкой сетчатки. Проведена энуклеация левого глазного яблока.
С учетом тяжелого воспалительного процесса после энуклеации также проводились инстилляции безифлоксацина по капле 3 раза в день в левую конъюнктивальную полость. Воспалительные явления в конъюнктивальной полости купированы через 5 дней. В послеоперационном периоде состояние пациента оставалось тяжелым. Установлен диагноз: сепсис (возбудитель не уточнен), левосторонний осумкованный плеврит, анемия тяжелой степени, асцит, спленомегалия, абсцессы правой и левой долей печени, тромбоз воротной вены и ее ветвей. По данным КТ органов грудной клетки — двусторонняя полисегментарная септическая эмбологенная пневмония с участками деструкции, по данным КТ брюшной полости — абсцессы обеих долей печени. Уровень прокальцитонина на момент офтальмологического осмотра — 0,47 нг/мл, клиническая картина соответствовала выраженному сепсису. Диабетический статус был подтвержден уровнем гликированного гемоглобина >7%. Пациент получал лечение в терапевтическом отделении МОНИКИ, после стабилизации состояния был выписан с улучшением.
Клиническое наблюдение 3
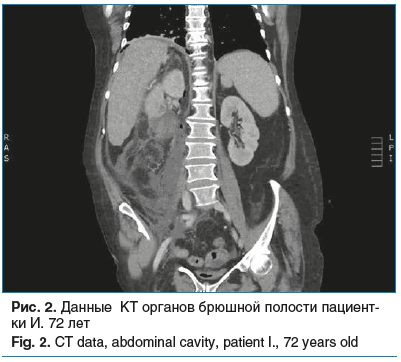
Пациентка И., 72 года, доставлена в МОНИКИ с жалобами на резкое снижение зрения и интенсивную боль в правом глазу с иррадиацией в височную область. Со слов пациентки, жалобы сохранялись в течение 2 сут до обращения за медицинской помощью. В анамнезе — сахарный диабет 2 типа и артериальная гипертензия. На момент поступления был установлен диагноз эндофтальмита правого глаза: Visus OD — светоощущение с неправильной светопроекцией. Через 1 сут после госпитализации состояние ухудшилось: появились боль в животе, тошнота, рвота. При КТ выявлены (рис. 2): острый пиелонефрит слева, гнойный деструктивный пиелонефрит справа, пионефроз, паранефрит. Проведена субкостальная люмболапаротомия с нефр-эктомией справа. Больная переведена в отделение реанимации и интенсивной терапии, где был установлен диагноз уросепсиса. Послеоперационный период осложнился развитием септического шока, острой почечной недостаточностью, полиорганной недостаточностью, отеком легких и головного мозга, ДВС-синдромом, множественными абс-цессами печени и инфарктом селезенки. Микробиологический анализ аcцитической жидкости выявил Escherichia coli. Уровень прокальцитонина не был определен. Несмотря на интенсивную терапию, у пациентки сохранялись анурия, тяжелая гипотензия (АД 67/42 мм рт. ст.), прогрессировал метаболический ацидоз. Смерть наступила на 3-и сутки госпитализации на фоне нарастающей полиорганной недостаточности и септического шока.
Обсуждение
Эндогенный эндофтальмит остается редким, но крайне тяжелым осложнением системной инфекции, которое требует повышенной настороженности со стороны узких специалистов. Анализ литературы и собственных клинических наблюдений свидетельствует о сложной патофизиологии заболевания, нередко необратимой утрате зрительных функций даже при раннем лечении, высокой летальности. Развитие ЭЭ может быть стремительным. В большинстве случаев бактериальные формы проявляются остро, с полной утратой зрения в течение 2–3 сут. Напротив, грибковые формы часто характеризуются под-острым дебютом, но не менее тяжелым прогнозом [14]. В серии наблюдений [15] средний интервал между манифестацией первичной инфекции и появлением офтальмологических жалоб составлял 5–7 сут.
Пандемия COVID-19 добавила новые аспекты в патогенез ЭЭ. Исследования показывают, что применение системных стероидов, иммуномодуляторов и длительная госпитализация увеличивают частоту грибковых форм эндофтальмита, преимущественно вызванных Candida и Aspergillus [16, 17]. Интересен случай вспышки ЭЭ в Индии, связанной с внутривенным введением декстрозы из контаминированной партии растворов [18].
У представленных нами пациентов наблюдались быстрое снижение остроты зрения и стремительное развитие воспаления оболочек глаза при недооценке врачами как общей, так и офтальмологической симптоматики. При поступлении в офтальмологическое отделение МОНИКИ витрэктомия уже была невозможна из-за бесперспективности органосохраняющего лечения и тяжелого соматического статуса пациентов (полиорганная недостаточность, септический шок), что совпадает с данными литературы [18]. Уровень прокальцитонина был повышен — от 0,4 нг/мл до критических значений. Это соответствует данным о роли прокальцитонина как раннего биомаркера сепсиса и предиктора тяжести течения ЭЭ [9]. Двум пациентам была проведена энуклеация после стабилизации состояния. В послеоперационном периоде обоим пациентам был назначен безифлоксацин в конъюнктивальную полость. Данный противомикробный препарат представляет собой новый топический С8-хлорфторхинолон с мощной антибактериальной активностью широкого спектра действия и благоприятным фармакокинетическим профилем, что в совокупности выгодно отличает его от других фторхинолонов в лечении бактериальной инфекции глаза [19]. Безифлоксацин никогда не применялся системно, поэтому его использование особенно эффективно при воспалительных заболеваниях глазной поверхности, вызванных резистентными к антибиотикам патогенами [20]. Независимо от фенотипа резистентности изолятов, бези-флоксацин был бактерицидным в течение 45–120 мин, как минимум в 2–4 раза быстрее, чем гатифлоксацин или моксифлоксацин, и в более низких концентрациях [21].
Важно отметить, что офтальмолог зачастую становится первым специалистом, способным заподозрить наличие инфекционного очага в другом органе. При отсутствии в анамнезе хирургических вмешательств внезапное снижение зрения, гипопион, витрит и боли в глазу должны рассматриваться как потенциальное проявление системной инфекции.
Таким образом, ЭЭ требует междисциплинарного подхода: взаимодействия офтальмолога, инфекциониста, реаниматолога и хирурга.
Заключение
Эндогенный эндофтальмит — редкое, но крайне серьезное офтальмологическое заболевание, которое нередко становится первым проявлением тяжелой системной инфекции. Анализ клинических наблюдений показывает, что внезапное ухудшение зрения, особенно на фоне хронических заболеваний (сахарного диабета, иммуносупрессии), должно настораживать врача и побуждать к активному поиску возможного инфекционного очага «внеглазной» локализации. ЭЭ следует рассматривать не только как офтальмологическую проблему, но и как важный клинический маркер тяжелого инфекционного процесса, требующего немедленного реагирования и системного подхода к лечению. В условиях, когда состояние пациента быстро ухудшается, критически важно раннее взаимодействие специалистов разных профилей — офтальмолога, инфекциониста, хирурга и реаниматолога. Такой междисциплинарный подход повышает шансы на своевременную диагностику, корректную терапию и снижение риска неблагоприятных исходов, включая утрату зрения или развитие септического шока.
Сведения об авторах:
Гришина Елена Евгеньевна — д.м.н., профессор, главный научный сотрудник онкологического отделения хирургических методов лечения ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0003-2668-9136
Андрюхина Ольга Михайловна — старший научный сотрудник офтальмологического отделения ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0002-7242-8781
Коврижкина Алина Алексеевна — научный сотрудник офтальмологического отделения ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0002-5952-2183
Богатырев Александр Михайлович — научный сотрудник офтальмологического отделения ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0002-6877-0023
Гурбанова Гюнель Маликовна — врач-аспирант кафедры офтальмологии и оптометрии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0009-0004-7449-8419
Контактная информация: Гришина Елена Евгеньевна, e-mail: eyelena@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 26.09.2025.
Поступила после рецензирования 14.10.2025.
Принята в печать 31.10.2025.
About the authors:
Elena E. Grishina — Dr. Sc. (Med.), Professor, Chief Scientific Officer at the Oncological Department of Surgical Therapeutic Methods, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0003-2668-9136
Olga M. Andryukhina — Senior Scientific Officer at the Ophthalmological Department, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0002-7242-8781
Alina A. Kovrizhkina — Scientific Officer at the Ophthalmological Department, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0002-5952-2183
Aleksandr M. Bogatyryov — Scientific Officer at the Ophthalmological Department, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0002-6877-0023
Gyunel M. Gurbanova — Postgraduate Doctor at the Department of Ophthalmology and Optometry, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0009-0004-7449-8419
Contact information: Elena E. Grishina, e-mail: eyelena@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 26.09.2025.
Revised 14.10.2025.
Acc
[1] Клинические рекомендации. Профилактика катетер-ассоциированных инфекций кровотока и уход за центральным венозным катетером (ЦВК). М., 2017.
материал rmj.ru
