Введение
Основной проблемой глаукомной хирургии остается рубцевание вновь созданных путей оттока, которое приводит к повышению внутриглазного давления в послеоперационном периоде [1, 2]. Для повышения эффективности гипотензивной операции предложено множество методик: интра- и послеоперационное применение антипролиферативных препаратов, использование различных дренажей, минимизация операционной травмы. Тем не менее изолированное применение указанных методик не приводит к желаемому результату.
Наиболее часто в качестве антипролиферативных средств используются митомицин С и 5-фторурацил, которые в значительной степени повышают эффективность антиглаукомной операции. Эти препараты применяют интраоперационно в виде аппликаций и инъекций в послеоперационном периоде. Однако безопасность применения данных препаратов оставляет желать лучшего, что ограничивает их повсеместное использование в клинической практике [3, 4]. Одним из наиболее безопасных препаратов для борьбы с избыточным рубцеванием в хирургии глаукомы является циклоспорин А, который обладает противовоспалительным, иммуномодулирующим и антипролиферативным действием. Он избирательно действует на Т-хелперы, тем самым уменьшая концентрацию ключевого провоспалительного медиатора интерлейкина 2 [5, 6]. Однако патофизиология раневого процесса очень сложна и не ограничивается участием в нем только Т-лимфоцитов [7, 8]. Поэтому селективность действия циклоспорина А, с одной стороны, обеспечивает высокую безопасность его применения, а с другой — может быть причиной его недостаточной эффективности.
Наиболее изученными антипролиферативными агентами являются глюкокортикостероиды (ГКС), которые обладают противовоспалительным, иммунодепрессивным, антипролиферативным действием и оказывают воздействие на все звенья патогенеза воспалительного процесса, продолжительность которого составляет до 2 лет [9]. Согласно данным А.Е. Дугиной [10] длительность острой фазы воспаления в конъюнктиве после гипотензивного вмешательства составляет 3 нед. Поэтому для получения желаемого результата в отношении контроля процесса рубцевания минимальная продолжительность применения ГКС в послеоперационном периоде должна быть не менее 3 нед. В офтальмологии данная группа препаратов применяется в виде конъюнктивальных инстилляций, субконъюнктивальных инъекций. Однако необходимо принимать во внимание, что эффективность ГКС, применяемых в виде инстилляций, ограничена из-за временной вариабельности концентрации препарата в конъюнктиве.
В настоящее время для повышения биодоступности ГКС разработаны системы доставки данных лекарственных средств. Уже сегодня в офтальмологии в качестве системы доставки дексаметазона используется биодеградируемый интравитреальный имплант, состоящий из алифатических полиэфиров молочной и гликолевой кислот и их сополимеров [11]. В РФ зарегистрирован пористый дренаж «Глаутекс» (ООО «ХайБиТек», Россия) на основе сополимера молочной и гликолевых кислот с размером пор 5–50 мкм и с периодом биодеструкции не более 8 мес. В настоящее время имеются данные о его успешном насыщении различными препаратами, в том числе с использованием ультразвука [12–14]. В связи с этим нам кажется перспективной идея объединения двух стратегий профилактики избыточного рубцевания после антиглаукомной операции, при которой под склеральный лоскут и конъюнктиву помещают дренаж, предварительно насыщенный дексаметазоном.
Цель исследования: разработка методики насыщения антиглаукоматозного дренажа суспензией дексаметазона ex tempore для длительного высвобождения лекарственного вещества в терапевтических концентрациях in vitro.
Содержание статьи
Материал и методы
Работа выполнена на базе физико-химической лаборатории ООО «ХайБиТек». В качестве субстрата для насыщения дексаметазоном использовали биорезорбируемый дренаж из поли (D,L-лактид-со-гликолида) с размером пор 5–50 мкм и с периодом биодеструкции не более 8 мес. Наличие микропор позволяет насыщать данный вид дренажа различными препаратами. Вес дренажей определялся с помощью высокоточных аналитических весов GH-202 (AND, Япония). Для насыщения дренажи помещали в 0,1% суспензию порошка дексаметазона в физиологическом растворе и воздействовали на нее ультразвуковыми волнами. В эксперименте использовали два режима ультразвукового воздействия: для насыщения образца 1 (3 шт.) использовали ультразвук мощностью 100 Вт частотой 22 кГц в течение 6 мин (диспергатор ультразвуковой УЗД2-0,1/22), для насыщения образца 2 (3 шт.) — ультразвук мощностью 20 Вт частотой 30 кГц в течение 15 мин (миниатюрный ультразвуковой гомогенизатор Bandelin Sonopuls mini20, имеющий микрозонд диаметром 2,5 мм). После ультразвуковой обработки дренажи вынимали из суспензии, отжимали на фильтровальной бумаге, сушили при 60 °C в течение 1 ч и далее взвешивали для определения привеса. Для обеих групп устанавливалось минимальное время насыщения дренажей, при котором привеса уже не происходило.
Для определения профиля высвобождения дексаметазона из дренажей в условиях, приближенных к реальным, образцы, насыщенные вышеуказанным способом дексаметазоном (по 3 шт.), выдерживали в стеклянных флаконах со сбалансированным солевым раствором (balanced salt solution, BSS) при температуре 37 °C в течение 1 мес. Ежедневно дренажи перемещали в новый раствор BSS, объем которого был рассчитан, исходя из объема внутриглазной жидкости, проходящей через фильтрационную подушку за заданный промежуток времени, — 3 мл/сут. Концентрацию дексаметазона в промывных растворах определяли с помощью спектрофотометрии (спектрофотометр Lambda EZ 201, Perkin Corporation, США) в ультрафиолетовой области спектра с длиной волны, соответствующей максимуму поглощения для дексаметазона λmax, — 242 нм.
Статистический анализ проводили с использованием программы StatTech v. 4.8.11 (разработчик — ООО «Статтех», Россия). Количественные показатели описывали с помощью средних арифметических величин и стандартных отклонений (M±m).
Результаты и обсуждение
Было установлено, что структура и форма дренажей при насыщении дексаметазоном не изменялись. В ходе эксперимента получены следующие результаты: при воздействии ультразвука большой мощности и малой частоты (мощность 100 Вт, частота 22 кГц) в течение 6 мин среднее количество дексаметазона, сорбируемого дренажом, составило 0,26±0,01 мг, т. е. 24,5 вес.% от веса исходного дренажа. При использовании ультразвука малой мощности и большей частоты (20 Вт, 30 кГц) в течение 15 мин среднее количество сорбируемого дексаметазона значительно увеличивалось и составило 0,70±0,03 мг, т. е. 46,7 вес.% от веса дренажа. Приведенный привес дренажа определялся, исходя из начального веса дренажа 0,80±0,03 мг. Причина такого отличия в сорбционных характеристиках дренажа при изменении режима ультразвуковой обработки суспензии заключается, очевидно, в том, что выбранный щадящий ультразвуковой режим насыщения образца 2 позволяет проникать дексаметазону более глубоко в поры дренажа, сорбироваться в них и не десорбироваться еще в процессе самой ультразвуковой обработки.
Согласно данным литературы концентрация дексаметазона, значительно снижающая пролиферацию и усиливающая апоптоз и/или некроз эндотелиальных клеток роговицы, составляет 10–4 и 10–3 М (39,52 и 395,2 мкг/мл соответственно) [15]. Максимальная концентрация дексаметазона в эксперименте получена в 1-е сутки и составила 26 мкг/мл для образца, насыщенного в условиях первого режима, и 23 мкг/мл — в условиях второго режима. Как видно на рисунке 1, оба образца показали выделение безопасных концентраций препарата. Согласно данным литературы терапевтическая концентрация дексаметазона составляет 1 мкг/мл и выше [16]. На рисунке 1 продемонстрировано, что оба образца показали превышение терапевтической концентрации препарата в течение всего периода высвобождения дексаметазона.
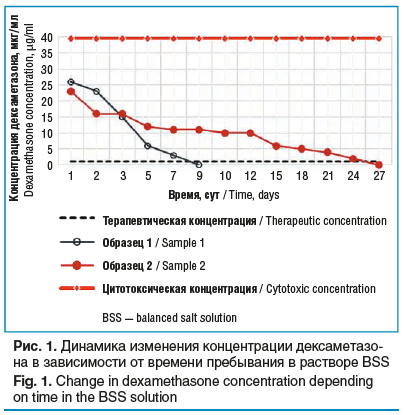
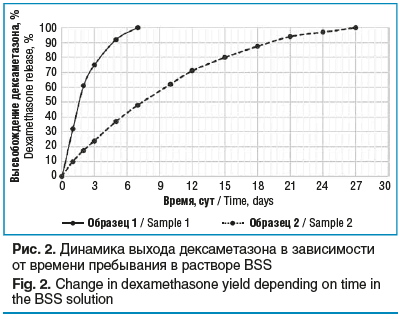
На рисунке 2 видно, что большая часть дексаметазона высвободилась из образца 1 уже в течение 1-х суток и далее происходило постепенное выделение препарата в течение 7 дней, что, очевидно, недостаточно для оказания выраженного антипролиферативного эффекта. Для образца 2 время высвобождения дексаметазона было значительно больше и составило 26 дней, кроме того, высвобождение дексаметазона было более равномерным. Учитывая, что длительность острой фазы воспаления в конъюнктиве после гипотензивного вмешательства составляет 3 нед. [10], а дексаметазон воздействует на все фазы воспалительного процесса, включая фазы пролиферации и ремодуляции, можно ожидать, что образец 2 является наиболее перспективным в отношении профилактики послеоперационного рубцевания.
Заключение
Проведенный эксперимент продемонстрировал, что способность биорезорбируемого антиглаукоматозного дренажа из поли(D,L-лактид-со-гликолида) сорбировать дексаметазон на своей поверхности увеличивается при воздействии ультразвука малой мощности и большей частоты (20 Вт, 30 кГц) в течение 15 мин. Также биорезорбируемый антиглаукоматозный дренаж из поли(D,L-лактид-со-гликолида) после депонирования ex tempore дексаметазона указанным выше способом обеспечивает его высвобождение в терапевтических концентрациях в течение 26 дней, что соответствует длительности острой фазы воспаления в конъюнктиве. Таким образом, биорезорбируемый антиглаукоматозный дренаж из поли(D,L-лактид-со-гликолида), насыщенный дексаметазоном, может быть использован в качестве безопасного и эффективного средства в борьбе с послеоперационным рубцеванием в хирургическом лечении глаукомы.
Сведения об авторах:
Радайкина Мария Владимировна — аспирант кафедры офтальмологии ФГБОУ ВО СамГМУ Минздрава России; 443099, Россия, г. Самара, ул. Чапаевская, д. 89; заведующая глаукомным отделением ГБУЗ «СОКОБ им. Т.И. Ерошевского»; 443068, Россия, г. Самара, ул. Ново-Садовая, д. 158; ORCID iD 0000-0002-3644-6296
Золотарев Андрей Владимирович — д.м.н., доцент, заведующий кафедрой офтальмологии ФГБОУ ВО СамГМУ Минздрава России; 443099, Россия, г. Самара, ул. Чапаевская, д. 89; заместитель главного врача по платным услугам ГБУЗ «СОКОБ им. Т.И. Ерошевского»; 443068, Россия, г. Самара, ул. Ново-Садовая, д. 158; ORCID iD 0000-0002-9107-5221
Карлова Елена Владимировна — д.м.н., доцент кафедры офтальмологии ФГБОУ ВО СамГМУ Минздрава России; 443099, Россия, г. Самара, ул. Чапаевская, д. 89; заместитель главного врача по инновационно-технологическому развитию ГБУЗ «СОКОБ им. Т.И. Ерошевского»; 443068, Россия, г. Самара, ул. Ново-Садовая, д. 158; ORCID iD 0000-0003-4929-8832
Глубокова Мария Николаевна — к.фарм.н., доцент кафедры химии института фармации ФГБОУ ВО СамГМУ Минздрава России; 443099, Россия, г. Самара, ул. Чапаевская, д. 89; ORCID iD 0000-0001-8296-9701
Контактная информация: Радайкина Мария Владимировна, e-mail: masha1310@yandex.ru
Источник финансирования: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.09.2025.
Поступила после рецензирования 25.09.2025.
Принята в печать 20.10.2025.
About the authors:
Maria V. Radaykina — Postgraduate Student at the Department of Ophthalmology, Samara State Medical University; 89, Chapaevskaya str., Samara, 443099, Russian Federation; T.I. Eroshevskiy Samara Regional Clinical Ophthalmological Hospital; 158, Novo-Sadovaya str., Samara, 443068, Russian Federation; ORCID iD 0000-0002-3644-6296
Andrey V. Zolotarev — Dr. Sc. (Med.), Assistant Professor, Head of the Department of Ophthalmology, Samara State Medical University; 89, Chapaevskaya str., Samara, 443099, Russian Federation; Deputy Chief Physician for Paid Services, T.I. Eroshevskiy Samara Regional Clinical Ophthalmological Hospital; 158, Novo-Sadovaya str., Samara, 443068, Russian Federation; ORCID iD 0000-0002-9107-5221
Elena V. Karlova — Dr. Sc. (Med.), Assistant Professor, Head of the Department of Ophthalmology, Samara State Medical University; 89, Chapaevskaya str., Samara, 443099, Russian Federation; Deputy Chief Physician for Advanced Technological Development, T.I. Eroshevskiy Samara Regional Clinical Ophthalmological Hospital; 158, Novo-Sadovaya str., Samara, 443068, Russian Federation; ORCID iD 0000-0003-4929-8832
Maria N. Glubokova — C. Sc. (Pharm.), Assistant Professor of the Department of Chemistry, Institute of Pharmacy, Samara State Medical University; 89, Chapaevskaya str., Samara, 443099, Russian Federation; ORCID iD 0000-0001-8296-9701
Contact information: Maria V. Radaykina, e-mail: masha1310@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 02.09.2025.
Revised 25.09.2025.
Accepted 20.10.2025.
материал rmj.ru
