Введение
Глаукома — одна из основных причин слепоты в мире на протяжении многих лет; мультифакторное заболевание, патогенез которого включает механические, сосудистые и биохимические факторы [1].
Первичная открытоугольная глаукома (ПОУГ) остается наиболее распространенной формой заболевания и традиционно ассоциируется с повышенным уровнем внутриглазного давления (ВГД). Повышенное ВГД можно зафиксировать при скрининге, что важно для выявления заболевания, а также это главный модифицируемый фактор риска при ПОУГ, воздействие на который является текущей терапевтической стратегией.
Однако от 16% [2] до 70% [3] пациентов, в зависимости от выбранной популяции, никогда не демонстрируют цифр истинного уровня ВГД, выходящих за верхнюю границу нормы в 21 мм рт. ст. Это так называемая глаукома нормального давления (ГНД), отличающаяся тем, что повреждение зрительного нерва прогрессирует при условно нормальном ВГД.
Такие различия в клинических фенотипах предполагают различия в патогенетических механизмах, вероятнее всего, в патогенезе ГНД центральную роль играют сосудистая дисфункция, нейровоспаление и аутоиммунные процессы [4].
Трудности скрининга и ведения пациентов с ГНД диктуют необходимость поиска точных биомаркеров для ранней диагностики данной формы глаукомы и новых терапевтических мишеней.
Водянистая влага (ВВ) как жидкость, омывающая структуры переднего и заднего сегментов глаза, является идеальным субстратом для выявления молекулярных биомаркеров, отражающих локальные патологические изменения. Анализ протеома ВВ позволяет получить информацию о молекулярных изменениях, происходящих в переднем сегменте, и о процессах, отражающих патологию заднего сегмента, поскольку существует постоянный обмен белками между ВВ и стекловидным телом [5].
Данная публикация содержит обзор результатов исследований качественного и количественного белкового состава ВВ у пациентов с ГНД.
Характеристика включенных исследований и их результаты
Для формирования поискового запроса в Pubmed использовали слова «aqueous humor», «normal tension glaucoma», «NTG», «protein», «proteomе», «proteomic», в результате чего было найдено 26 статей с 1999 г. по сегодняшний день. Из данных статей критериям отбора (наличие группы пациентов с ГНД, наличие контрольной группы, исследование именно ВВ) соответствовали всего 7. Краткая характеристика включенных в анализ исследований представлена в таблице 1.

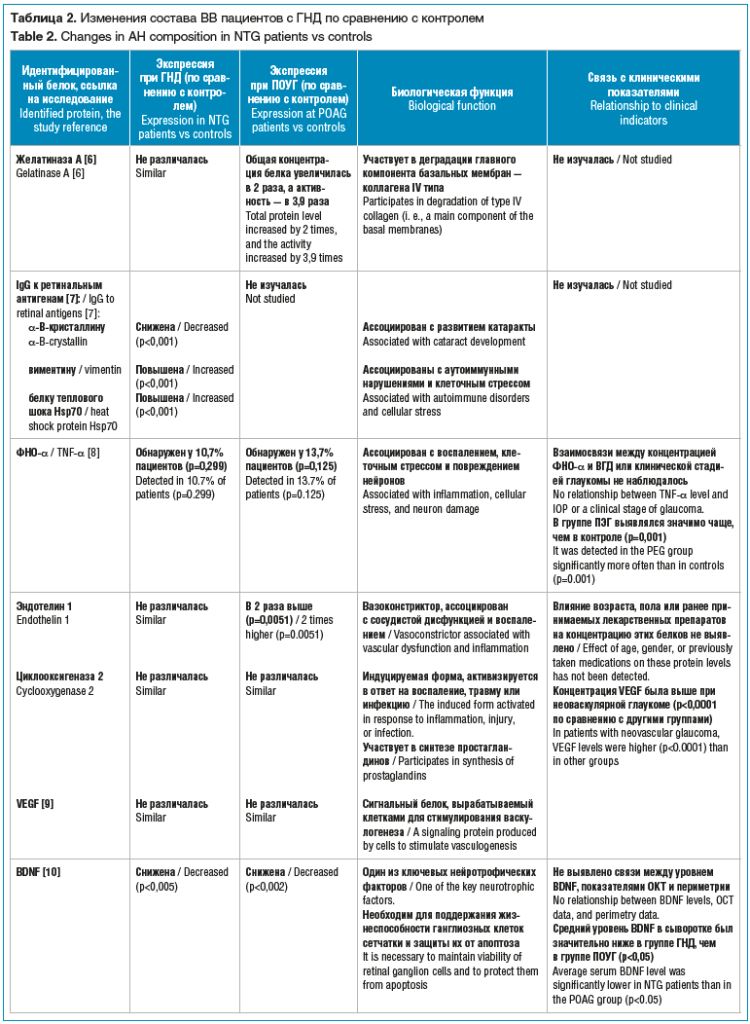
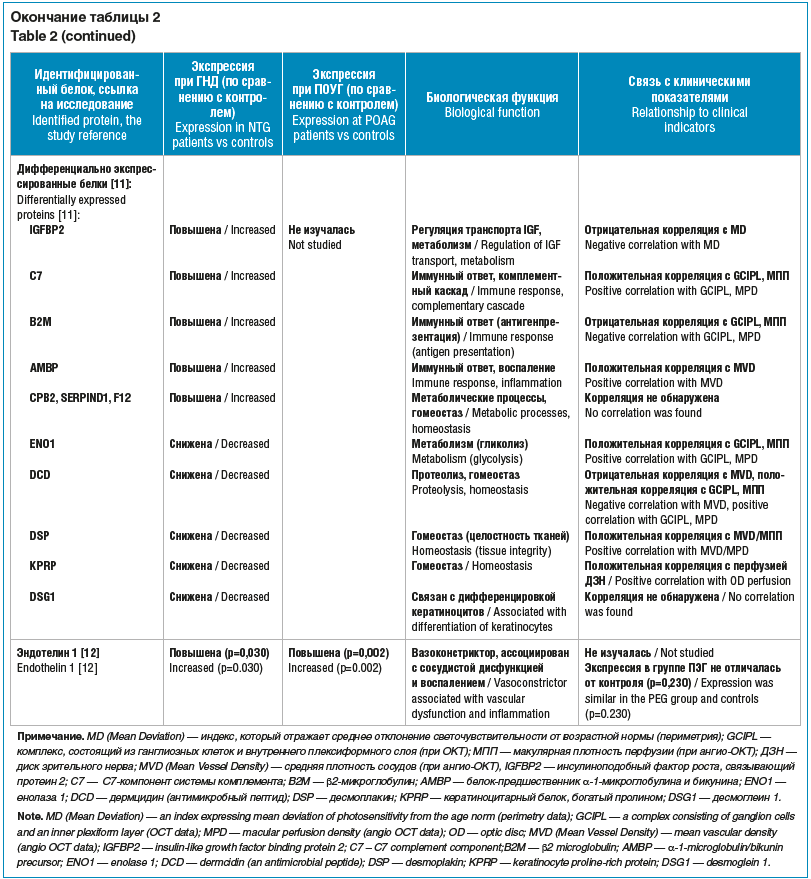
Перечисленные работы отличаются разнообразием исследуемых белков и включением, помимо контрольной группы (пациенты с катарактой), пациентов с классической ПОУГ. В таблице 2 представлены результаты анализа белкового состава ВВ пациентов с ГНД и указанием биологического значения идентифицированных протеинов.
Обсуждение
Идентифицированные белки по их биологической роли можно разделить на следующие группы:
маркеры воспаления и иммунного ответа;
маркеры оксидативного стресса;
маркеры экстрацеллюлярного матрикса;
маркеры нейродегенерации и апоптоза.
Рассмотрим изменения качественного и количественного состава белков ВВ указанных групп у пациентов с ГНД, ПОУГ и катарактой.
Маркеры воспаления и иммунного ответа. Активация иммунной системы и наличие воспаления являются общими признаками ГНД и ПОУГ. Так, при обоих видах заболевания наблюдается повышение уровней C7 -компонента системы комплемента и B2M [11, 13]. Это может служить подтверждением общей роли комплементарного каскада и нейровоспаления в повреждении зрительного нерва при глаукоме.
При ПОУГ дополнительно было обнаружено значительное повышение уровней белков системы комплемента C3, C4A, C4B и F2 [13], более чем 13-кратное увеличение содержания IGKC (легкая цепь каппа-Ig) [14], что свидетельствует о выраженной локальной иммунной или воспалительной реакции.
Специфичными для ГНД являются изменения содержания таких белков, как IGFBP2, ENO1, DCD, DSP и KPRP, которые демонстрируют значимую корреляцию с морфологическими (ОКТ-показатели) и функциональными (периметрические индексы) параметрами заднего сегмента глаза, непосредственно отражающими повреждение ганглиозных клеток сетчатки. Данные молекулы могут являться потенциальными маркерами прогрессии и тяжести заболевания и подтверждать гипотезу о том, что протеомные изменения в ВВ при ГНД преимущественно отражают патологию сетчатки и зрительного нерва, а не переднего сегмента.
Еще одной специфичной для ГНД находкой стало повышение уровня антител к виментину и HSP70, которые ассоциируются с аутоиммунными нарушениями, что служит дополнительным доказательством аутоиммунной вовлеченности в патогенезе ГНД [7].
Что касается уровня ФНО-α, то его повышение в ВВ при ГНД и ПОУГ по сравнению с таковым в контрольной группе не достигло уровня статистической значимости [8]. Однако существует исследование, показавшее 2-кратное увеличение содержания данного белка в плазме крови у пациентов с ПОУГ [15]. Можно предположить роль ФНО-α в нейровоспалении при глаукоме, но требуются дополнительные исследования.
Еще один белок, ассоциированный с сосудистой дисфункцией и системным воспалением, — эндотелин 1, его уровень повышен в ВВ как при ГНД, так и при ПОУГ [12]. Значимое повышение уровня прослеживается и в плазме крови пациентов с ГНД (в 1,4 раза) и ПОУГ (в 1,9 раза) [16]. Повышение уровня эндотелина 1, особенно при ГНД, при которой сосудистые факторы играют ключевую роль, поддерживает гипотезу о дисрегуляции сосудистой перфузии как общем патогенетическом звене.
Маркеры оксидативного стресса. При ПОУГ в ряде исследований было выявлено снижение уровня супероксиддисмутазы, глутатионтрансферазы, пероксиредоксина, каталазы, которые обеспечивают детоксикацию и защиту от окисления [17, 18]. Снижение антиоксидантной защиты, увеличение активных форм кислорода могут способствовать повреждению трабекулярной сети и нарушению циркуляции ВВ. Экспрессию данных молекул при ГНД еще предстоит изучить.
Маркеры экстрацеллюлярного матрикса. Увеличение концентрации данной группы белков характерно для ПОУГ, что демонстрируют, например, результаты исследования желатиназы А, уровень и активность которой повысились у пациентов с ПОУГ и не изменились у пациентов с ГНД по сравнению с контролем [6]. В других исследованиях было показано усиление экспрессии миотрофина, миогенина, фосфопротеина, анкирина 2, COL18A1, ассоциированных с ремоделированием трабекулярной сети и нарушением оттока ВВ [19, 20]. В целом протеомные изменения при ПОУГ отражают повреждение переднего сегмента глаза, в частности трабекулярной сети, что согласуется с ролью повышенного ВГД в развитии данной формы глаукомы.
Маркеры нейродегенерации и апоптоза. Уровни BDNF в ВВ были значительно снижены как при ГНД, так и при ПОУГ по сравнению с контролем [10]. При этом разница в средних уровнях BDNF в ВВ между группами ГНД и ПОУГ не была статистически значимой. Это указывает на общий дефицит нейротрофической поддержки, способствующий апоптозу ганглиозных клеток сетчатки, независимо от уровня ВГД. Интересно то, что в данном исследовании уровень BDNF в сыворотке крови был значительно ниже у пациентов с ГНД по сравнению с таковым у пациентов с ПОУГ. Это снижение, возможно, может указывать на системное нарушение нейротрофической поддержки, которое является специфическим предрасполагающим фактором для ГНД. В ВВ пациентов с ПОУГ был выявлен дисбаланс между нейропротективными факторами и молекулами, способствующими апоптозу (белки теплового шока, фактор пигментного эпителия, каспаза 14, GAPDH (фермент, участвующий в гликолизе) и др.), что может говорить о потере ганглиозных клеток сетчатки и повреждении зрительного нерва либо способствовать этому [19, 20].
Заключение
Сравнительный анализ протеома ВВ показывает, что ГНД и ПОУГ, хотя и являются частью спектра открыто-угольной глаукомы, обладают как общими, так и уникальными молекулярными чертами. Общим для обеих форм является активация нейровоспаления и сосудистой дисфункции, что поддерживает гипотезу о наличии ВГД-независимых факторов развития и прогрессирования заболевания. Различия заключаются в том, что ГНД характеризуется уникальным набором биомаркеров, чьи уровни коррелируют с повреждением заднего сегмента глаза, а также отражают активность аутоиммунных процессов.
Представленные исследования имеют ограничения в виде небольших размеров выборки, неоднородности аналитических методов, использования пациентов с катарактой в качестве контрольной группы (что может искажать результаты). Это нужно учитывать при анализе и трактовке полученных данных.
Несмотря на эти ограничения, схожесть результатов, полученных на различных аналитических платформах и в разных когортах, позволяет предположить, что протеомные изменения могут иметь отношение к патогенезу ГНД и ПОУГ и быть изучены в качестве потенциальных биомаркеров, необходимых для доклинической диагностики глаукомы и разработки нейропротективных и иммуномодулирующих терапевтических стратегий, нацеленных на замедление прогрессирования заболевания.
Дальнейшие исследования должны быть направлены на создание крупных проспективных когорт для протеомного анализа ВВ (в том числе сравнительного между разными формами глаукомы), а также на валидацию предложенных биомаркеров с целью их клинического внедрения.
Сведения об авторах:
Оганезова Жанна Григорьевна — к.м.н., доцент кафедры офтальмологии им. акад. А.П. Нестерова Института клинической медицины ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-4437-9070
Куроедов Александр Владимирович — д.м.н., заведующий кафедрой офтальмологии им. акад. А.П. Нестерова Института клинической медицины ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; начальник офтальмологического центра (с дневным стационаром) ФКУ «ЦВКГ им. П.В. Мандрыка» Минобороны России; 107014, Россия, г. Москва, ул. Б. Оленья, д. 8А; ORCID iD 0000-0001-9606-0566
Петрова Алина Валерьевна — врач-офтальмолог офтальмологического центра (с дневным стационаром) ФКУ «ЦВКГ им. П.В. Мандрыка» Минобороны России; 107014, Россия, г. Москва, ул. Б. Оленья, д. 8А; ORCID iD 0009-0008-4336-9242
Контактная информация: Оганезова Жанна Григорьевна, e-mail: oganezova@doctormedia.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 19.08.2025.
Поступила после рецензирования 11.09.2025.
Принята в печать 06.10.2025.
About the authors:
Janna G. Oganezova — C. Sc. (Med.), associate professor of the Academician A.P. Nesterov Department of Ophthalmology of the Institute of Clinical Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-4437-9070
Alexander V. Kuroyedov — Dr. Sc. (Med.), Head of the Academician A.P. Nesterov Department of Ophthalmology, Institute of Clinical Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; Head of the Ophthalmological Center (with a Day Hospital), P.V. Mandryka Military Clinical Hospital; 8A, Bolshaya Olenya str., Moscow, 107014, Russian Federation; ORCID iD 0000-0001-9606-0566
Alina V. Petrova — ophthalmologist in the Ophthalmological Center (with a Day Hospital), P.V. Mandryka Military Clinical Hospital; 8A, Bolshaya Olenya str., Moscow, 107014, Russian Federation; ORCID iD 0009-0008-4336-9242
Contact information: Janna G. Oganezova, e-mail: oganezova@doctormedia.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 19.08.2025.
Revised 11.09.2025.
Accepted 06.10.2025.
материал rmj.ru
