Введение
Несмотря на значительный прогресс профилактики и лечения, сердечно-сосудистые заболевания продолжают оставаться одной из ведущих причин смертности, а атеросклероз — основным патофизиологическим субстратом этих состояний. Ключевым биохимическим фактором, определяющим атерогенный риск, считается повышенный уровень холестерина липопротеинов низкой плотности (ХС ЛНП), в связи с чем современные рекомендации рассматривают его как главную мишень липидснижающей терапии и требуют у пациентов высокого и очень высокого сердечно-сосудистого риска как относительного снижения уровня ХС ЛНП ≥50% от исходного уровня, так и достижения строгих целевых значений [1, 2].
В реальной клинической практике значительная часть больных не достигает целевых значений ХС ЛНП на фоне монотерапии статинами даже при использовании препаратов в высоких дозах, что связано как с ограничением эффекта, так и с ростом частоты нежелательных явлений. По данным регистра DA VINCI, около 70–80% пациентов очень высокого риска и 50–60% пациентов высокого риска не достигают целевых уровней ХС ЛНП, что свидетельствует о выраженном разрыве между рекомендациями и реальной практикой [3]. Схожие тенденции наблюдаются и в отечественных данных. В исследовании ЭССЕ-РФ (2016) доля лиц высокого и очень высокого сердечно-сосудистого риска в популяции составила 31,3%, при этом статины принимали лишь около 7% пациентов данной категории. Эффективность терапии оставалась крайне низкой — целевых уровней ХС ЛНП достигли лишь 14,4% мужчин и 4,8% женщин [4]. В последние годы подчеркивается необходимость ранней интенсификации терапии путем добавления ингибитора абсорбции ХС эзетимиба к максимальной переносимой дозе статина у пациентов, у которых целевые уровни ХС ЛНП не достигнуты [5].
Эффективность данной стратегии подтверждена результатами крупного рандомизированного исследования IMPROVE-IT, в котором добавление эзетимиба к симвастатину у больных после острого коронарного синдрома обеспечило дополнительное снижение уровня ХС ЛНП и достоверное уменьшение частоты сердечно-сосудистых событий по сравнению с монотерапией статином [6]. Сегодня активно изучаются фиксированные комбинации (ФК) статина с эзетимибом, демонстрирующие более выраженное снижение уровня ХС ЛНП и более высокую долю пациентов, достигающих целевых значений, по сравнению с монотерапией при сопоставимом профиле безопасности [7].
Результаты многоцентрового рандомизированного исследования III фазы также показали, что ФК розувастатина и эзетимиба (Зенон®) обеспечивала более значимое снижение уровня ХС ЛНП и более высокий процент достижения целевых уровней по сравнению с удвоенной дозой статина. У пациентов очень высокого риска терапия ФК розувастатина и эзетимиба (Зенон®) 40+10 мг и 20+10 мг продемонстрировала достоверное превосходство над монотерапией розувастатином 40 мг по снижению ХС ЛНП (на 19,7 и 12,3% соответственно; p<0,05), при этом доля пациентов, достигших целевых значений ХС ЛНП <1,8 ммоль/л, составила 77% и 60% против 41% в группе монотерапии. Назначение комбинированной терапии с меньшей дозой статина также позволяло минимизировать риск развития нежелательных явлений, сохраняя высокий уровень эффективности и благоприятный профиль безопасности [8].
Препарат Зенон® представляет собой ФК розувастатина и эзетимиба, разработанную для пациентов с первичной гиперхолестеринемией [8], доказавшую свою эффективность в рандомизированном клиническом исследовании. В то же время сравнительные данные об эффективности и безопасности препарата Зенон® в сопоставлении с препаратами атор-вастатина и розувастатина, а также со свободной комбинацией (СК) розувастатина и эзетимиба в отдельных таблетках в условиях рутинной практики остаются ограниченными.
Цель исследования: оценить эффективность и безопасность ФК розувастатина и эзетимиба у пациентов с дислипидемией высокого и очень высокого сердечно-сосудистого риска в сравнении с монотерапией оригинальными статинами (аторвастатин и розувастатин) и СК розувастатина с эзетимибом в отдельных таблетках в условиях 3-месячного наблюдения.
Содержание статьи
Материал и методы
Работа выполнена на базе Университетской клиники Медицинского научно-образовательного института МГУ. Исследование имело наблюдательный характер и проводилось в соответствии с принципами надлежащей клинической практики (GCP) и действующими требованиями законодательства РФ. Протокол был одобрен локальным этическим комитетом учреждения.
С января по июль 2025 г. в Университетскую клинику обратилось 384 пациента с дислипидемией, которым в соответствии с актуальными рекомендациями по нарушениям липидного обмена была инициирована липид-снижающая терапия1. Из данной когорты методом псевдорандомизации была сформирована основная выборка из 80 пациентов, из которых было сформировано 4 группы по 20 человек в зависимости от стартовой терапии. В исследование включали пациентов старше 60 лет, которые имели очень высокий сердечно-сосудистый риск. Пациентов не включали в исследование при наличии гиперчувствительности к компонентам препарата, клинически значимых нарушений функции печени (повышение уровня трансаминаз >3 верхних границ нормы), тяжелой почечной недостаточности (креатинин ≤30 мл/мин/1,73 м2), заболеваний или факторов риска миопатии, одновременного приема циклоспорина или фибратов.
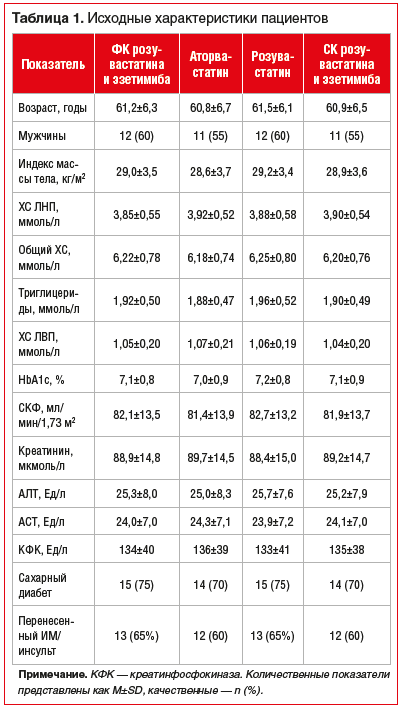
Липидснижающая терапия в основной группе проводилась с использованием ФК розувастатина и эзетимиба (Зенон®) 40+10 мг, в контрольных группах — аторвастатином 80 мг (монотерапия), розувастатином 40 мг (монотерапия) или СК розувастатина (40 мг) с эзетимибом (10 мг) в отдельных таблетках. Помимо статинов пациенты получали иАПФ/сартаны (88%), блокаторы кальциевых каналов (52%), антиагреганты (100%), β-блокаторы (76%) по показаниям. Группы не различались по основным клинико-демографическим характеристикам и исходным параметрам липидного профиля (p>0,05) (табл. 1).
Все пациенты наблюдались в течение 3 мес. Приверженность терапии оценивали на каждом визите (через 1 и 3 мес. после начала терапии) путем опроса пациентов. Замена препарата или изменение дозы допускались только при развитии побочных эффектов или по клиническим показаниям. Все случаи модификации терапии фиксировались в индивидуальных регистрационных формах.
На каждом визите проводили осмотр, оценку жалоб, регистрацию возможных нежелательных явлений, а также измерение массы тела. Лабораторные исследования включали определение показателей липидного профиля (общий ХС, ХС ЛНП, ХС липопротеинов высокой плотности (ЛВП), триглицериды) и биохимических маркеров безопасности терапии (уровни АЛТ, АСТ, КФК, креатинина, глюкозы плазмы натощак). У пациентов с сахарным диабетом и/или нарушенной толерантностью к глюкозе дополнительно определяли уровень HbA1c исходно и через 3 мес.
Клинически значимыми считали повышение уровня АЛТ и/или АСТ более чем в 3 раза выше верхней границы нормы, увеличение уровня КФК более чем в 5 раз выше верхней границы нормы, рост уровня креатинина более чем на 30% от исходного значения, а также любое нежелательное явление, потребовавшее снижения дозы или отмены препарата. Все нежелательные явления регистрировали и классифицировали по степени выраженности и предполагаемой связи с принимаемой терапией.
Основной конечной точкой исследования являлась доля пациентов, достигших целевых уровней ХС ЛНП к 3-му месяцу терапии в соответствии с действующими рекомендациями для больных с очень высоким сердечно-сосудистым риском1. Дополнительно оценивали относительный процент снижения ХС ЛНП по сравнению с исходным уровнем, а также изменения биохимических маркеров безопасности (АЛТ, АСТ, КФК, HbA1c) и частоту нежелательных явлений в сравниваемых группах.
Статистическая обработка данных проведена с использованием стандартных методов статистики. Количественные показатели представлены в виде среднего значения и стандартного отклонения (нормальное распределение согласно результатам оценки с помощью критерия Шапиро — Уилка). Для межгруппового сравнения количественных переменных применяли дисперсионный анализ, для сравнения долей — критерий χ2 или точный критерий Фишера. Внутригрупповую динамику показателей оценивали с помощью парного t-критерия Стьюдента. Различия считали статистически значимыми при p<0,05.
Результаты исследования
На фоне всех изучаемых режимов лечения отмечалось статистически значимое снижение уровня ХС ЛНП уже через 1 мес. с дальнейшим усилением эффекта к 3-му месяцу (табл. 2).
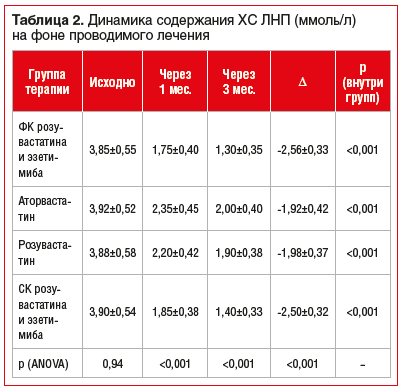
Во всех группах снижение уровня ХС ЛНП к 1-му и 3-му месяцу по сравнению с исходным уровнем было статистически значимым (p<0,001). Межгрупповой анализ показал, что к 3-му месяцу относительное снижение содержания ХС ЛНП было более выраженным в группах, получавших ФК и СК розувастатина и эзетимиба по сравнению с монотерапией аторвастатином и розувастатином (p<0,001). Различия между ФК и СК розувастатина и эзетимиба были статистически незначимы, с тенденцией к более выраженному снижению уровня ХС ЛНП на фоне приема ФК.
К 3-му месяцу терапии доли пациентов, достигших целевых значений ХС ЛНП для очень высокого сердечно-сосудистого риска (ХС ЛНП <1,4 ммоль/л и снижение ≥50% от исходного), существенно различались между группами (табл. 3).
![Таблица 3. Результаты сравнительного анализа данных СМАД в группах повышенной и нормальной ВАД, Me [25%; 75%] Таблица 3. Результаты сравнительного анализа данных СМАД в группах повышенной и нормальной ВАД, Me [25%; 75%]](https://medblog.su/wp-content/uploads/2026/01/1768446810_4_Povyshennaya-variabelnost-arterialnogo-davleniya-v-techenie-sutok-i-vozmozhnosti-ee.png)
По итогам 3-месячного лечения наибольшая доля пациентов, достигших строгих целевых показателей ХС ЛНП, наблюдалась в группах комбинированной терапии — в группе ФК, получавшей Зенон®, и в группе СК розувастатина с эзетимибом. Обе схемы обеспечивали значительно более высокую частоту достижения уровня ХС ЛНП <1,4 ммоль/л и требуемого относительного снижения по сравнению с монотерапией статинами (p<0,01). Именно в группах комбинированной терапии существенно чаще наблюдалось одновременное выполнение обоих терапевтических критериев, тогда как в группах аторвастатина и розувастатина этот показатель оставался более чем вдвое ниже.
На протяжении 3-месячного наблюдения значимой негативной динамики уровней АЛТ, АСТ, КФК и HbA1c в группах не отмечено (табл. 4).
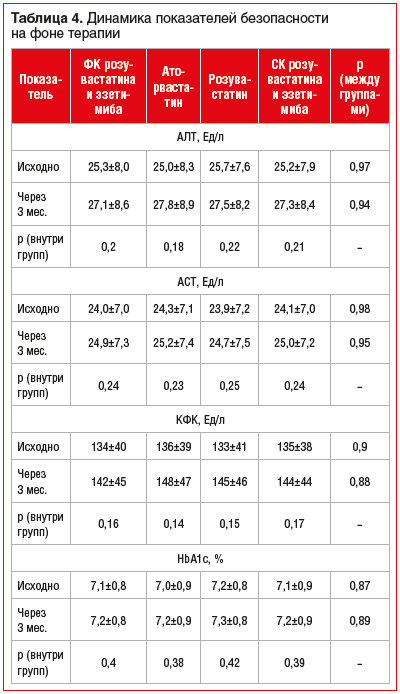
Незначительное повышение средних значений АЛТ, АСТ и КФК к 3-му месяцу носило субклинический характер и не сопровождалось развитием клинических симптомов. Меж-групповых различий в динамике уровня трансаминаз и КФК не выявлено. Уровень HbA1c за период наблюдения оставался стабильным во всех группах исследования, статистически значимого ухудшения гликемического контроля не отмечено.
Клинически значимые нежелательные явления регистрировались относительно редко и не имели существенных межгрупповых различий (табл. 5).

Серьезных нежелательных явлений, включая рабдомио-лиз, клинически значимую печеночную недостаточность или декомпенсацию сопутствующих заболеваний, за период наблюдения зарегистрировано не было. Частота мышечных симптомов была сопоставимой в группах. Отмены или снижения дозы препарата вследствие нежелательных явлений не потребовалось.
Все рассматриваемые схемы липидснижающей терапии продемонстрировали удовлетворительный профиль без-опасности и хорошую переносимость. Применение ФК розувастатин + эзетимиб (Зенон®) не сопровождалось увеличением частоты неблагоприятных реакций по сравнению с монотерапией оригинальными статинами и СК розувастатина и эзетимиба.
Обсуждение
В представленном исследовании оценивали эффективность и безопасность ФК розувастатина и эзетимиба (Зенон®) по сравнению с монотерапией оригинальными статинами (аторвастатин и розувастатин) и СК розувастатина с эзетимибом у пациентов с дислипидемией и очень высоким сердечно-сосудистым риском. Основными результатами стали более выраженное снижение уровня ХС ЛНП и более высокая доля пациентов, достигших целевых значений ХС ЛНП на фоне комбинированной терапии при сопоставимом профиле безопасности по сравнению с монотерапией оригинальными статинами.
Полученные данные согласуются с современными представлениями о том, что монотерапии статинами во многих случаях недостаточно для достижения рекомендованных целевых значений ХС ЛНП у пациентов с очень высоким сердечно-сосудистым риском. Согласно действующим рекомендациям у этой категории больных требуется как снижение ХС ЛНП ≥50% от исходного уровня, так и достижение очень низких абсолютных целевых значений, что в реальной клинической практике редко удается обеспечить только за счет увеличения дозы статина [9]. Именно поэтому в руководствах подчеркивается необходимость раннего добавления эзетимиба при недостаточном ответе на терапию у пациентов высокого и, особенно, очень высокого риска [10].
В нашем исследовании ФК розувастатина с эзетимибом Зенон® и СК розувастатина и эзетимиба обеспечили более существенное снижение уровня ХС ЛНП по сравнению с монотерапией аторвастатином и розувастатином. Подобные результаты ранее были продемонстрированы в ряде рандомизированных исследований фиксированных дозовых комбинаций розувастатина и эзетимиба, где комбинация превосходила монотерапию розувастатином по снижению ХС ЛНП, общего ХС и ХС не-ЛВП при сопоставимом профиле безопасности [11]. На фоне комбинированной терапии у существенно большей доли пациентов удалось достичь как относительного снижения ХС ЛНП ≥50%, так и целевого уровня <1,4 ммоль/л, причем частота одновременного достижения этих двух критериев более чем в 2 раза превосходила таковую при монотерапии статинами. Это подчеркивает клиническую значимость раннего использования комбинации у больных очень высокого риска, у которых исходно очевидно, что потенциала одной лишь эскалации дозы статина недостаточно [12].
Особого внимания заслуживает сопоставление фиксированной и свободной комбинаций розувастатина и эзетимиба. В нашем исследовании обе схемы продемонстрировали сопоставимую эффективность в снижении ХС ЛНП и достижении целевых уровней при тенденции к более выраженному снижению на фоне терапии препаратом Зенон®. К 3-му месяцу целевые уровни ХС ЛНП (<1,4 ммоль/л) были достигнуты у 75% пациентов, получавших Зенон®, и у 70% — на терапии комбинацией розувастатина с эзетимибом, что достоверно превышало показатели монотерапии оригинальными статинами (35–40%, p<0,01). Сопоставление этих данных с результатами регистра РЕНЕССАНС показывает, что в реальной клинической практике использование СК статина и эзетимиба часто оказывается менее эффективным, чем фиксированные формы, что может быть связано как с различиями в используемых препаратах, так и с более низкой приверженностью лечению при необходимости приема нескольких таблеток. Отмечено, что доля пациентов, достигших целевых уровней ХС ЛНП при применении СК, была статистически значимо ниже, чем при использовании ФК, что подчеркивает важность выбора не только эффективного действующего вещества, но и его формы [13]. Таким образом, даже при отсутствии статистически значимых различий между фиксированной и свободной комбинациями в нашей выборке ФК обладает клинически значимыми преимуществами — упрощает режим приема, снижает риск пропуска одной из составляющих терапии и способствует повышению приверженности лечению, особенно у пациентов с полипрагмазией. Эти выводы согласуются с данными других исследований, подтверждающих преимущества однокапсульных сочетаний статинов с эзетимибом по эффективности и удобству применения [14].
Показательно, что при сопоставимом профиле безопасности прием ФК не сопровождался увеличением частоты статин-ассоциированных мышечных и печеночных нежелательных явлений. Динамика уровней АЛТ, АСТ и КФК в группах комбинированной терапии не отличалась от таковой при монотерапии оригинальными статинами, а клинически значимые повышения уровней ферментов и КФК отмечались редко и с сопоставимой частотой во всех группах. Подобные результаты описаны и в рандомизированных исследованиях ФК [15].
Отдельного внимания заслуживают результаты по HbA1c. В течение 3 мес. уровень HbA1c оставался стабильным во всех группах, без статистически значимого ухудшения гликемического контроля, что особенно важно с учетом высокой доли пациентов с сахарным диабетом и предиабетом. Хотя срок наблюдения был относительно коротким, это позволяет рассматривать как комбинированную терапию, так и монотерапию статинами как метаболически нейтральные в отношении углеводного обмена на данном интервале, что согласуется с данными о нейтральном или умеренном влиянии розувастатина и эзетимиба на параметры углеводного обмена в краткосрочных исследованиях [16].
Следует учитывать ограничения исследования. Выборка была относительно небольшой, а одноцентровый наблюдательный дизайн и ограниченная длительность наблюдения отличаются от рекомендованного для оценки клинической безопасности лекарственных средств (ICH E1), что ограничивает возможность выявления редких и отсроченных нежелательных реакций.
Заключение
У пациентов с дислипидемией и очень высоким сердечно-сосудистым риском комбинированная липидснижающая терапия с использованием ФК розувастатина и эзетимиба обеспечивала более выраженное снижение уровня ХС ЛНП и более высокую частоту достижения строгих целевых значений по сравнению с монотерапией статинами (аторвастатин и розувастатин) и была сопоставима по эффективности со СК розувастатина и эзетимиба. При этом профиль безопасности ФК розувастатина и эзетемиба не отличался от такового при монотерапии статинами и при применении СК. Значимого увеличения частоты клинически значимых изменений показателей АЛТ, АСТ, КФК и HbA1c, а также тяжелых нежелательных явлений не отмечено. Полученные данные подтверждают целесообразность более раннего и широкого применения комбинированной липидснижающей терапии, в том числе ФК розувастатина и эзетимиба, у пациентов с очень высоким сердечно-сосудистым риском, не достигающих целевых уровней ХС ЛНП на фоне терапии статинами. Ѓ
1Клинические рекомендации. Нарушения липидного обмена. 2023. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/preview-cr/752_1 (дата обращения: 10.10.2025).
Информация с rmj.ru