Офтальмология
Цель работы заключается в анализе закономерностей, связывающих генотип пациентов по гену PAX6 с клиническими проявлениями ВА.
Материал и методы: в анализ включены 98 пациентов с ВА из 73 неродственных семей с малыми мутациями в гене PAX6 (74 пациента) и крупными хромосомными делециями 11p13 (24 пациента). Сформированы группы пациентов со схожими по молекулярным последствиям генотипами или в соответствии с локализацией мутации. Составлены таблицы сопряженности 2Х2 между видом/расположением мутации и признаком ВА. Статистический анализ проведен с помощью точного критерия Фишера.
Результаты: установлено, что фенотипы ВА, ассоциированные с мутациями, приводящими к потере функции (нонсенс мутации, мутации сдвига рамки и сплайсинга), характеризуются более тяжелым клиническим течением. Миссенс-мутации ассоциированы с фенотипом, не отличающимся от такового в общей выборке, однако частичная аниридия встречается при миссенс-мутациях достоверно чаще. Фенотипы пациентов с хромосомными делециями, исключая делеции 3′ цис-регуляторной области, не отличаются от фенотипов пациентов с внутригенными PAX6 мутациями. Более мягкий фенотип наблюдается у пациентов с делециями 3′ цис-регуляторной области гена PAX6.
Ключевые слова: врожденная аниридия, мутации гена PAX6, хромосомные делеции региона 11p13, связь типа мутации с особенностями клинической картины.
Для цитирования: Васильева Т.А., Воскресенская А.А., Кадышев В.В., Поздеева Н.А., Марахонов А.В., Зинченко Р.А. Клинико-молекулярно-генетические особенности врожденной аниридии // РМЖ «Клиническая Офтальмология». 2018. №1. С. 7-12
Vasilyeva T. A.1, Voskresenskaya A. A.2, Kadyshev V. V.1, Pozdeyeva N. A.2, Marakhonov A. V.1,3, Zinchenko R. A.1,4
1 Research Center for Medical Genetics, Moscow
2 Cheboksary branch of S. Fyodorov Eye Microsurgery Federal State Institution
3 Moscow Institute of Physics and Technology (State University), Dolgoprudny
4 Pirogov Russian National Research Medical University, Moscow
Introduction: congenital aniridia (AN) is a Mendelian autosomal dominant disorder (population prevalence 1:57143). AN might occur as a part of WAGR syndrome (~13%). The main diagnostic signs of AN are absence of iris and fovea hypoplasia accompanied by nystagmus. Patients also show other eye structures as well as central nervous system anomalies. AN is caused by heterozygous mutations of the PAX6 gene or chromosome rearrangements of 11p13 region. There are no established correlation between the type of PAX6 mutation and the features of aniridia clinical picture.
Aim: the paper is to analyze probable relations between AN clinical features and the type of PAX6 mutation.
Patients and Methods: 98 patients with AN from 73 unrelated families with identified small PAX6 mutations (74 patients) and large chromosomal 11p13 deletions (24 patients) were analyzed. Patients were divided into the groups according to the type/location of mutation. Phenotypic traits were referred to the type/location of mutation. Contingency tables 2X2 were analyzed by the exact Fisher test.
Results: AN clinical picture associated with loss of function mutations (nonsense, frame shift and splicing) has more severe clinical course. Missense mutations are associated with character phenotype of general sample, however, partial aniridia occurs significantly more often. Phenotypes of patients with chromosomal deletions (without deletions of the 3′ cis-regulatory region), do not differ from that of patients with intragenic mutations. A milder phenotype is observed in patients with deletions of the 3′ cis-regulatory region.
Key words: congenital aniridia, PAX6 mutations, chromosome region 11p13 deletions, relationships between mutation type and clinical trait.
For citation: Vasilyeva T.A., Voskresenskaya A.A., Kadyshev V.V. at all. Clinical and molecular-genetic features of congenital aniridia // RMJ “Clinical ophthalmology”. 2018;1:7–12.
Статья посвящена изучению клинико-молекулярно-генетических особенностей врожденной аниридии. Выявлены особенности клинического течения врожденной аниридии в зависимости от обнаруженных мутаций.
Содержание статьи
Введение
Выявление взаимосвязи клинических особенностей фенотипа и подтвержденного молекулярно-генетическими методами генотипа позволяет не только уточнять дифференциальную диагностику заболевания, но и расширяет наши представления о клиническом течении заболевания и корректирует возможное лечение.
Врожденная аниридия (OMIM #106210) (ВА) — моногенная наследственная патология, имеющая общемировую распространенность в популяциях по всему миру, по данным регистра редких и орфанных болезней Orphanet, 1:57 143 населения [1]. Ведущими диагностическими признаками являются врожденное отсутствие ткани радужки, гипоплазия фовеа, сопровождается нистагмом [2].
В большинстве случаев ВА встречается как изолированная патология: спорадическая или семейная с аутосомно-доминантным типом наследования (85%) и синдромальная (15%). Синдромальная ВА в 13% случаев выявляется в составе синдрома WAGR (OMIM #194072), в 2% случаев наблюдаются нетипичные формы ВА с рецессивным наследованием [2]. Синдром WAGR характеризуется 4 клиническими симптомами: опухолью Вильмса, аниридией, аномалиями мочеполовой системы и задержкой умственного развития [3].
В большинстве случаев ВА обусловлена гетерозиготными мутациями в гене PAX6 (OMIM*607108) [4], располагающемся на 11 хромосоме, в т. ч. хромосомными перестройками (регион 11p13) [5]. Синдром WAGR обусловлен делециями региона 11p13, захватывающими локусы гена PAX6 и гена предрасположенности к развитию опухоли Вильмса — WT1 (OMIM*607102).
Вариабельность клинической картины может быть очень высока. Кроме основных признаков при ВА могут развиваться: помутнения и/или сублюксация хрусталика разной степени, кератопатия (у 80% пациентов), реже встречаются глаукома и гипоплазия зрительного нерва. При ВА отмечается значительное снижение остроты зрения [6]. Таким образом, в 85% случаев изолированной ВА кроме радужки поражены другие структуры глаза. В 10% случаев при изолированной ВА пороки развития структур глаза могут сопровождаться поражениями центральной нервной, эндокринной, мочеполовой и других систем и органов, отличными от признаков синдрома WAGR [7].
В настоящее время не установлено конкретных взаимосвязей между типом мутации гена PAX6 или наличием и размером хромосомной делеции региона 11p13 и особенностями клинической картины ВА, в т. ч. ее тяжестью [8].
Целью данной работы является поиск возможных гено-фенотипических корреляций между клинической картиной заболевания и генотипом, определенным в ходе подтверждающей диагностики.
Материал и методы
Научным коллективом лаборатории генетической эпидемиологии ФГБНУ «МГНЦ» впервые в России ранее был проведен молекулярно-генетический анализ 110 пациентов из 84 неродственных семей с предположительным диагнозом «врожденная аниридия» [9].
Подтверждающая и дифференциальная диагностика ВА проводилась в соответствии с протоколом, разработанным ранее в лаборатории генетической эпидемиологии ФГБНУ «МГНЦ» [10, 11]. От всех обследованных получено информированное согласие на обработку персональных данных и клинико-лабораторное обследование, исследование одобрено этическим комитетом ФГБНУ «МГНЦ».
Критериями включения пациентов в настоящий анализ гено-фенотипических корреляций были:
клинический диагноз ВА;
установленная молекулярная причина заболевания;
молекулярная причина ВА не является делецией WAGR-области, что может быть связано с ранним выявлением синдрома WAGR, который у данных пациентов еще не развился ввиду малого возраста (
наличие данных детального офтальмологического осмотра.
Согласно данным критериям, из дальнейшего анализа были исключены: 3 пациента без мутаций гена PAX6 или делеций хромосомной области 11р13; 3 больных без подробного описания клинической картины; 6 пациентов, у которых обнаружена делеция хромосомной области, критичной для развития WAGR синдрома.
Таким образом, в настоящий анализ гено-фенотипических корреляций включены 98 пациентов с ВА из 73 неродственных семей (44 спорадических случая и 54 семейных). Средний возраст — 16,9±16,8 года (варьирует от 6 мес. до 65 лет); большинство больных в выборке (66 человек, 67,3%) обследованы в возрасте до 12 лет. Соотношение по полу (мужчины : женщины) составляет 1:1,3. Клинический диагноз установлен в результате осмотра пациентов в ФГБНУ «МГНЦ» (52 пациента) и в Чебоксарском филиале ФГАУ «МНТК «Микрохирургия глаза» им. акад. С. Н. Федорова» (46 пациентов).
Среди данных пациентов ранее в результате секвенирования экзонов и фланкирующих участков интронов гена PAX6 мутации были определены у 74 человек (75,5%). Основную часть составляют мутации сдвига открытой рамки считывания и нонсенс-мутации, в сумме дающие 2/3 всех выявленных внутригенных мутаций.
У 24 пациентов (24,5%) методом MLPA определены различные делеции региона 11p13 [9].
Далее были сформированы группы пациентов со схожими по молекулярным последствиям генотипами, у которых анализировался фенотип по ключевым для ВА признакам.
Статистический анализ проведен с использованием точного критерия Фишера.
Результаты и обсуждение
Генетические причины ВА разделены на 6 групп: 4 группы малых мутаций гена PAX6: нонсенс-мутации (n=29 пациентов), миссенс-мутации (n=6), мутации сайтов сплайсинга и интронные варианты (n=14), нарушающие сплайсинг, небольшие инсерции и/или делеции, приводящие к сдвигу открытой рамки считывания (n=19), 2 группы крупных хромосомных перестроек: затрагивающие регион 11p13 без учета делеций 3′-цис-регуляторной области гена PAX6 (n=11) и хромосомные делеции региона 11p13, затрагивающие только 3′ цис-регуляторную область (n=13) (табл. 1).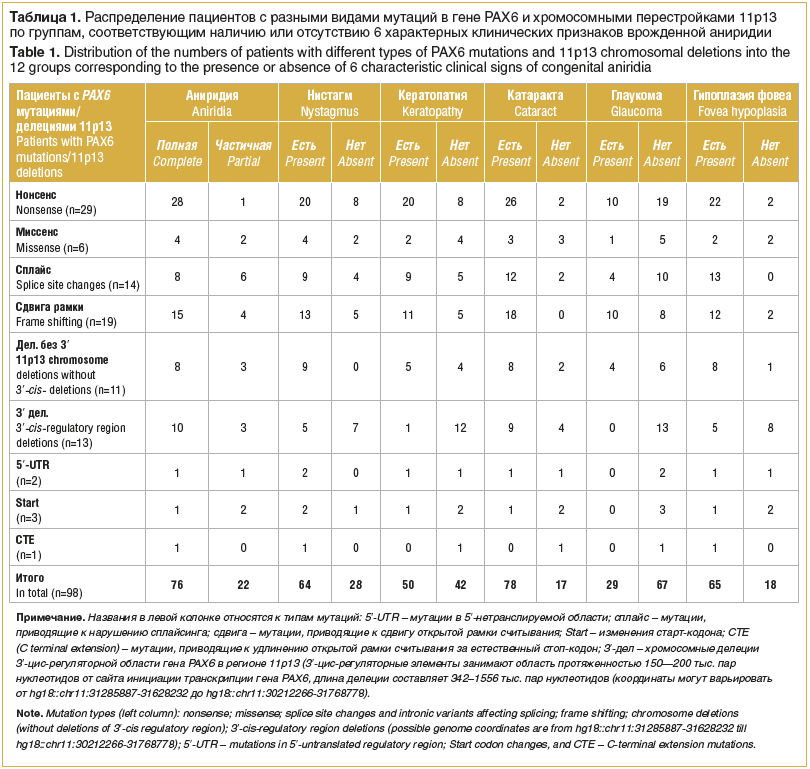
Выделено 6 характерных клинических признаков ВА: наличие полной или частичной аниридии, нистагма, кератопатии 1—3 стадии, катаракты (без разделения на врожденную и осложненную), глаукомы (также без разделения на врожденную и осложненную) и гипоплазии центральной ямки сетчатки.
Для поиска взаимосвязи между характерными фенотипическими признаками, часто встречающимися у пациентов с ВА, и обнаруженными типами мутаций были построены таблицы сопряженности 2Х2, которые проанализированы с помощью точного критерия Фишера (табл. 2).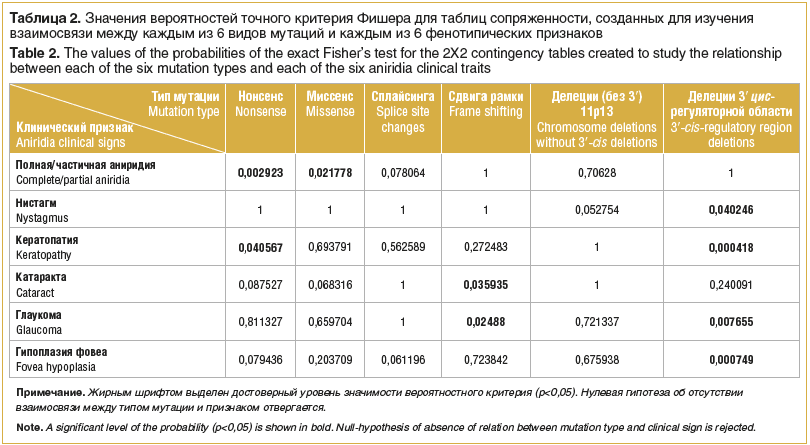
В результате анализа выявлено несколько закономерностей. При нонсенс-мутациях достоверно чаще наблюдаются полное отсутствие ткани радужки и развитие кератопатии (p=0,002923 и p=0,040567 соответственно).
У пациентов с мутациями сдвига открытой рамки считывания достоверно чаще развиваются катаракта и глаукома (p=0,035935 и p=0,02488 соответственно).
Частичная аниридия встречается при миссенс-мутациях достоверно чаще (p=0,021778), чем при остальных типах мутаций.
Более мягкий фенотип достоверно чаще наблюдается у пациентов с делециями 3′-цис-регуляторной области гена PAX6. Для него характерно отсутствие нистагма, глаукомы, кератопатии, гипоплазии фовеа (p=0,040246, p=0,000418, p=0,007655, p=0,00074 соответственно).
Фенотипы пациентов с хромосомными делециями, исключая делеции 3′-цис-регуляторной области, не отличаются от фенотипов пациентов в общей выборке и не выделяются в отдельную группу (p>0,1).
В 1998 г. S. K. Gupta et al., опираясь на мнение Т. Glaiser et al. о возможности разной степени повреждения функций PAX6 и деления патогенных аллелей на 3 класса: аморфные, гипоморфные или неоморфные, предположили и впервые проанализировали существование гено-фенотипических корреляций при ВА [12, 13]. Допуская разные роли изоформ белка, содержащих разные домены, S. K. Gupta et al. предположили, что некоторые клинические признаки ВА вызваны повреждением разных доменов белка PAX6. По их мнению, катаракта чаще ассоциирована с мутациями, разрушающими PST домен, а развитие повреждений сетчатки — с мутациями в парном домене. Однако высказанная теория не была подтверждена статистически достоверными методами, что, вероятно, связано с небольшой рассматриваемой выборкой пациентов с ВА (n=11).
Наши результаты частично согласуются с процитированными выше авторами [8, 12, 13]. Теория Т. Glaiser et al. о трех разных типах мутантных аллелей PAX6, т. е. о разных последствиях разного типа мутаций и исходно разном индивидуальном уровне экспрессии PAX6 под влиянием генетического фона, превосходно объясняет клиническую гетерогенность ВА, выявленную и в нашем исследовании [12]. I. Tzulaki et al., не находя никаких статистически значимых корреляций фенотипа от генотипа, объясняют сглаживание различий в последствиях нонсенс-мутаций и мутаций сдвига открытой рамки считывания разной локализации существованием универсального механизма деградации мРНК с преждевременным стоп-кодоном (NMD), независимо от того, где локализована мутация, приводящая к возникновению PTS [8]. Однако и S. K. Gupta et al. отчасти оказались правы в том, что локализация мутации может влиять на тип повреждения функции PAX6.
Для проверки гипотезы S. K. Gupta et al. проведен дополнительный анализ, для которого идентифицированные в нашем исследовании мутации разделены на 6 групп по принципу их локализации. Проанализирована возможная зависимость каждого из 6 характерных клинических признаков ВА от локализации мутаций в разных доменах белка PAX6 (табл. 3).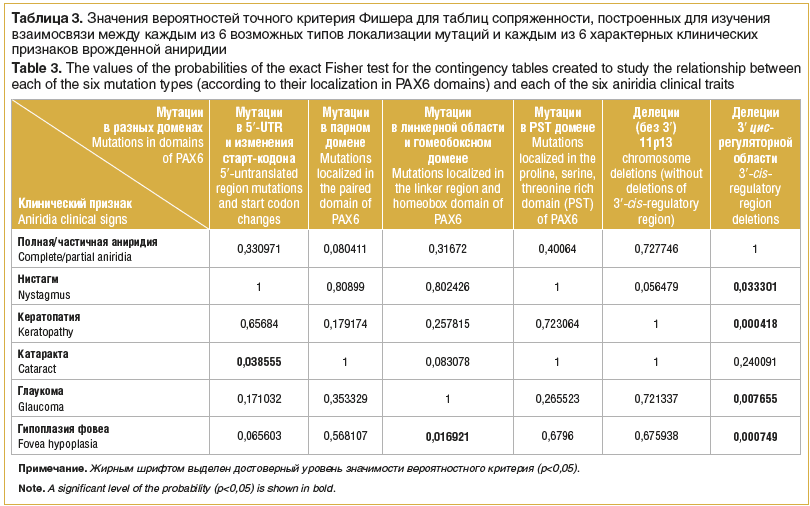
Данный анализ показал, что, в отличие от данных S. K. Gupta et al. [12], с гипоплазией фовеа достоверно чаще ассоциированы только мутации в линкерной области и гомеодомене (p=0,016921). Достоверная зависимость получена также для признака развития катаракты и небольшой группы мутаций в 5′-UTR и изменений старт-кодона.
В нашей работе мы разделили мутации не по принципу их локализации в определенных доменах белка PAX6, а по категориям, предположительно отражающим типы повреждения функции. Таким образом, мы в полной мере следовали принципу теории Т. Glaiser et al. о соответствии клинической картины типу мутантного аллеля: в разной степени гипоморфного или полностью аморфного [13]. Гипоморфные аллели, по всей видимости, продуцируются миссенс-мутациями и делециями 3′ цис-регуляторной области гена PAX6, не затрагивающими его кодирующую последовательность. Им соответствуют более мягкие фенотипы. Аморфные аллели с полной потерей функции продуцируются нонсенс-мутациями и мутациями, приводящими к сдвигу открытой рамки считывания, особенно если эти мутации повреждают N-конец белка (парный и гомеодомены), а также хромосомными делециями 11р13, захватывающими кодирующую последовательность гена PAX6.
Заключение
В связи с высокой генетической гетерогенностью и клиническим полиморфизмом до сих пор не были установлены гено-фенотипические корреляции при ВА. В первую очередь это связано с необходимостью достаточного количества больных в анализируемой выборке и наличием подробного описания клинической картины ВА у этих пациентов. Использование выборки из 98 пациентов позволило изучить и впервые выявить гено-фенотипические корреляции в группе пациентов с ВА. Проанализированы возможные взаимосвязи между каждым из 6 видов мутаций в гене PAX6 (нонсенс, сдвига открытой рамки считывания, миссенс, сплайсинга или делециями 11р13, захватывающими только регуляторный регион или кодирующую последовательность гена PAX6) и каждым из основных характерных фенотипических признаков ВА.
В результате исследования впервые установлены следующие закономерности. При нонсенс-мутациях достоверно чаще наблюдаются полное отсутствие ткани радужки и развитие кератопатии, при мутациях сдвига открытой рамки считывания достоверно чаще развиваются катаракта и глаукома, таким образом, фенотипы, ассоциированные с мутациями, приводящими к потере функции, характеризуются более тяжелым клиническим течением, что, возможно, обусловлено значительным повреждением функции гена из-за полной потери одного аллеля. Несинонимичные замены ассоциированы с таким же, как и в общей выборке, фенотипом ВА, однако частичная аниридия встречается при миссенс-мутациях достоверно чаще, чем при остальных типах мутаций. Фенотипы пациентов с хромосомными делециями, исключая делеции 3′ цис-регуляторной области, не отличаются от фенотипов пациентов с внутригенными PAX6 мутациями. Более мягкий фенотип сразу по нескольким клиническим признакам наблюдается у пациентов с делециями
3′ цис-регуляторной области гена PAX6.
Выявление особенностей клинического течения ВА в зависимости от обнаруженных мутаций представляет не только клинический, но и значительный научный интерес, т. к. свидетельствует об одном из реально функционирующих в организме человека механизмов регуляции функции гена PAX6.
Литература
1. Nguengang Wakap S. Prevalence of rare diseases: Bibliographic data. 2017 Contract No.: Number 2: Diseases listed by decreasing prevalence, incidence or number of published cases.
2. Васильева Т. А., Воскресенская А. А., Хлебникова О. В. и др. Дифференциальная диагностика наследственных форм врожденной аниридии с позиций современной генетики. Вестник РАМН. 2017;72 (4):233–241 [Vasilyeva T.A., Voskresenskaya A. A., Khlebnikova O. V. et al. Genetic approaches to differential diagnosis of hereditary forms of congenital aniridia. Annals of the Russian academy of medical sciences. 2017;72 (4):233–241 (in Russ.)].
3. Марахонов А. В., Васильева Т. А., Хлебникова О. В. и др. Микроделеции локуса гена WT1 резко повышают риск развития опухоли Вильмса у пациентов с врожденной аниридией. Успехи молекулярной онкологии. 2016;3 (4):122–123 [Marakhonov A.V., Vasilyeva T. A., Khlebnikova O. V. et. al. WT1 locus microdeletions confer high risk for the development of Wilms’ tumor in patients with congenital aniridia. Advances in Molecular Oncology. 2016;3 (4):122–123 (in Russ.)].
4. Hingorani M., Hanson I., van Heyningen V. Aniridia. Eur J Hum Genet. 2012;20 (10):1011–1017.
5. Robinson D. O., Howarth R. J., Williamson K. A. et al. Genetic analysis of chromosome 11p13 and the PAX6 gene in a series of 125 cases referred with aniridia. Am J Med Genet A. 2008;146A (5):558–569.
6. Hingorani M., Williamson K. A., Moore A. T., van Heyningen V. Detailed ophthalmologic evaluation of 43 individuals with PAX6 mutations. Invest Ophthalmol Vis Sci. 2009;50 (6):2581–2590.
7. Käsmann-Kellner B., Seitz B. [Aniridia syndrome: clinical findings, problematic courses and suggestions for optimization of care (“aniridia guide”)]. Ophthalmologe. 2014;111 (12):1145–1156.
8. Tzoulaki I., White I. M., Hanson I. M. PAX6 mutations: genotype-phenotype correlations. BMC Genet. 2005;6:27.
9. Vasilyeva T. A., Voskresenskaya A. A., Käsmann-Kellner B. et al. Molecular analysis of patients with aniridia in Russian Federation broadens the spectrum of PAX6 mutations. Clin Genet. 2017;92 (6):639–644.
10. Васильева Т. А., Хлебникова О. В., Марахонов А. В. и др. Изучение генетических основ и разработка протоколов для диагностики наследственных заболеваний органа зрения на примере врожденной аниридии. Медицинская генетика. 2016;15 (6):37–43 [Vasilyeva T.A., Khlebnikova O. V., Marakhonov A. V. et al. Study of genetics and design of the test-system for diagnosis of eye anterior chamber hereditary disorders: the case of congenital aniridia. Medical Genetics. 2016;15 (6):37–43 (in Russ.)].
11. Марахонов А. В., Васильева Т. А., Воскресенская А.А и др. Опыт применения медицинской технологии диагностики врожденной аниридии в ФГБНУ «МГНЦ». Медицинская генетика. 2017;16 (11):23–26 [Marakhonov A.V., Vasilyeva T. A., Voskresenskaya A. A. et al. Application of medical technology for the diagnosis of congenital aniridia at the Research Centre for Medical Genetics. Medical Genetics. 2017;16 (11):23–26 (in Russ.)].
12. Gupta S. K., De Becker I., Tremblay F. et al. Genotype/phenotype correlations in aniridia. Am J Ophthalmol. 1998;126 (2):203–210.
13. Glaser T., Jepeal L., Edwards J. G. et al. PAX6 gene dosage effect in a family with congenital cataracts, aniridia, anophthalmia and central nervous system defects. Nat Genet. 1994;7 (4):463–471.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
материал с сайта https://www.rmj.ru/
