Введение
Около 339 млн человек во всем мире страдают бронхиальной астмой (БА), при этом примерно у 5–10% диагностируется тяжелая БА (ТБА) [1]. Неоптимальный контроль астмы оказывает значительное влияние на пациентов, приводя к снижению качества жизни, увеличению числа обострений, госпитализаций, смертности и расходов на лечение [2]. Кроме того, ТБА часто ассоциирована с приемом пероральных глюкокортикостероидов (оГКС), назначаемых либо периодически для лечения обострений, либо в качестве поддерживающей терапии и приводящих к развитию ряда нежелательных явлений [3]. ТБА характеризуется тем, что остается неконтролируемой, несмотря на соблюдение максимально оптимизированной терапии (высокие дозы ингаляционных ГКС (иГКС) в комбинации с длительно действующими холинолитиками), приверженность лечению, адекватную технику ингаляции, отсутствие влияния сопутствующих заболеваний или потери контроля, когда лечение высокими дозами сокращается[1].
Патогенез ТБА реализуется посредством различных воспалительных путей [4]. За последние десятилетия появились более глубокие и дифференцированные представления о патофизиологических изменениях, лежащих в основе БА, что позволило определить фенотипы заболевания и внедрить в практику таргетную биологическую терапию [6]. Еще 2–3 года назад лечение БА было направлено на достижение контроля заболевания [5]. Однако с внедрением биологических методов лечения, направленных на основные механизмы воспаления, в качестве достижимой цели лечения ТБА стали рассматривать клиническую ремиссию [6]. В настоящее время воздействие на специфические медиаторы, участвующие в каскаде воспалительных процессов, с использованием биологических препаратов дает возможность достичь оптимального контроля заболевания. Поэтому при диагностировании тяжелой формы БА рекомендуется направить пациента в специализированный центр для фенотипического исследования и оценки возможности проведения дополнительной терапии моноклональными антителами1. После выбора потенциально наиболее эффективного биологического препарата важно подтвердить правильность терапевтической стратегии, оценив возможность достижения клинической ремиссии.
Концепция клинической ремиссии, достигаемой на фоне терапии генно-инженерными биологическими препаратами (ГИБП), рассматривается GINA как долгосрочная цель лечения ТБА1. Клиническая ремиссия подразумевает состояние низкой активности заболевания или его полного отсутствия в течение определенного периода времени, которое может быть как спонтанным, так и достигнутым в результате терапии [7–9]. Были предложены критерии ремиссии ТБА, включающие отсутствие симптомов и обострений, улучшение функции легких, полное прекращение приема системных ГКС и взаимное согласие между пациентом и лечащим врачом относительно состояния ремиссии заболевания1 [6]. Консенсус рабочей группы Американского колледжа аллергии, астмы и иммунологии, Американской академии аллергии, астмы и иммунологии и Американского торакального общества предложил объективные параметры определения клинический ремиссии: отсутствие обострений, потребовавших приема оГКС: отсутствие обострений, потребовавших госпитализации, ACQ-5<1,5 или 0,75; ACT≥20; ОФВ1≥80% или увеличение ОФВ1≥100 мл и/или >20% по сравнению с исходным уровнем [10]. В настоящее время отсутствие согласованности в оценке используемых критериев клинической ремиссии астмы как в исследованиях реальной практики, так и в рандомизированных клинических исследованиях (РКИ), приводит к противоречивым результатам.
Клиническая ремиссия БА может развиваться как часть естественного течения заболевания, и ее распространенность у взрослых пациентов может варьировать от 2 до 52% [11]. Достижение клинической ремиссии у пациентов с ТБА, в 70–89% случаев имеющих фенотип 2-го типа, стало возможно на фоне применения терапии моноклональными антителами [12, 13].
Цель исследования: оценить возможность достижения клинической ремиссии у пациентов с ТБА, получающих ГИБП, в реальной клинической практике.
Материал и методы
Было обследовано 215 больных ТБА, получающих генно-инженерную биологическую терапию (ГИБТ) в Экспертном центре по профилю «пульмонология» СПб ГБУЗ «ГМПБ № 2».
В исследование были включены пациенты в возрасте 18 лет и старше с ТБА, подписавшие информированное согласие и отвечающие всем диагностическим критериям в соответствии с федеральными клиническими рекомендациями по лечению и диагностике БА[2]. Отсутствие контроля БА при применении высоких доз иГКС, бронходилататоров длительного действия, антилейкотриеновых препаратов и/или оГКС явилось основанием для назначения таргетного биологического препарата. Все пациенты должны были использовать базисную ингаляционную терапию и правильно пользоваться ингаляционными устройствами.
Критерии исключения: клинически значимая патология сердечно-сосудистой системы (острый инфаркт миокарда или нестабильная стенокардия в течение 6 мес. до включения, нарушения ритма, хроническая сердечная недостаточность III–IV функционального класса); острое инфекционное заболевание или обострение хронической инфекции на момент включения в исследование.
Развитие и прогрессирование БА у пациентов, включенных в исследование, было ассоциировано с Т2-воспалением, основными биомаркерами которого являются эозинофилы крови и мокроты, уровень сывороточного IgЕ и концентрация оксида азота в выдыхаемом воздухе.
Назначение ГИБТ проводилось в соответствии с федеральными клиническими рекомендациями 2.
Омализумаб назначали преимущественно пациентам молодого возраста с наличием клинически значимой атопии с подтвержденной связью между экспозицией аллергенов и развитием симптомов/обострений БА и исходным уровнем IgE в сыворотке крови >30 ЕД/мл и <1500 МЕ/мл. Для назначения бенрализумаба или меполизумаба количество эозинофилов в периферической крови должно было превышать 300/мкл, а у пациентов, которые постоянно или часто получали оГКС, — 150/мкл. Дупилумаб был рекомендован при эозинофилии крови ≥150 и ≤1500 клеток/мкл или пациентам с гормонозависимой БА, получающим системные ГКС (независимо от числа эозинофилов в периферической крови)1.
В каждой группе пациентов, получающих один из таргетных препаратов, определяли число пациентов, достигших клинической ремиссии ТБА, на основании следующих критериев: исчезновение симптомов астмы (ACQ-5≤1,5), отсутствие обострений на протяжении 12 мес., прекращение приема оГКС и ОФВ1≥80%, — которые оценивали исходно, на каждом визите и через 12 мес. после инициации таргетной биологической терапии. Помимо этого, определяли количество эозинофилов в периферической крови и уровень IgE.
Статистическую обработку проводили с использованием стандартного пакета прикладного статистического анализа Statistica for Windows 7,0.
Результаты и обсуждение
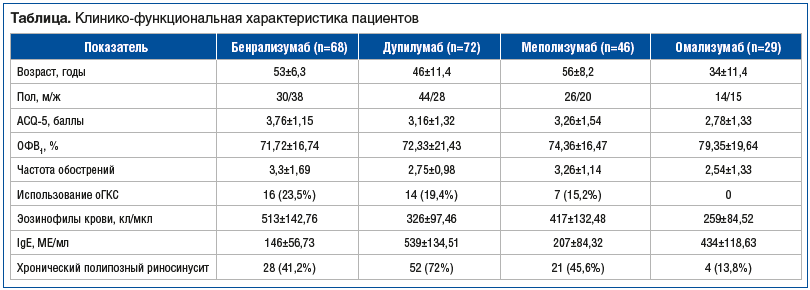
Анализируемые группы существенно не различались по возрасту, полу, контролю симптомов, частоте обострений БА и параметрам вентиляционной функции легких (см. таблицу). Уровень эозинофилов крови у всех включенных в исследование пациентов превышал 150 кл/мкл. Исходный уровень IgЕ был достоверно выше в группах пациентов, получавших дупилумаб и омализумаб. У 48,8% пациентов в качестве коморбидной патологии имел место хронический полипозный риносинусит.
В соответствии с графиком визитов, определяемым сроком введения препаратов, с установленной кратностью оценивали клинико-функциональные и лабораторные показатели: симптомы заболевания (ACQ-5); данные спирометрии, клинического анализа крови, биохимического анализа крови, ЭКГ.
Через 12 мес. лечения обострения отсутствовали у 49 (72%) пациентов, получавших бенрализумаб, у 54 (75%) получавших дупилумаб, у 35 (76%) — меполизумаб и у 20 (69%) — омализумаб.
Среди пациентов, у которых отсутствовали обострения на протяжении 12 мес. применения ГИБТ, не использовали оГКС 41 (60%) больной, получавший бенрализумаб, 45 (62%) получавших дупилумаб, 31 (67%) — меполизумаб и 20 (69%) — омализумаб. Достичь контроля симптомов (ACQ-5≤1,5 балла) при отсутствии обострений и применения оГКС на протяжении 1 года приема ГИБТ удалось у 33 (49%) больных, получавших бенрализумаб, 36 (50%) получавших дупилумаб, 22 (47%) — меполизумаб, 9 (31%) — омализумаб. Далее во всех терапевтических группах проводили отбор пациентов с ОФВ1≥80% на фоне лечения, что являлось последним критерием комплексной оценки достижения клинической ремиссии.
Таким образом, среди пациентов, получавших бенрализумаб, достиг клинической ремиссии 21 (31%) человек, среди получавших дупилумаб — 25 (35%), меполизумаб — 13 (28%), омализумаб — 8 (28%). При этом процент пациентов, достигших клинической ремиссии из числа получающих дупилумаб, соответствует результатам, полученным в исследованиях QUEST и TRAVERSE [14]. Анализ двух РКИ показал, что 35% пациентов, получавших дупилумаб, достигли клинической ремиссии через 12 мес. наблюдения и 36,1% — через 24 мес. наблюдения [14]. В РКИ клиническая ремиссия при использовании дупилумаба была достигнута у 31,6%, а у 21,3% ответ на терапию отсутствовал [15].
В исследовании B. Sposato et al. [11] клиническая ремиссия БА была достигнута при лечении омализумабом, меполизумабом, бенрализумабом и дупилумабом у 21,8, 23,6, 35,8 и 23,5% пациентов соответственно. Недавно проведенное РКИ показало, что распространенность клинической ремиссии БА, достигнутой при применении меполизумаба и бенрализумаба, составила 30,12 и 40,00% соответственно [16]. Разная частота достижения клинической ремиссии прежде всего обусловлена различным числом применяемых критериев оценки. Так, согласно результатам австралийского регистра меполизумаба (Australian Mepolizumab Registry) и австралийского регистра ксолара (Australian Xolair Registry), клиническая ремиссия была отмечена у 29,3% (73/249) и 22,8% (37/162) пациентов соответственно. Оценка включала отсутствие обострений и применения оГКС и ACQ-5≤1 через 12 мес. Когда при определении клинического результата были добавлены показатели функции легких (ОФВ1≥80% после приема бронхолитиков) через 12 мес., доля клинических ремиссий снизилась до 25,2 и 19,1% соответственно [17]. Кроме того, оценка достижения клинической ремиссии зависит от определения степени контроля БА в соответствии с используемыми опросниками (ACQ-5 ≤1,5 или 0,75), что было наглядно продемонстрировано при анализе результатов лечения пациентов с ТБА бенрализумабом в исследованиях SIROCCO/CALIMA. При использовании порогового уровня ACQ-5≤1,5 клиническая ремиссия определялась у 23,9% пациентов, а в случае ACQ-5≤0,75 — лишь у 14,5% [18].
В настоящее время проводится поиск предикторов, прогнозирующих лучший клинический ответ на лечение тем или иным ГИБП и возможность достижения «полной клинической ремиссии астмы». В качестве предпосылок достижения клинической ремиссии рассматривают раннее начало биологической терапии, меньшую продолжительность заболевания и менее тяжелое его течение, незначительные ремоделирование и обструкцию дыхательных путей, а также небольшую дозу ГКС и непродолжительное их использование1 [19]. Существует множество факторов, препятствующих оптимальному ответу на терапию. Прежде всего следует отметить несоблюдение режима приема лекарств, курение, ожирение [19], отсутствие приверженности лечению. Следует отметить, что несоблюдение режима ингаляционной терапии является одной из основных позиций, которую необходимо учитывать при анализе «астмы, которую трудно контролировать» [20]. Сопутствующие заболевания, связанные с астмой, также являются важными факторами, которые следует принимать во внимание, когда речь заходит о достижении ремиссии [21]. Такие состояния, как полипозный риносинусит, дисфункция голосовых связок, ожирение, обструктивное апноэ во сне, синдром гипервентиляции и гастроэзофагеальный рефлюкс, необходимо выявлять, оценивать и лечить у всех пациентов [22]. Морфологическими субстратами, препятствующими достижению ремиссии ТБА, являются структурные изменения дыхательных путей: стойкая (фиксированная) обструкция, наличие бронхоэктазов и гиперсекреция слизи.
Разнообразие воспалительных процессов, определяющих развитие БА, требует применения точных медицинских подходов, а это в свою очередь повышает вероятность успеха в достижении клинической ремиссии астмы и реализации принципа «от лечения к цели» [7].
Заключение
Появление нового класса препаратов для лечения ТБА позволило изменить цель лечения — от контроля заболевания к обеспечению наилучших возможных его исходов. Достижение клинической ремиссии является инструментом для реализации новой цели, однако на сегодняшний день отсутствует однозначная трактовка параметров клинической ремиссии. Это является одной из основных причин в различиях оценки степени достижения ремиссии не только в реальной клинической практике, но и в РКИ.
Список литературы Вы можете найти на сайте http://www.rmj.ru
[1] 2024 GINA Main Report — Global Initiative for Asthma — GINA. (Electronic resource.) URL: https://ginasthma.org/2024-gina-main-report (access date: 10.01.2025).
[2] Клинические рекомендации «Бронхиальная астма». Министерство здравоохранения Российской Федерации. 2021. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/recomend/359_2 (дата обращения: 22.12.2024).
Информация с rmj.ru





