Введение
Хроническая венозная недостаточность (ХВН) нижних конечностей является широко распространенным заболеванием, финальной стадией которого (C6 по классификации CEAP) выступает формирование трофической язвы [1]. Патогенез венозных трофических язв (ВТЯ) сложен и многокомпонентен, ключевую роль играют хроническое воспаление, гипоксия тканей и критическое нарушение процессов ангиогенеза [1, 2]. Центральным звеном являются дисфункция эндотелия и дисбаланс между деградацией внеклеточного матрикса, опосредованной матриксными металлопротеиназами, и способностью к неоваскуляризации [2, 3]. Несмотря на существующий арсенал методов, проблема поиска эффективных стимуляторов репарации тканей остается актуальной [4].
В настоящее время все большее внимание уделяется терапии биологическими факторами роста, способными целенаправленно модулировать клеточные процессы в ране [5]. Современные систематические обзоры демонстрируют, что применение факторов роста, таких как фактор роста эндотелия сосудов (VEGF), фактор роста фибробластов (bFGF) и тромбоцитарный фактор роста (PDGF), может статистически значимо улучшить показатели заживления хронических ран, включая венозные язвы, сократить время до полной эпителизации и уменьшить площадь раневого дефекта [5].
Ангиогенин представляет собой белок из семейства рибонуклеаз, являющийся одним из наиболее мощных стимуляторов ангиогенеза [3]. В отличие от классических факторов роста, таких как VEGF, ангиогенин обладает уникальным механизмом действия, включая прямую стимуляцию эндотелиальных клеток, активацию внутриклеточных сигнальных путей (MAPK, PI3K/Akt) и рибонуклеазную активность, модулирующую синтез рРНК и клеточный метаболизм [3, 6]. Исследования показывают значимое повышение сывороточного уровня ангиогенина у пациентов с ВТЯ по сравнению со здоровыми лицами, что свидетельствует о вовлеченности его системы в патогенез заболевания [2]. Это обосновывает целесообразность экзогенного введения ангиогенина для усиления ангиогенного ответа.
Представляем наш первый опыт местного и инъекционного использования рекомбинантного ангиогенина в лечении ВТЯ.
Содержание статьи
Собственный опыт
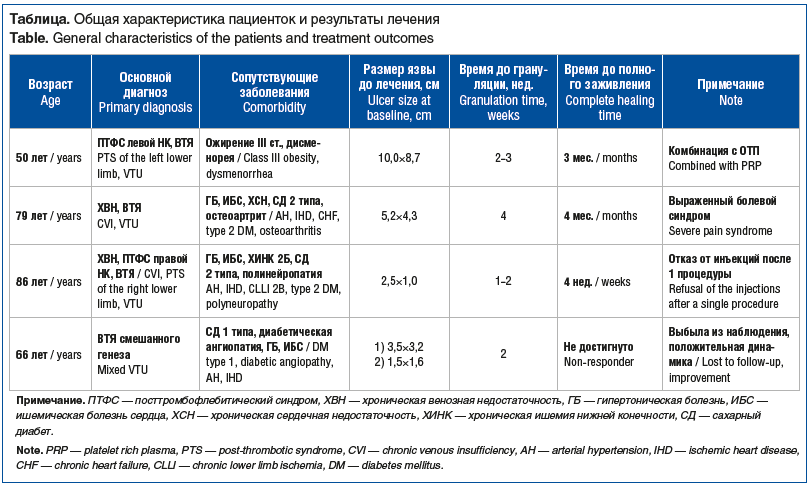
Под нашим наблюдением находились 4 пациентки с трофическими язвами венозной и смешанной этиологии стадии C6 по классификации CEAP, резистентные к стандартному консервативному лечению (компрессионная терапия, современные раневые покрытия) в течение не менее 3 мес. Критерии невключения: наличие критической ишемии конечности (лодыжечно-плечевой индекс <0,5), гангрена, онкологические заболевания в анамнезе, системные аутоиммунные заболевания, прием иммуносупрессивной терапии.
Всем пациенткам на протяжении всего периода наблюдения проводилось стандартное базисное лечение, включающее компрессионную терапию (эластичное бинтование или трикотаж II–III класса) и современные раневые покрытия, адекватные фазе раневого процесса. В качестве адъювантного метода применяли средство на основе рекомбинантного человеческого ангиогенина в двух формах.
Форма раствора — сыворотка-мезококтейль MAIN#1 PDRN 3,0 мл. Раствор рекомбинантного ангиогенина (2 мкг/мл) вводили периульцерально и/или в дно язвы. Объем вводимого раствора подбирали индивидуально, в зависимости от площади и глубины язвенного дефекта он составлял от 0,5 до 3,0 мл на процедуру. Инъекции выполняли по принципу «наполнения» тканей периульцеральной зоны и дна язвы до визуально определяемого напряжения тканей. Выбор данной дозировочной схемы был основан на общих принципах локального применения факторов роста в регенеративной медицине, предполагающих создание высокой локальной концентрации биологически активного вещества [1, 2]. Прямых аналогов использования инъекционной формы ангиогенина для лечения ВТЯ в доступной литературе на момент проведения лечения обнаружено не было, что определяет новизну представленного подхода.
Процедуры проводили с интервалом 7–21 день. Интервал применения был ориентирован на фактическое обращение пациентки. Курс лечения составлял от 1 до 5 процедур в зависимости от переносимости и динамики.
Гелевая форма — ультрарегенерирующий гель (20 мкг/мл) наносили на раневую поверхность ежедневно после проведения туалета раны. В 1 наблюдении инъекции ангиогенина сочетали с введением обогащенной тромбоцитами аутоплазмы (ОТП), полученной путем дифференциального центрифугирования аутологичной цельной крови по стандартной методике [7]. При выраженном болевом синдроме (наблюдение 2) инъекции выполняли на фоне аппликационной (крем лидокаин + прилокаин) и инфильтрационной (лидокаин 20 мг/мл) анестезии.
Основными критериями эффективности считали динамику площади раневого дефекта (оценивали методом планиметрии по фотографиям), время до появления активных грануляций, уменьшение болевого синдрома (по субъективной оценке пациента) и время до полного заживления (полной эпителизации). Исследование проведено в соответствии с принципами Хельсинкской декларации. От всех пациентов получено добровольное информированное согласие на проведение лечения и публикацию обезличенных данных и фотоматериалов.
Общая характеристика пациенток и результаты лечения представлены в таблице.
Для наглядного представления достигнутых результатов приводим описания клинических наблюдений.
Клиническое наблюдение 1
Пациентка, 50 лет (1973 г. р.). Жалобы при обращении (январь 2023 г.) на наличие длительно незаживающей язвы по медиальной поверхности левой голени, боли различного характера, отек в верхних отделах голени, уменьшение объема мягких тканей дистально, серозно-гнойное отделяемое из язвы.
Анамнез заболевания: 3 года назад перенесла тромбоз глубоких вен левой голени. В 2022 г. выполнена эндовазальная лазерная коагуляция ствола большой подкожной вены, на фоне которой язвенный дефект уменьшился, но не закрылся полностью. Длительно получала консервативное лечение без выраженного эффекта: флеботоники, антикоагулянты, местно — мазевые формы антибиотиков, препараты для стимуляции регенерации (депротеинизированный гемодериват крови телят, метилурациловая мазь, Эплан), компрессионный трикотаж II класса.
Локальный статус: на медиальной поверхности левой голени трофическая язва 10,0×8,7 см, с неровными контурами, покрыта фибриновым налетом, имеет специфический запах. Края цианотичны, инфильтрированы. Грануляции вялые, островковые в центре. Признаки перифокального воспаления.
Сопутствующая патология: варикозная болезнь, ХВН, ПТФС левой нижней конечности. Ожирение III степени (ИМТ 37,8 кг/м2). Дисменорея.
Лечение: 1-й этап: антибактериальная терапия (системно и местно) с учетом результатов посева, местная обработка раствором повидон-йода 10%, на фоне эластической компрессии (компрессионный гольф II класса компрессии). 2-й этап (после санации язвы) — курс из 5 процедур инъекций раствора ангиогенина в комбинации с ОТП (периульцерально и в дно язвы) с интервалом 7–14 дней. Инъекции ангиогенина сочетались с введением ОТП. Процедура приготовления инъекционной композиции выполнялась в следующей последовательности:
Забор и подготовка ОТП: проводили забор периферической венозной крови пациентки в объеме 15–20 мл в специальные пробирки, содержащие антикоагулянт (цитрат натрия). Пробирки центрифугировали при заданных параметрах (3500 об/мин в течение 5 мин) для разделения фракций. После центрифугирования ОТП аккуратно аспирировали в отдельный шприц.
Приготовление рабочей смеси: непосредственно перед введением содержимое шприца с ОТП и шприца с раствором ангиогенина в объеме 3,0 мл смешивали в одном шприце путем последовательного перевода поршня через трехходовый кран.
Техника введения: активированную смесь вводили немедленно, путем множественных инъекций (техника «наполнения» или «мезотерапевтическая техника») периульцерально в область краев язвы и в ее дно, создавая равномерное распределение раствора в тканях. Общий объем введенной композиции составлял от 4,0 до 6,0 мл на процедуру.
Данная методика позволяла обеспечить непосредственный контакт ангиогенина с активированными тромбоцитами и синергичное высвобождение широкого спектра эндогенных факторов роста (PDGF, VEGF, TGF-β и др.) непосредственно в зоне репарации.
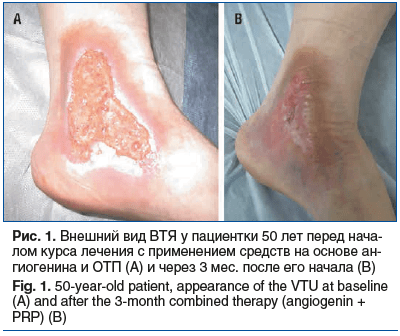
Ежедневно применяли гель ангиогенина. Результаты: через 2–3 нед. — появление активных грануляций, через 1,5 мес. — уменьшение площади дефекта на 70%, через 3 мес. — полное заживление (рис. 1).
Клиническое наблюдение 2
Пациентка, 79 лет (1944 г. р.). Жалобы на длительно незаживающую язву левой голени, боль, обильное отделяемое, мокнутие, запах.
Анамнез заболевания: язва возникла 3–4 мес. назад после микротравмы. Лечилась народными средствами с отрицательной динамикой.
Локальный статус: язва размером 5,2×4,3 см, глубиной 0,32 см. Края фестончатые, инфильтрированы, фибриновый налет. Выраженный перифокальный отек, гиперемия, цианоз. Грануляции отсутствуют, отделяемое — лимфорея.
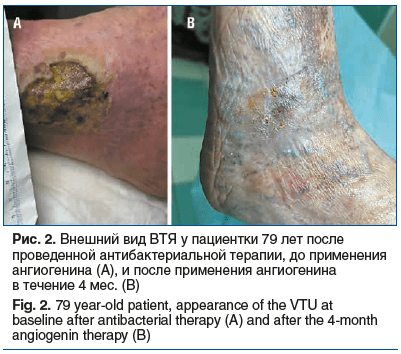
Сопутствующая патология: ГБ 2 ст., ИБС, ХСН, СД 2 типа (инсулиннезависимый, субкомпенсация), дорсопатия, остео-артрит. Лечение: 1-й этап: антибактериальная терапия, местно — гидроактивные повязки. 2-й этап: курс из 5 инъекций раствора ангиогенина (периульцерально) на фоне аппликационной и инфильтрационной анестезии (интервал 14–21 день). Ежедневно — гель ангиогенина. Компрессия в виде эластического бинтования. Результаты: через 2,5 мес. — уменьшение дефекта на 75–80%, через 4 мес. — полное заживление (рис. 2).
Клиническое наблюдение 3
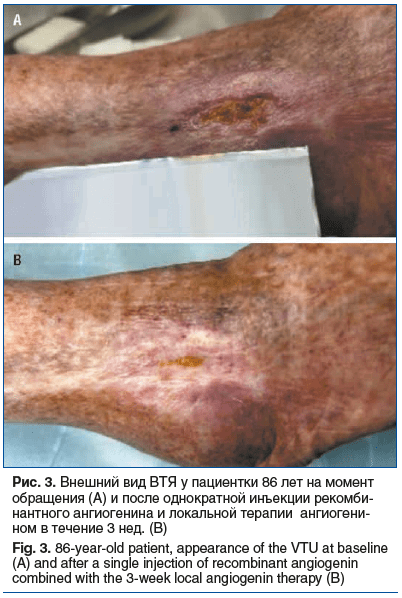
Пациентка, 86 лет (1937 г. р.). Жалобы на выраженный болевой синдром в области язвы правой голени, хромоту, нарушение сна.
Анамнез заболевания: в анамнезе тромбоз (2019 г.), рецидивирующие язвы. Данная язва возникла 4 мес. назад после микротравмы. Лечилась самостоятельно (депротеинизированный гемодериват крови телят, Эплан) без эффекта. Локальный статус: язва размером 2,5×1,0 см. Края фестончатые, характерны для ишемического компонента. Отделяемого нет. Вялая грануляция по периферии. Резкая болезненность при пальпации.
Сопутствующая патология: ГБ, ИБС, ХСН, атеросклероз артерий нижних конечностей (ХИНК 2Б), СД 2 типа, диабетическая полинейропатия, полиостеоартрит.
Лечение: выполнена однократная инъекция раствора ангиогенина (периульцерально). От последующих инъекций пациентка отказалась из-за выраженной болезненности (индивидуальная особенность пациентки на фоне полинейропатии). Назначен гель ангиогенина ежедневно. Дополнительно — аппаратная нейромускулярная стимуляция артериального кровотока. Результаты: полное заживление язвы достигнуто через 4 нед. от начала терапии (рис. 3).
Клиническое наблюдение 4
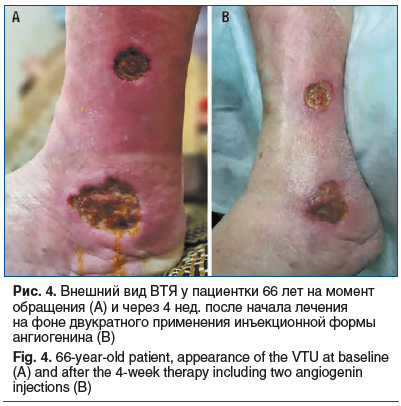
Пациентка, 66 лет (1958 г. р.). Жалобы на две глубокие язвы на левой голени, интенсивный болевой синдром, лимфорею.
Анамнез: язвы возникли летом 2023 г. после микротравмы. Лечилась самостоятельно с отрицательной динамикой. Обратилась за медицинской помощью в декабре 2023 г. в связи с увеличением в размере язвы и болевым синдромом.
Локальный статус: две язвы: на тыле стопы (3,5×3,2 см, глубина 0,35 см) и на голени (1,5×1,6 см, глубина 0,25 см). Дно покрыто фибрином, участки некроза. Края инфильтрированы, отек. Сопутствующая патология: СД 1 типа (инсулинозависимый, субкомпенсация), диабетическая ангио- и нейропатия, ГБ, ИБС. Лечение: 1-й этап: антибактериальная терапия, местно — стерильные антибактериальные повязки для лечения ран, предактивированные раствором Рингера; 2-й этап: двукратное введение раствора ангиогенина (периульцерально) и ежедневное применение геля ангиогенина. Результаты: отмечена значимая положительная динамика: уменьшение воспаления, появление грануляций, уменьшение размеров язв на 35–40% (рис. 4). Конечный результат не документирован в связи с прекращением наблюдения по инициативе пациентки.
Обсуждение
Представленная серия клинических наблюдений демонстрирует, что применение ангиогенина в комплексной терапии ВТЯ привело к положительной динамике у всех пациенток, включая больных пожилого возраста с отягощенным соматическим статусом (пациентки 2, 3, 4), что согласуется с данными о ключевой роли стимуляции ангиогенеза в преодолении резистентности хронических ран к заживлению [2, 3, 5].
Полученные нами результаты, а именно быстрое появление грануляций и начало эпителизации, могут свидетельствовать о преодолении под действием ангиогенина ключевых патогенетических барьеров, описанных в современных теориях формирования ВТЯ, таких как нарушение микроциркуляторного русла, блокада диффузии кислорода «фибриновыми манжетами» и дисбаланс протеаз [1, 2]. Уникальный механизм действия ангиогенина, независимый от классического VEGF-пути и включающий активацию внутриклеточных сигнальных каскадов (MAPK, PI3K/Akt) и модуляцию синтеза рРНК [3], позволяет предположить, что он может эффективно запускать процесс неоваскуляризации даже в неблагоприятной микросреде хронической раны.
Выбор инъекционной методики введения и объемов введения, несмотря на отсутствие прямых аналогов в литературе по лечению ВТЯ, был основан на общих принципах локальной терапии факторами роста, направленных на создание высокой концентрации биологически активного вещества в зоне репарации. Важно отметить, что фундаментальные исследования демонстрируют хороший профиль безопасности ангиогенина при локальном применении даже в высоких дозах, что снижало потенциальные риски данного подхода. В наблюдении 1 комбинированное введение ангиогенина с ОТП было направлено на создание синергичного эффекта, где экзогенный ангиогенин потенцировал действие широкого спектра эндогенных факторов роста (PDGF, VEGF, TGF-β), высвобождаемых из активированных тромбоцитов [5, 7]. Данный подход показал наилучший результат, выразившийся в полном заживлении наиболее крупного язвенного дефекта.
Наблюдение 3, где был использован только топический гель ангиогенина после однократной инъекции, также показало впечатляющую эффективность с полным заживлением через 4 нед. Этот результат свидетельствует о том, что даже без инвазивного вмешательства местное применение ангиогенина может быть высокоэффективным, что особенно актуально для пациентов с низкой толерантностью к болевым процедурам. Это открывает перспективы для дальнейшего изучения неинвазивных форм доставки.
Важно отметить, что терапия ангиогенином во всех случаях применялась на фоне неизменной базовой терапии (компрессия, раневой менеджмент, коррекция сопутствующей патологии), что подчеркивает его роль именно как мощного адъювантного средства, а не монотерапии, и согласуется с общими принципами биологической терапии ран [5].
Ограничением нашего исследования является небольшое количество наблюдений и отсутствие контрольной группы, что не позволяет сделать окончательных выводов об эффективности и превосходстве метода над стандартной терапией. Однако представленные данные обнадеживают и являются основанием для планирования масштабных рандомизированных контролируемых исследований.
Заключение
Проведенное исследование демонстрирует клиническую эффективность применения рекомбинантного человеческого ангиогенина в комплексной терапии трофических язв венозной и смешанной этиологии. Полученные результаты показывают, что локальное применение раствора ангиогенина инъекционным способом и геля для местного нанесения способствует активации репаративных процессов даже у пациентов с длительно незаживающими язвами, резистентными к стандартной терапии.
Наиболее значимые результаты исследования:
у всех пациенток наблюдалась положительная динамика в виде появления активных грануляций и начала эпителизации в сроки от 2 до 3 нед.;
полное заживление язвенных дефектов достигнуто у 3 из 4 пациенток в сроки от 4 нед. до 4 мес.;
комбинированная терапия с использованием ангиогенина и ОТП показала наилучшие результаты при лечении крупных язвенных дефектов;
даже монотерапия гелевой формой ангиогенина продемонстрировала высокую эффективность у пациенток с непереносимостью инъекционных методик.
Особого внимания заслуживает хороший профиль безопасности применяемой терапии — ни в одном случае не было зарегистрировано системных побочных эффектов или местных осложнений, связанных с применением ангиогенина.
Перспективы дальнейших исследований включают:
проведение рандомизированных контролируемых исследований с большей выборкой пациентов;
оптимизацию протоколов дозирования и способов введения препарата;
изучение эффективности ангиогенина при различных типах хронических ран;
исследование синергического действия ангиогенина с другими факторами роста.
Полученные данные свидетельствуют о перспективности применения ангиогенина в качестве эффективного адъювантного средства в комплексном лечении трофических нарушений при хронической венозной и артериальной недостаточности.
Сведения об авторе:
Сухоруков Евгений Анатольевич — врач-хирург (флеболог), врач ультразвуковой диагностики ООО «Здоровое поколение»; 142100, Россия, г. Подольск, ул. Февральская, д. 54/150; ORCID iD 0000-0002-6337-0629
Контактная информация: Сухоруков Евгений Анатольевич, e-mail: 8896626@gmail.com
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 15.07.2025.
Поступила после рецензирования 07.08.2025.
Принята в печать 28.08.2025.
About the author:
Evgenyi A. Sukhorukov — Surgeon (Phlebologist), Ultrasound Doctor, Healthy generation LLC; 54/150, Fevralskaya str., Podolsk, 142100, Russian Federation; ORCID iD 0000-0002-6337-0629
Contact information: Evgenyi A. Sukhorukov, e-mail: 8896626@gmail.com
Financial Disclosure: the author has no a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 15.07.2025.
Revised 07.08.2025.
Accepted 28.08.2025.
Информация с rmj.ru