Введение
Одним из основных социально значимых возраст-ассоциированных заболеваний является фибрилляция предсердий (ФП), распространенность которой неуклонно растет в связи с увеличением числа лиц пожилого и старческого возраста [1–3]. По результатам отечественного эпидемиологического исследования ЭПОХА [1], включавшего 11 453 пациента из 8 субъектов России, было показано, что частота встречаемости ФП составляет 2040 пациентов на 100 000 населения, при этом самые низкие показатели отмечены у лиц в возрасте 20–40 лет (0,1%), а среди пациентов старческого возраста (80–89 лет) они достигают 9,6%. Сравнимые данные были собраны и в европейских эпидемиологических исследованиях: так, в Испании аналогично отмечается увеличение распространенности ФП от 4% (≥40 лет) до 8,5 и 16,5% у пациентов пожилого (>60 лет) и старческого (>85 лет) возраста соответственно [2]. При этом ожидается, что количество пациентов с ФП возрастет на 150% в течение последующих четырех десятилетий [3].
Одним из основных факторов риска развития ФП является ишемическая болезнь сердца (ИБС), распространенность которой у пациентов с ФП составляет от 17 до 46,5% [4], при этом у пациентов с ИБС ФП диагностируется в 1–5% случаев [4]. По данным исследования причин географических и расовых различий, связанных с инфарктом (REAsons for Geographic And Racial Differences in Stroke, REGARDS) [5, 6], в которое было включено 23 928 пациентов (период наблюдения 6,9 года), наличие сопутствующей ФП было независимым предиктором возрастания риска возникновения у пациента инфаркта миокарда (ИМ) в 2 раза (отношение рисков (ОтнР) 1,96, 95% доверительный интервал (ДИ) 1,52–2,52), а по данным J. Sundbøll et al. [7] (n=103 989), у больных с впервые диагностированной ФП суммарный риск ИМ за десятилетний период находится на уровне 3,5%. Кроме того, почти 15% пациентов с ФП проводится чрескожное коронарное вмешательство (ЧКВ) [8]. Частота встречаемости ИБС у пациентов с ФП увеличивается с возрастом: так, в исследовании J.P. Piccini et al. [9] (n=186 461) 5-летняя заболеваемость ИМ при ФП составила 3,3% у пациентов в возрасте 67–69 лет и 4,4% у пациентов в возрасте 85–89 лет. Сочетание ИБС и ФП у пациентов сопровождается увеличением риска развития не только ИМ, но и тромбоэмболических событий, что отражает шкала CHA2DS2-VASc (Congestive heart failure, Hypertension, Age≥75, Diabetes, Stroke/TIA/thromboembolism, Vascular disease, Age 65–74, Sex category (female) — Застойная сердечная недостаточность, Артериальная гипертензия, Возраст ≥75, Сахарный диабет, Инсульт/ТИА/тромбоэмболия, Сосудистые заболевания, Возраст 65–74, Пол (женский))[1].
Одним из основных клинически значимых тромбоэмболических осложнений у пациентов с ФП является инсульт, риск развития которого увеличивается в 4–5 раз во всех возрастных группах [10]. По результатам исследований ФП независимо ассоциирована с возникновением и других неврологических осложнений, включая додементные когнитивные нарушения (КН) и деменцию, даже без предшествующего ишемического инсульта в анамнезе [11]. Это обусловлено, в частности, наличием общих факторов риска, таких как пожилой возраст, сахарный диабет (СД), наличием сердечно-сосудистой патологии (артериальной гипертензии (АГ), хронической сердечной недостаточности (ХСН), ИБС) и др. [12–14]. С другой стороны, ИБС также является одним из факторов риска развития КН и деменции [15, 16]. Так, по данным метаанализа [15] (46 исследований, n=1 248 908), у пациентов с ИБС риск возникновения КН и деменции увеличивается на 50% по отношению к лицам, не имеющим данного заболевания. По результатам Роттердамского исследования [16], включавшего 4971 пациента, было продемонстрировано за период наблюдения в среднем 2,5 года, что у пациентов, перенесших ИМ, наблюдалось статистически значимое снижение когнитивных функций, вне зависимости от возраста и уровня образования.
Вместе с тем даже с учетом подтвержденной неблагоприятной предиктивной значимости и ФП, и ИБС в отношении дебюта КН и деменции, работы, где изучался бы когнитивный статус у коморбидных пациентов с ФП и ИБС и одновременно получающих двойную антитромботическую терапию (ДАТ), в настоящее время отсутствуют.
Кроме того, следует обратить внимание, что применение ДАТ в подобной группе больных коррелирует с повышенным риском «больших» кровотечений, требующих медицинского вмешательства и являющихся одним из ключевых факторов, способствующих развитию анемии [6, 17–19].
Анемия, наблюдаемая у пациентов с ФП, распространенность которой составляет от 11,9 до 16%, является потенциально корректируемым фактором риска увеличения смертности от всех причин, клинически значимых сердечно-сосудистых осложнений и геморрагических событий [6, 17–19]. По данным исследований было продемонстрировано влияние анемии и на cостояние когнитивных функций, однако патофизиологические механизмы пока остаются предметом дискуссий [20–22]. Так, по данным проспективного когортного исследования [20] (n=313 448, период наблюдения 9,03 года), анемия была ассоциирована с повышением риска развития деменции на 56%. А по данным H. Weilei et al. [21] (n=326 с перенесенным ишемическим инсультом), анемия была независимо ассоциирована с развитием постинсультных КН (отношение шансов (OШ) 3,637, 95% ДИ 1,216–10,881, р=0,021) после поправки на демографические параметры, сосудистые факторы риска, степень тяжести инсульта и функциональные исходы. Также стоит подчеркнуть, что результаты проспективного популяционного когортного исследования [22] (n=1212, средний возраст 93,3 года, период наблюдения 6 лет) продемонстрировали возрастание риска смертности у пациентов с анемией и диагностированными КН (ОШ 2,60, 95% ДИ 2,06–3,27), что еще раз подчеркивает значимость своевременной диагностики и лечения анемии в данной когорте пациентов.
Проблема деменции и неуклонного прогрессирования КН имеет значимые социально-экономические последствия, поскольку приводит к снижению качества жизни у пожилых пациентов и росту инвалидизации [23]. Эти заболевания также способствуют увеличению случаев госпитализаций и смертности из-за недостаточной приверженности пациента лечению, проявляющегося как в пропуске приема лекарственных препаратов, так и в их передозировке и вследствие этого в ухудшении контроля коморбидных хронических заболеваний у пожилых пациентов [24, 25].
В свете вышеизложенного целью данного исследования стал анализ влияния анемии на состояние когнитивных функций пациентов с сочетанием ИБС и ФП, находящихся на ДАТ.
Содержание статьи
Материал и методы
Этические аспекты. Настоящее проспективное открытое когортное исследование получило одобрение этического комитета ФГБОУ ДПО РМАНПО Минздрава России (протокол заседания № 12 от 10 октября 2023 г.).
Критерии включения [6]: пациенты обоих полов ≥18 лет; ФП неклапанной этиологии, риск по шкале CHA2DS2-VASc ≥1 балла для мужчин и ≥2 баллов для женщин1; подтвержденный прием прямого орального антикоагулянта (ПОАК) (ривароксабан, апиксабан или дабигатрана этексилат) и любого антиагреганта (ацетилсалициловая кислота или клопидогрел, или тикагрелор, или прасугрел). Критерии невключения: беременность, лактация, обратимые причины ФП, выраженная печеночная и почечная недостаточность, клинически значимое кровотечение на момент включения в исследование, наличие сопутствующей патологии (системные, онкологические и психические заболевания, а также гематологические заболевания, оказывающие влияние на гемостаз), низкая комплаентность, прием тройной антитромботической терапии или варфарина. Критерии исключения [6]: отказ от дальнейшего участия в исследовании, беременность, отмена антиагреганта или антикоагулянта, в том числе замена на варфарин, развитие острого коронарного синдрома (ОКС) в период наблюдения, низкая приверженность лечению, отмеченная во время проведения исследования.
В исследование были включены 126 пациентов с ФП (медиана возраста 69,5 [63; 76] года, 62,7% мужчин), получающих ДАТ, которые впоследствии были разделены на 2 группы в зависимости от наличия анемии: в группу 1 были распределены пациенты с анемией (n=27), в группу 2 — пациенты без данной сопутствующей патологии (n=99).
Клинические данные изучаемой когорты пациентов представлены в таблицах 1 и 2. Пациенты группы 1 были статистически значимо старше (75,0 [68,0; 80,0] года) по сравнению с лицами, включенными в группу 2 (68,0 [62,0; 76,0] года, р=0,008) (см. табл. 1). К тому же пациенты группы 1 имели более высокие уровни систолического артериального давления (САД) в сопоставлении с лицами в группе 2 (р=0,022) (см. табл. 1). Медиана итогового балла по шкале оценки риска кровотечений при мерцательной аритмии (Hypertension, Abnormal renal-liver function, Stroke, Bleeding history or predisposition, Labile international normalized ratio, Elderly, Drugs or alcohol concomitantly, HAS-BLED) и, соответственно, риск развития кровотечений также были выше в группе 1 по сравнению с группой 2 (р<0,001) (см. табл. 1). В процессе исследования структуры сопутствующих заболеваний было установлено, что у пациентов группы 1 статистически значимо чаще встречались стенокардия напряжения 3 ФК (29,6% против 11,1%) и ХБП 4-й стадии (11,1% против 1%) по сравнению с больными группы 2 (р=0,030 и р=0,031 соответственно) (см. табл. 2). Неполное высшее и высшее образование имели 33,3% (n=9) пациентов группы 1 и 27,3% (n=27) — группы 2, различия между группами статистически незначимы.
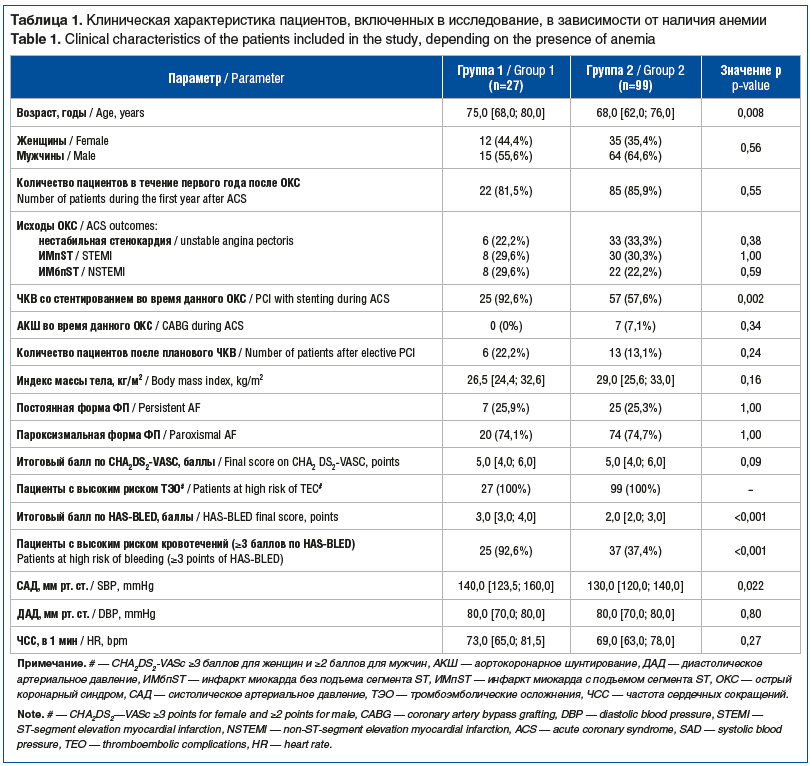
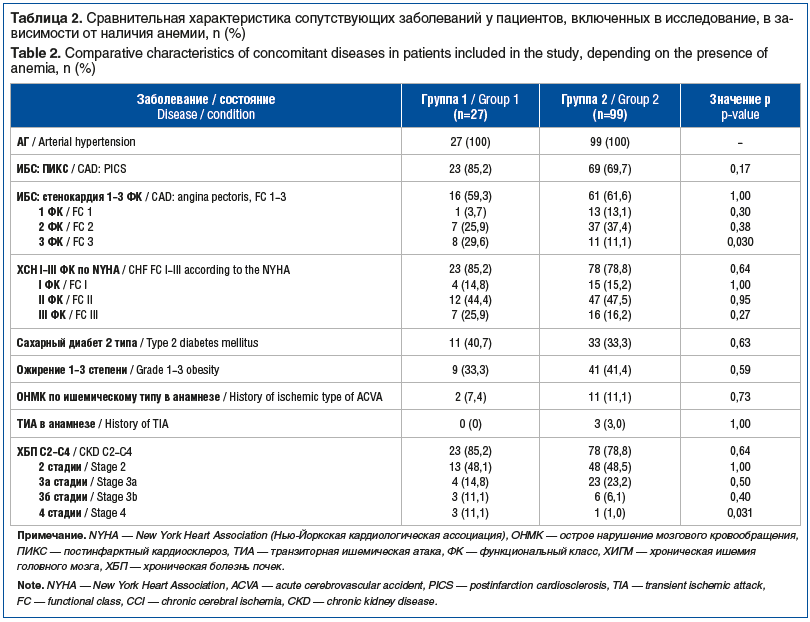
При сравнительном анализе лабораторных параметров уровень гемоглобина (116,0 [105,0; 122,0] г/л против 141,0 [134,0; 149,0] г/л), а также концентрация триглицеридов (1,1 [0,9; 1,6] ммоль/л против 1,5 [1,1; 2,0] ммоль/л) были статистически значимо ниже в группе 1, чем в группе 2 (р<0,001 и р=0,033 соответственно). У пациентов группы 1 показатели липопротеинов высокой плотности, напротив, были на статистически значимо более высоком уровне, чем в группе 2 (1,5 [1,2; 1,6] ммоль/л против 1,2 [1,0; 1,4] ммоль/л, р=0,001).
Единственным статистически значимым различием в медикаментозной терапии стал прием моксонидина: 4 (14,8%) пациента в группе 1 и 3 (3%) — в группе 2 (р=0,038).
У каждого пациента настоящего исследования была осуществлена оценка когнитивных функций с применением нейропсихологических тестов: Монреальской шкалы оценки когнитивных функций (The Montreal Cognitive Assessment, МоСА) [26], Краткой шкалы оценки психического статуса (КШОПС; Mini-Mental State Examination, ММSE) [27], теста построения маршрута (тест последовательных соединений) — часть А, часть В (в секундах) (Trail Making Test, TMT) [28], методики «вербальных ассоциаций» (литеральные (буквы) и категориальные (животные) ассоциации) (Word fluency test) [29], теста запоминания 10 слов (Word-List Recall) [30], теста словесно-цветовой интерференции (тест Струпа; Stroop color-word conflict) [31]. Также всем пациентам проведена оценка депрессии с помощью шкалы Гамильтона (Hamilton Rating Scale for Depression, HDRS) [32] и оценка тревоги с помощью шкалы тревоги Бека (The Beck Anxiety Inventory, BAI) [33].
Статистическая обработка данных выполнена в программном пакете IBM SPSS Statistics 27 (IBM, США) [6]. Нормальность распределения полученных переменных оценивали с помощью критерия Шапиро — Уилка. Для описания параметров с ненормальным распределением количественных переменных рассчитывали медиану (Ме) и 1-й и 3-й квартили (Ме [Q1; Q3]). При анализе различий количественных показателей использовали критерий Манна — Уитни. Категориальные переменные оценивали с помощью точного критерия Фишера, а непараметрические показатели — с помощью критерия χ2. Статистически значимыми считали значения при р<0,05 [6].
Результаты исследования
По результатам анализа MoCА-теста было показано, что итоговые баллы у пациентов группы 1 были статистически значимо ниже в сравнении с группой 2 (25 [23; 26] баллов против 26 [24; 27] баллов, р=0,048) (табл. 3). Соответственно, число лиц с количеством баллов >26 было статистически значимо больше в группе 2 — 37,4% (37 человек), чем в группе 1 — 4 (14,8%) человека (р=0,047) (см. табл. 3). Данные тестирования по КШОПС, представленные в таблице 3, продемонстрировали аналогичные результаты: 15 (15,2%) человек имели итоговые баллы в диапазоне нормальных значений (29–30 баллов), в то время как в группе 1 такие пациенты отсутствовали (p=0,039 между группами).
Анализ результатов теста построения маршрута показал, что время выполнения части В у пациентов группы 1 было статистически значимо выше, чем в группе 2 (p=0,024) (см. табл. 3). Данные теста вербальных ассоциаций показали, что пациенты группы 2 называли статистически значимо больше слов как в субтесте литеральных, так и в субтесте категориальных ассоциаций по сравнению с пациентами группы 1 (р=0,022 и p=0,026 соответственно) (см. табл. 3). При оценке результатов теста запоминания 10 слов было продемонстрировано, что количество слов при непосредственном воспроизведении было статистически значимо ниже в группе 1, чем у пациентов в группе 2 (p=0,009), при этом различия в количестве слов при отсроченном воспроизведении оказались статистически незначимы (см. табл. 3).
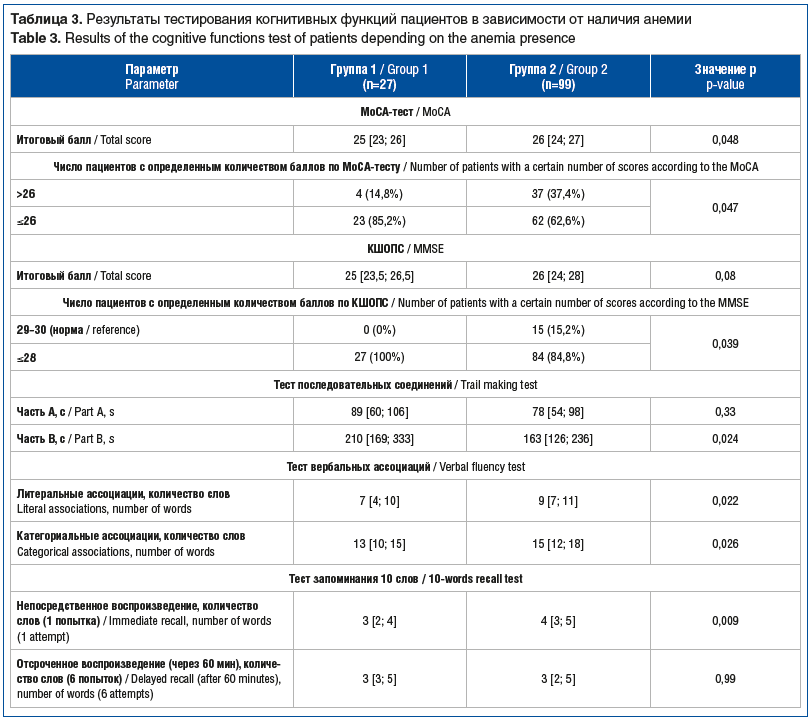
Анализ когнитивных функций с помощью теста словесно-цветовой интерференции не выявил статистически значимых различий между группами. Также не обнаружено статистических различий между группами по шкалам депрессии Гамильтона и тревоги Бека.
Обсуждение
В нашем исследовании обнаружено, что у пациентов, имеющих одновременно ФП и ИБС, при наличии сопутствующей анемии наблюдаются статистически значимо более выраженные КН в сравнении с больными без данной гематологической патологи. В частности, в настоящем исследовании у пациентов с сопутствующей анемией медиана итогового балла по МоСА-тесту была статистически значимо ниже, чем у пациентов в группе без анемии, также среди них статистически значимо реже встречались пациенты с итоговым баллом по МоСА >26. По результатам КШОПС все пациенты с анемией имели КН той или иной степени выраженности (итоговый балл по КШОПС ≤28 баллов) в отличие от пациентов без сопутствующей анемии. КШОПС была разработана для выявления болезни Альцгеймера и осуществляет оценку 5 когнитивных функций: ориентация (в пространстве, времени, собственной личности), память, внимание, восприятие и речь [27], в то время как МоСА представляет собой тест, обладающий более высокой чувствительностью и предназначенный для диагностики умеренных КН и деменции, в первую очередь сосудистого генеза, и позволяет анализировать 8 различных когнитивных функций: память, внимание, речь, исполнительские и зрительно-конструктивные навыки, абстрактное мышление, счет и ориентацию [26, 34–36].
Помимо этого, у пациентов с ИБС и ФП с сопутствующей анемией было зафиксировано статистически значимо меньшее количество слов, произнесенных в субтестах как на литеральные, так и на категориальные ассоциации (тест вербальных ассоциаций), что говорит о нарушениях речевой активности и семантической памяти, что чаще всего наблюдается при болезни Альцгеймера[2] (нейродегенеративные КН) [29]. Кроме того, пациенты с сопутствующей анемией выполняли часть В теста последовательных соединений статистически значимо медленнее по сравнению с пациентами без анемии, что указывает на нарушение исполнительных (управляющих) функций у пациентов с ИБС, ФП и анемией [28].
Когнитивные нарушения существенно влияют на продолжительность и качество жизни пациентов, повышая вероятность падений и, соответственно, переломов и в дополнение способствуя развитию старческой астении и стойкому нарушению трудоспособности, что оказывает существенное влияние на ресурсы здравоохранения [37, 38]. Также стоит отметить, что снижение памяти, речи и социального интеллекта может приводить к социальной изоляции и дезадаптации, увеличению риска развития тревож-ных расстройств и депрессии у пожилых пациентов [39]. А снижение исполнительных функций и памяти ухудшает коммуникацию таких пациентов с медицинским персоналом, что приводит к частым случаям несоблюдения врачебных рекомендаций [40, 41].
Согласно результатам ряда публикаций была доказана взаимосвязь анемии с развитием КН и деменции. Так, по данным метаанализа [42] (20 исследований, n=6558), риск развития КН был значимо выше у пациентов с анемией (скорректированный относительный риск (сОР) 1,39, 95% ДИ 1,25–1,55, p<0,001). В анализе подгрупп анемия также достоверно коррелировала с повышением риска развития деменции любого генеза (сОР 1,39, 95% ДИ 1,23–1,56, p<0,001), деменции при болезни Альцгеймера в 1,59 раза (сОР 1,59, 95% ДИ 1,18–2,13, p=0,002) и додементных КН (сОР 1,36, 95% ДИ 1,04–1,78, p=0,02) [42]. Сходные данные были получены в исследовании F.J. Wolters et al. [43], включавшем 12 305 пациентов (средний возраст 64,6 года, период наблюдения 12,1 года), исходя из которых можно утверждать, что анемия ассоциирована с увеличением риска развития деменции на 34% и деменции при болезни Альцгеймера на 41% независимо от других факторов. W. Jia et al. [44] в многоцентровом проспективном исследовании (n=2240, средний возраст 60,96±10,76 года, период наблюдения 3 мес.) оценивали влияние анемии на состояние когнитивных функций у пациентов с перенесенным ишемическим инсультом / транзиторной ишемической атакой (ТИА). Оценку когнитивных функций осуществляли с помощью MoCA-теста. Согласно полученным данным у пациентов с анемией баллы по MoCA-тесту были статистически значимо ниже, чем у лиц без анемии (22,53±5,56 балла против 23,68±4,77 балла, р=0,001) [44]. J. Wang et al. [45] (n=207 203, возраст ≥60 лет, период наблюдения 16 лет) также обнаружили взаимосвязь анемии с более быстрым снижением когнитивных функций (β=-0,08, 95% ДИ -0,14 — -0,01) и, в частности, скорости обработки информации (β=- 0,10, 95% ДИ -0,19 — -0,01). Помимо этого, анемия была предиктором не только увеличения риска развития деменции (ОтнР 1,57, 95% ДИ 1,38–1,78), но и более раннего ее дебюта (на 1,53 года, 95% ДИ 1,08–1,97) по сравнению с пациентами без анемии [45]. Отдельно необходимо подчеркнуть, что риск развития деменции был статистически значимо выше у пациентов с анемией в сочетании с высоким уровнем С-реактивного белка (СРБ) (ОтнР 1,89, 95% ДИ 1,60–2,22), что подтверждает значимый вклад воспаления в развитие и прогрессирование КН у пациентов с анемией [45]. Хроническое системное низкоинтенсивное воспаление является общим механизмом развития деменции у пациентов как с ФП и ИБС, так и с анемией [45–47]. По данным ряда исследований, увеличение уровня СРБ независимо ассоциировано с повышенным риском развития деменции [48, 49].
Центральным патофизиологическим механизмом развития КН у пациентов с анемией, по мнению исследователей, является снижение оксигенации периферических тканей из-за низкой концентрации гемоглобина [50–52]. Гипоперфузия головного мозга на фоне анемии может сопровождаться развитием гипоксии; при этом по мере увеличения ее длительности изменяются возбудимость и функциональная экспрессия кальциевых каналов, приводя к их дисфункции, что в свою очередь может способствовать нейродегенерации [50]. К тому же более низкая концентрация кислорода усиливает процесс образования β-амилоидного белка через амилоидогенную трансформацию белка-предшественника амилоида [51]. Увеличение количества β-амилоида активирует нативные кальциевые каналы L-типа и нарушает гомеостаз кальция. Гиперактивация экспрессии кальция в центральных нейронах на фоне гипоксии может привести к нейротоксичности β-амилоида и последующему развитию КН [52].
Как было упомянуто ранее, анемия ассоциирована с увеличением риска кровотечений. Так, в настоящем исследовании количество пациентов с высоким риском кровотечений в группе с анемией было больше почти в 2,5 раза (92,6% против 37,4%, р<0,001) в сопоставлении с лицами, не имеющими указанного заболевания. На основании этого еще одним предполагаемым механизмом развития КН у пациентов с анемией является возникновение церебральных микрокровоизлияний. Это было подтверждено, в частности, в исследовании F.J. Wolters et al. [43], упомянутом ранее; у пациентов с анемией риск развития по крайней мере одного микрокровоизлияния был выше на 45% (ОШ 1,29, 95% ДИ 0,90–1,86). Данный механизм также лежит в основе снижения когнитивных функций у пациентов с ФП [53, 54].
По результатам настоящего исследования у пациентов с ИБС, ФП и анемией отмечаются более высокие уровни САД (140,0 [123,5; 160,0] мм рт. ст. против 130,0 [120,0; 140,0] мм рт. ст., р=0,022) по сравнению с группой без анемии. В свою очередь отсутствие контроля АГ также может вносить вклад в развитие и прогрессирование КН у пациентов изучаемой нами когорты. АГ, поражающая головной мозг в качестве одного из органов-мишеней, является одним из основных факторов риска снижения когнитивных функций [55–57]. Наиболее выраженно АГ снижает такие когнитивные функции, как память, скорость обработки информации, исполнительные функции и абстрактное мышление [55]. Значимый вклад в прогрессирование КН вносит отсутствие контроля уровня АД у пациентов с АГ. Так, по данным метаанализа 136 исследований [56] (n=2 214 814, средний возраст 35,3–93,2 года, период наблюдения 1,5–43 лет) уровень САД ≥140 мм рт. ст., а также ДАД ≥80 мм рт. ст. достоверно коррелировал с увеличением риска развития деменции на 37–52%, а повышение САД >130 мм рт. ст. у пациентов 40–60 лет ассоциировалось с повышением риска КН и деменции на 34% (р<0,001). Эти факты нашли подтверждение и в поперечном эпидемиологическом исследовании A.L.A. Luz et al. [57] (n=383), в котором оценивали когнитивные функции у пожилых пациентов (≥60 лет) с использованием MoCA-теста. В когорте пациентов с контролируемой АГ итоговый балл по MoCA-тесту был статистически значимо выше, чем у лиц с отсутствием контроля АД (25 [19; 25] против 20 [17; 23], р<0,001) [57].
Заключение
Результаты настоящего исследования демонстрируют, что у пациентов с сочетанием ИБС и ФП наличие сопутствующей анемии ассоциировано с более выраженным снижением когнитивных функций. Раннее выявление данного заболевания у пациентов, получающих ДАТ, может способствовать снижению риска развития/прогрессирования КН и деменции, и, соответственно, увеличению продолжительности и улучшению качества жизни таких больных. В настоящее время необходимо проведение дальнейших исследований, направленных на изучение патофизиологических механизмов развития КН у пациентов с ИБС, ФП и анемией, получающих ДАТ, а также оценку эффективности и безопасности проводимой терапии в вопросе снижения риска развития и прогрессирования КН и деменции.
Сведения об авторах:
Телкова Светлана Сергеевна — ассистент, старший лаборант, аспирант кафедры терапии и полиморбидной патологии им. академика М.С. Вовси ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0003-1439-7371
Кочетков Алексей Иванович — к.м.н., доцент, доцент кафедры терапии и полиморбидной патологии им. академика М.С. Вовси ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0001-5801-3742
Гаврилова Наталья Евгеньевна — д.м.н., профессор кафедры терапии и полиморбидной патологии им. академика М.С. Вовси ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; генеральный директор, главный врач ООО «СЦЗ»; 111024, Россия, г. Москва, ул. 2-я Кабельная, д. 2, стр. 25; ORCID iD 0000-0003-4624-9189
Филиппова Татьяна Владимировна — ассистент, старший лаборант кафедры терапии и полиморбидной патологии им. академика М.С. Вовси ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0009-0004-7241-0938
Остроумова Ольга Дмитриевна — профессор, д.м.н., заведующая кафедрой терапии и полиморбидной патологии им. академика М.С. Вовси ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; профессор кафедры клинической фармакологии и пропедевтики внутренних болезней ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-0795-8225
Контактная информация: Остроумова Ольга Дмитриевна, e-mail: ostroumova.olga@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 14.07.2025
Поступила после рецензирования 06.08.2025.
Принята в печать 28.08.2025.
About the authors:
Svetlana S. Telkova — Assistant Professor, Senior Laboratory Assistant, Associate Professor of the Department of Therapy and Polymorbid Pathology named after M.S. Vovsi, Russian Medical Academy of Continuous Professional Education; 2/1 build. 1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0003-1439-7371
Alexey I. Kochetkov — C. Sc. (Med.), Associate Professor of the Department of Therapy and Polymorbid Pathology named after M.S. Vovsi, Russian Medical Academy of Continuous Professional Education; 2/1 build. 1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0001-5801-3742
Natalia E. Gavrilova — Dr. Sc. (Med.), Professor of the Department of Therapy and Polymorbid Pathology named after M.S. Vovsi, Russian Medical Academy of Continuous Professional Education; 2/1 build. 1, Barrikadnaya str., Moscow, 125993, Russian Federation; General Director, Chief Medical Officer of SCZ LLC (Scandinavian Health Center); 2 build. 25, 2nd Kabelnaya str., Moscow, 111024, Russian Federation; ORCID iD 0000-0003-4624-9189
Tatiana V. Filippova — Assistant Professor, Senior Laboratory Assistant, Associate Professor of the Department of Therapy
and Polymorbid Pathology named after M.S. Vovsi, Russian Medical Academy of Continuous Professional Education; 2/1 build. 1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0009-0004-7241-0938
Olga D. Ostroumova — Dr. Sc. (Med.), Professor, Head of the Department of Therapy and Polymorbid Pathology named after M.S. Vovsi, Russian Medical Academy of Continuous Professional Education; 2/1 build. 1, Barrikadnaya str., Moscow, 125993, Russian Federation; Professor of the Department of Clinical Pharmacology and Propaedeutics of Internal Diseases, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 build 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0002-0795-8225
Contact information: Olga D. Ostroumova, e-mail: ostroumova.olga@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 14.07.2025
Revised 06.08.2025.
Accepted 28.08.2025.
[1] Клинические рекомендации. Фибрилляция и трепетание предсердий у взрослых. 2020. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/preview-cr/382_1 (дата обращения: 15.07.2025).
[2] Клинические рекомендации. Когнитивные расстройства у лиц пожилого и старческого возраста. 2025. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/preview-cr/617_5 (дата обращения: 15.07.2025).
Информация с rmj.ru




