Введение
В последние десятилетия отчетливо наметился глобальный тренд на увеличение числа различных нарушений зрения среди населения всего мира, включая детскую и подростковую популяции. Значительную долю в структуре причин нарушения зрения занимают аномалии рефракции, среди которых доминирует миопия. Согласно «Всемирному докладу о проблемах зрения 2019 года» Всемирной организации здравоохранения (ВОЗ)1 по меньшей мере 2,2 млрд человек во всем мире живут с той или иной формой нарушения зрения или слепотой. Из них как минимум 1 млрд человек страдает нарушениями зрения, которые можно было бы предотвратить или устранить. По глобальной оценке числа людей с миопией, опубликованной в этом докладе, к 2020 г. во всем мире насчитывалось 2,6 млрд человек (интервал неопределенности 1,97–3,43) всех возрастов, из них 312 млн человек (95% доверительный интервал (ДИ) 265–369 млн человек) в возрасте до 19 лет1.
По данным О.В. Проскуриной и соавт. [1], среди школьников Южного административного округа Москвы, а также Санкт-Петербурга, Ижевска и Иваново доля детей с миопией среди первоклассников составила 2,4%, среди учеников пятых классов — 19,7%, а среди одиннадцатиклассников — уже 38,6%. При этом среди учащихся первых классов общеобразовательных школ доля миопии составила 1,4% в сравнении с 7,5% среди первоклассников гимназий и лицеев. Среди выпускников этих же учебных заведений распространенность миопии составила 30,9 и 50,7% соответственно. Авторы связывают эти процессы с усложнением школьных программ и ранним дошкольным обучением чтению и письму, так как для поступления в первый класс таких образовательных учреждений существуют определенные требования к подготовке детей [1]. Показано, что данные изменения начинают формироваться в дошкольном и раннем школьном периодах, впоследствии усугубляясь [2–4].
Следует отметить, что, по имеющимся прогнозам, доля людей с миопией во всем мире будет только расти. Так, в соответствии с данными метаанализа, проведенного J. Liang et al. [5] на основании 276 исследований, наблюдается постепенное увеличение совокупной распространенности миопии с 24,32% (95% ДИ 15,23–33,40%) до 35,81% (95% ДИ 31,70–39,91%) с 1990 по 2023 г. Прогнозы указывают, что эта распространенность, как ожидается, достигнет 36,59% в 2040 г. и 39,80% в 2050 г. Люди, проживающие в странах Восточной Азии (35,22%), жители городов (28,55%), женщины (33,57%), подростки (47,00%) и учащиеся старших классов (45,71%) демонстрируют более высокую долю распространенности миопии. Россия наряду с Японией, Кореей, Сингапуром и Китаем входит в топ-5 стран с наибольшей распространенностью миопии (46%).
Несмотря на широкие возможности оптической коррекции и активное применение современных средств контроля миопии, близорукость остается масштабной медицинской проблемой. Высокая распространенность миопии среди населения, особенно в детском и подростковом возрасте, является тревожным фактором риска развития в будущем у ребенка серьезных осложнений, способствующих потере зрения. К ним относятся: осложненная катаракта, глаукома, отслойка сетчатки, а также изменения в макулярной области, известные как миопическая макулопатия. Практически все эти осложнения, в частности развитие мио-пической макулопатии, сопряжены с нарушением нормального функционирования сетчатки.
При близорукости наиболее информативным мето-дом исследования макулы является мультифокальная электроретинография (мфЭРГ). В отличие от стандартной флэш-ЭРГ, которая отражает вызванную светом электрическую активность почти всей сетчатки, мфЭРГ использует гексагональную диаграмму стимулов для получения топографической карты электрофизиологической активности ограниченной области сетчатки (~40–50°) [6]. Таким образом, мфЭРГ способна объективно оценить ее локальное состояние. Сигнал мфЭРГ регистрируется графически в виде отрицательных (N) и положительных (P) пиков. При миопии отмечается снижение амплитуды электрических сигналов (особенно пика P1), которое имеет выраженную корреляцию с длиной переднезадней оси глаза и степенью близорукости [7–10].
По данным R. Sachidanandam et al. [11], при увеличении осевой длины глаза на 1 мм регистрируется снижение амплитудной плотности пиков N1 и P1 в точке R1 (фовеа) при проведении мфЭРГ, даже в отсутствие клинических признаков миопической дегенерации сетчатки. Авторы объясняют это снижение реакции мфЭРГ с морфологическими изменениями в клетках сетчатки [12, 13].
Регистрация изменений электрической активности сетчатки может служить своеобразным предиктором прогрессирования миопии у детей. Отмечаются и морфологические изменения сетчатки, характеризующиеся уменьшением ее общей толщины, снижением плотности фоторецепторов, структурными изменениями во внешнем сегменте фоторецептора и снижением плотности ганглиозного комплекса [14]. При динамическом исследовании, проведенном у 26 детей с миопией в возрасте 9–13 лет (которым мфЭРГ проводилась с интервалом в 1 год), было зафиксировано снижение амплитуды электрической активности сетчатки в фовеальной области по мере прогрессирования близорукости. Установлено, что именно центральная область сетчатки является критической зоной, наиболее подверженной негативному влиянию прогрессирующей миопии у детей [15].
В основе развития миопии выявлены различные метаболические механизмы, значительная часть которых тесно связана с оксидативным стрессом [16]. Адекватная оксигенация сетчатки критически важна для ее нормального функционирования. Сетчатка характеризуется самым высоким потреблением кислорода в организме, что при избыточном воздействии света приводит к образованию большого количества активных форм кислорода (АФК) — основных факторов оксидативного стресса. АФК являются нестабильными молекулами и вызывают повреждение тканей.
Обилие полиненасыщенных жирных кислот в фоторецепторах сетчатки делает ее восприимчивой к перекисному окислению липидов. Воздействие атмосферного кислорода и ультрафиолетового излучения также приводит к развитию оксидативного стресса [17]. АФК могут быть успешно нейтрализованы при помощи механизмов антиоксидантной защиты. Антиоксиданты действуют как поглотители свободных радикалов, разрушители пероксидов, гасители синглетного кислорода, доноры водорода и электронов, металл-хелатирующие агенты и ингибиторы ферментов [18]. Хронический оксидативный стресс повышает риск развития осложнений миопии, особенно высокой степени [19].
Одним из негативных факторов, способствующих возникновению и усилению оксидативного стресса при мио-пии, является синий свет. Синий свет представляет собой часть спектра видимого света с длиной волны от 380 до 500 нм и присутствует как в естественном (солнечный свет), так и в искусственном (светодиодные лампы и экраны электронных устройств) освещении. Важно отметить, что, в отличие от естественного света, современные светодиоды в основном излучают именно синий свет. Поскольку современный человек проводит большую часть времени в закрытых помещениях, а дети и подростки — перед экранами цифровых устройств, воздействие синего света на ткани глаза в последние годы резко возросло.
И.Б. Ушаков и соавт. [4] в 2017–2020 гг. провели обследование и анкетирование 805 школьников и студентов из Москвы и Московской области. По их данным, практически 100% учащихся используют мобильные электронные устройства. При этом контроль за использованием электронных устройств снижал риск возникновения близорукости более чем в 2 раза [20].
В последние годы все больше эпидемиологических исследований оценивают время, проведенное перед экраном, с помощью опросников, заполняемых респондентами. Некоторые из этих исследований уже показали положительную корреляцию между увеличением времени, проведенным перед экраном, и близорукостью [21]. Эксперимент на мышах, подвергшихся воздействию синего света, излучаемого светодиодными лампами, показал значительные морфологические изменения: уже через 2 нед. было зафиксировано уменьшение толщины верхнего ядерного слоя, а через 39 нед. воздействия при значительном уменьшении толщины верхнего ядерного слоя очевидна потеря клеток фоторецепторов [22].
Дети более чувствительны, чем взрослые, к повреждающему действию синего и ультрафиолетового спектров, что обусловлено особенностями их глазной анатомии. У детей младше 10 лет более широкий зрачок и высокая прозрачность хрусталика позволяют пропускать до 70–75% лучей ультрафиолетового потока [23]. Для сравнения: у 30-летнего человека хрусталик и зрачок пропускают лишь около 10% этого потока. Таким образом, в отличие от взрослых, хрусталик маленьких детей не блокирует большую часть агрессивного света. Их основной естественной защитой служит макулярный пигмент сетчатки, который предохраняет фоторецепторы. Именно поэтому для детей особенно важно постоянное поступление лютеина и зеа-ксантина для поддержания достаточной плотности макулярного пигмента и эффективной защиты сетчатки [24, 25].
Лютеин и зеаксантин, являющиеся каротиноидами и составляющие основу макулярного пигмента, предохраняют глаза от оптического и оксидативного стресса, характерного для прогрессирующей миопии [26]. Включение антиоксидантов в рацион питания детей и подростков с миопией является обоснованным, поскольку большинство из них не синтезируются в организме человека и должны поступать экзогенно, с пищей [27]. Основными антиоксидантами для сетчатки являются именно каротиноиды. Лютеин и его структурный изомер зеаксантин составляют основу макулярного пигмента [28], при этом лютеин (36%), зеаксантин (18%) и мезозеаксантин (18%) формируют основную часть каротиноидов сетчатки, а их метаболиты — около 20% от общего содержания каротиноидов [29]. Важно подчеркнуть, что другие каротиноиды, такие как β-каротин и ликопин, не входят в состав макулярного пигмента. Наибольшая концентрация лютеина и зеаксантина отмечается в аксонах фоторецепторов слоя нервных волокон Генле, внешних сегментах палочек, наружном плексиформном слое фовеа и частично во внутреннем плексиформном слое [29, 30]. Макулярный пигмент является единственным защитным фактором фоторецепторов сетчатки, поэтому важно, чтобы ребенок получал лютеин и зеаксантин с пищей.
Вместе с тем лютеин, как и другие каротиноиды, обладает антиоксидантными и противовоспалительными свойствами. Таким образом, лютеин и зеаксантин, поглощая АФК и нейтрализуя вредные синие лучи, защищают фоторецепторы и пигментный эпителий сетчатки от окислительного повреждения. Но увеличение аксиального размера глазного яблока при осевой миопии приводит к снижению оптической плотности макулярного пигмента (ОПМП) в зоне желтого пятна, вследствие чего возможно развитие миопической макулопатии в зрелом возрасте [31].
В обзоре исследований [32] были представлены данные о связи между более высоким уровнем витамина D3 в крови и снижением частоты близорукости. Также была обнаружена обратная зависимость между концентрацией 25(OH)D в сыворотке крови и длиной глазного яблока — низкий уровень повышает риск развития близорукости. Еще в 2011 г. было отмечено, что средний уровень витамина D в крови у людей с миопией ниже, чем у лиц без нее [33]. В ходе национального исследования здоровья и питания (KNHANES) с участием 2038 подростков (13–18 лет) была обнаружена положительная корреляция между низкой концентрацией 25(OH)D в сыворотке крови и распространенностью миопии. Эта корреляция была более выраженной у подростков с высокой степенью миопии [34]. В исследовании, проведенном в Китае в 2019 г. с участием 186 детей, было показано, что распространенность умеренной и высокой миопии у детей с дефицитом сывороточного 25(OH)D была в 2,051 раза (95% ДИ 1,272–3,724) выше, чем у детей с достаточным количеством сывороточного 25(OH)D [35]. В Российской Федерации также выявляется недостаточная обеспеченность населения витамином D. В возрасте от 7 до 14 лет обеспечены витамином D (уровень 25(OH)D в плазме крови более 30 нг/мл) не более 10% детей, проживающих в Центральном и Северо-Западном регионах России [36].
Ряд исследователей отмечают, что низкий уровень цинка чаще встречается у людей с близорукостью [32]. Также отмечена связь между высоким потреблением витамина С и снижением частоты развития близорукости. В 7-м Национальном исследовании здоровья и питания Кореи (KNHANES VII, 2016) на основании анализа данных 18 077 подростков было показано, что употребление витамина С в высоких дозах связано со сниженным риском развития миопии [37]. Кроме того, в нескольких исследованиях упоминалось о позитивном действии на органы зрения антоцианов черники и черной смородины, омега-3 полиненасыщенных жирных кислот и лютеина. Было показано, что у людей, имеющих высокий уровень лютеина в сыворотке крови, на 40% снижался риск развития осложнений при близорукости [32].
Необходимость дополнительной дотации витаминных комплексов в подростковом и более раннем возрасте объясняется и тем, что около 70–80% детей на территории России имеют сочетанный дефицит трех и более витаминов, т. е. полигиповитаминозные состояния [38]. Популяционные исследования, проведенные Институтом питания РАН, свидетельствуют о недостаточном потреблении витаминов (А, С, Е, группы В) и микроэлементов (железа, цинка, йода, селена) значительной частью населения Российской Федерации. Школьники получают лишь 50% от необходимого количества витамина С, 31% — В1, 36% — В2, 36% — В6, 21% — Е, 17% — витамина А и 29% — β-каротина [39]. Витамины С и Е — мощные антиоксиданты, также необходимые для защиты клеток сетчатки; витамины группы В необходимы для нормального развития и функционирования нервных клеток сетчатки [40].
В 2024 г. нами был проведен опрос среди 200 детей и подростков с подтвержденным диагнозом «миопия» или «миопический астигматизм» или их родителей по специально разработанной анкете-опроснику. В результате было выяснено, что дети имеют несбалансированный рацион питания и недостаточно употребляют продукты, содержащие необходимые для нормального функционирования клеток сетчатки каротиноиды. Например, 88% детей вообще не употребляют в пищу тыкву, а 43,5% не употребляют зеленый горошек, кукурузу и стручковую фасоль, так как относят их к «нелюбимым» продуктам [30].
Получение каротиноидов из пищи — идеальный вариант для детей, поэтому врачи зачастую предлагают именно разнообразить рацион своим пациентам. Однако с учетом современных реалий для детей и подростков с миопией, учебными перегрузками или несбалансированным питанием, прием витаминно-минеральных комплексов (ВМК) с лютеином и зеаксантином и комплексом антиоксидантов важен и обоснован. Особенно это необходимо в периоды активного роста ребенка с повышенной потребностью в питательных веществах.
Содержание статьи
Собственный опыт
Ввиду отсутствия актуальных данных по обеспеченности подрастающего поколения витаминами и микроэлементами в период с 2020 по 2024 г. нами было проведено исследование, в рамках которого определяли содержание в крови витаминов С, D, Е, В1, В6, В12 и фолиевой кислоты у детей и подростков, проживающих в Центральном федеральном округе и посещающих дошкольные и школьные образовательные организации, по программе обследования детей и подростков Сеченовского Университета. Дети были проконсультированы педиатром, грубой соматической патологии не было выявлено.
Исследование витаминов В6 и В12 выполнялось микробиологическим тестом в комбинации с колориметрическим методом; определение содержания витамина С — колориметрическим тестом с тест-системой для определения водорастворимого витамина С; витаминов А, D и Е — методами иммуноферментного анализа. Сравнительный анализ гематологических показателей у детей из исследуемых образовательных организаций выполнен с помощью гематологического анализатора.
Участники (n=12 100) были распределены на две возрастные группы: дошкольный возраст (3–6 лет) — 2632 ребенка, из них 40% девочек, 60% мальчиков, школьный возраст (7–17 лет) — 9468 детей, из них 55% девочек, 45% мальчиков.
Дефицит витамина определяли при значении показателя ниже нижней границы нормы лаборатории, в которой проводилось исследование, субклинический дефицит — при значениях, на 10% превышающих нижнюю границу нормы. В результате исследования были получены данные по содержанию вышеуказанных витаминов в крови, а также по встречаемости дефицитного состояния и субклинического дефицита (рис. 1).
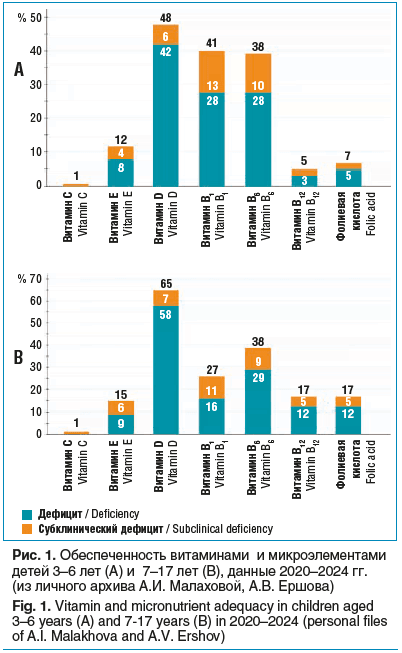
Согласно нашим данным (см. рис. 1, А) у детей в возрасте 3–6 лет чаще отмечается дефицит содержания витаминов, чем снижение их уровня до субклинического дефицита.
Наиболее глубокий дефицит у детей дошкольного возраста выявлен по витамину D — у 42%, дефицитное состояние по витаминам B1 и B6 отмечается у 41 и 38% детей соответственно, также имеет место дефицитное состояние по витамину В12, фолиевой кислоте, витамину Е. Исключением является витамин C — лишь у 1% детей 3–6 лет его уровень соответствовал субклиническому дефициту.
Как видно на рисунке 1, B, в возрастной группе 7–17 лет, как и у дошкольников, дефицит витаминов преобладал над их субклиническим снижением. Более того, у детей школьного возраста распространенность дефицита витаминов сохраняется или становится более выраженной по сравнению с группой 3–6 лет. Дефицит по витамину D встречается чаще у детей 7–17 лет, чем в группе 3–6 лет (58% против 42%), также немного чаще отмечается его субклинический дефицит — у 7%. Практически на том же уровне остается дефицит витамина В6. Дополнительно у детей 7–17 лет отмечается дефицит витамина B9 (фолаты) (17%) и B12 (17%), что может быть связано с более высокими темпами ростовых и обменных процессов и более высокой несбалансированностью их рационов питания. Это существенно превышает показатели в группе 3–6 лет, где частота дефицита витамина B9 составляла 3%, а B12 — 5%. Как и в младшей группе, среди детей 7–17 лет наименьшая распространенность снижения уровня прослеживалась по витамину C (лишь у 1% детей), при этом его дефицит не наблюдался.
При анализе встречаемости дефицитных состояний у детей в течение 1 года по месяцам было отмечено, что наиболее часто недостаток витаминов встречается в периоды с октября по апрель. Поэтому важно в этот период дополнительно поддерживать рацион питания детей и подростков с помощью специальной диеты или ВМК.
Также была обследована группа из 10 девочек с мио-пией, средний возраст 14,2 года. Им было проведено стандартное офтальмологическое обследование: визометрия, определение МКОЗ, авторефрактометрия, тонометрия, измерение переднезаднего размера (ПЗР) глазного яблока на биометре, оптическая когерентная томография (ОКТ) и фото глазного дна на приборе DRI OCT Triton с технологией Swept Source, Topcon-исследование линейных и 3D-сканов в горизонтальных и вертикальных срезах, а также ОКТ-ангиография с размерами сканов 6×6 мм, осмотр периферии глазного дна с линзой Гольдмана в условиях медицинского мидриаза по стандартной методике.
Всем пациенткам из группы проводили объективное исследование функционального состояния сетчатки c помощью системы для электрофизиологических исследований органа зрения Diopsys Nova (Diopsys, Inc., США) по протоколу мфЭРГ с 61 гексагональным паттерном, позволяющему оценить локальную функцию фоторецепторов и биполярных клеток центральной области сетчатки. По показаниям выполняли исследование по протоколу Diopsys PERG24, позволяющему оценивать функцию ганглиозных клеток сетчатки.
При сборе анамнеза у пациенток было выявлено недостаточное потребление с пищей каротиноидов, антиоксидантов, в связи с чем они получали специализированный ВМК — БАД к пище Окувайт® детский (кратность приема детьми старше 11 лет — 2 таблетки 1 раз в день).
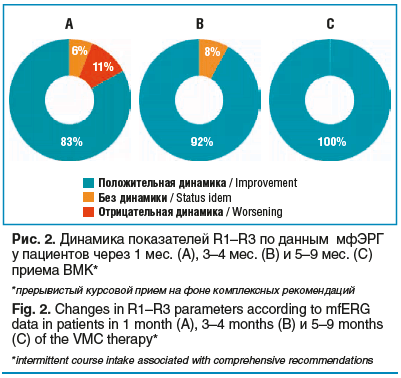
Уже после 1-го месяца приема ВМК в сочетании с комплексными рекомендациями у пациентов с миопией отмечалось улучшение результатов мфЭРГ. Динамика показателей R1–R3 на мфЭРГ у пациентов представлена на рисунке 2.
Было отмечено улучшение общего показателя функционирования клеток сетчатки по данным мфЭРГ на фоне прерывистого курсового (перерыв 3–5 дней между курсами) приема ВМК согласно инструкции и комплексным рекомендациям. При дальнейшем приеме курсами отмечалось улучшение (положительная динамика) всех показателей по данным мфЭРГ (см. рис. 2).
В качестве иллюстрации приводим собственные клинические наблюдения.
Клиническое наблюдение 1
Пациентка Ф., 15 лет. Зрение снижалось постепенно с 1-го класса. Пользуется дефокусными линзами для контроля миопии в течение 4 лет. Миопия высокой степени -6,5 дптр, стабильная за последние 4 года. ПЗР 24,8/24,8 мм, МКОЗ 1,0/1,0.
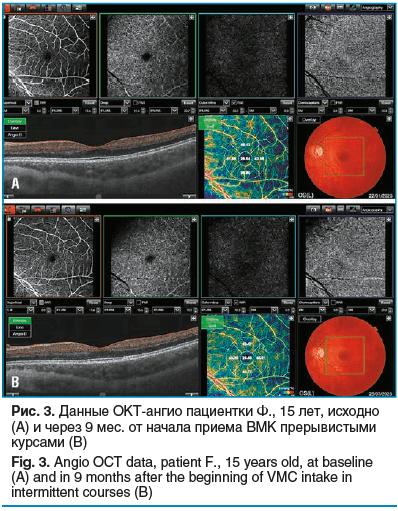
В анамнезе лазерная коагуляция сетчатки по поводу периферической витреохориоретинальной дистрофии обоих глаз. При исследовании структурной ОКТ профиль макулы сохранен, все слои сетчатки визуализируются без видимой патологии. Отмечается общее снижение плотности ганглиозного комплекса. При исследовании ОКТ-ангио отмечается снижение показателя VD (vessel density, плотность сосудов), т. е. снижена плотность сосудистой капиллярной сети в макулярной зоне, более выражена слева (рис. 3, А). Также выполнена мфЭРГ для оценки показателей в динамике после применения ВМК.
Пациентке был назначен ВМК Окувайт® детский в возрастной дозировке по 2 таблетки 1 раз в день курсами. Через 1, 3, 5, 7, 9 мес. наблюдения от начала приема ВМК курсами с перерывами 3–5 дней проводилось полное офтальмологическое обследование. Выявлена положительная динамика показателя VD ОКТ-ангио через 9 мес. от начала получения прерывистых курсов, особенно в левом глазу. Отмечено увеличение количественных показателей, переход тепловой карты ОКТ-ангио к более «теплым» цветам (рис. 3, B).
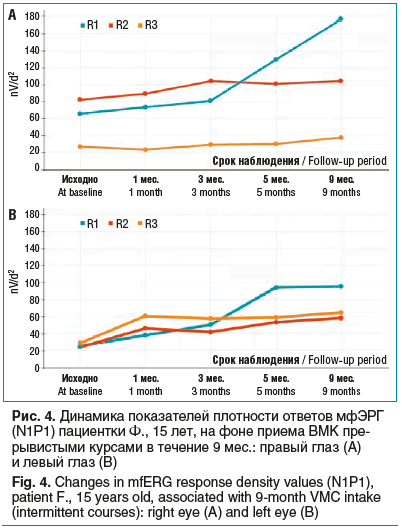
Положительная динамика показателей амплитуды мфЭРГ представлена на рисунке 4. Отмечается увеличение амплитуды, преимущественно в отведении R1, через 1 мес. от начала приема, а значительный прирост показателей заметен после 3 мес. курсового прерывистого приема (синяя линия) в составе комплексных рекомендаций. Это свидетельствует о повышении активности фоторецепторов и биполярных клеток сетчатки вследствие улучшения метаболизма. Подобная положительная динамика наблюдалась у всех остальных пациентов.
Клиническое наблюдение 2
Пациентка И., 15 лет. Зрение снижалось постепенно с 1-го класса. Пользуется ортокератологическими линзами в течение 4 лет, 1 год назад выполнена лазерная коагуляция сетчатки правого глаза по поводу периферической витреохориоретинальной дистрофии. Миопия средней степени -5,5 дптр, стабильна последние 4 года. ПЗР 26,12/26,2; МКОЗ 1,0/1,0. После лазерной коагуляции сетчатки пациентка в течение 1 года прерывистыми курсами принимала ВМК Окувайт® детский по 2 таблетки 1 раз в день.
По данным структурной ОКТ, профиль макулы сохранен, все слои сетчатки визуализируются без видимой патологии. Согласно результатам ОКТ-ангио снижена плотность сосудистой капиллярной сети в макулярной зоне. При исследовании ганглиозного комплекса отмечен небольшой фокальный дефект.
Проведена мфЭРГ для оценки в динамике после отмены приема ВМК.
Как видно на представленных графиках (рис. 5), проведено очередное исследование мфЭРГ через 1 и 3 мес. после отмены ВМК Окувайт® детский. Было отмечено ухудшение показателей амплитуды P1N1 примерно на 50% от исходного уровня. Затем пациентка снова начала прием ВМК в возрастной дозировке. Последующие измерения были сделаны через 3 мес. после курсового приема ВМК, показатели амплитуды начали восстанавливаться на правом глазу и полностью восстановились на левом.
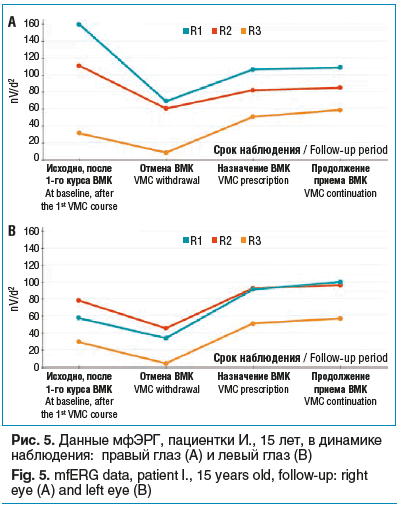
Представленные графики наглядно демонстрируют, что отмена приема ВМК в составе комплексных рекомендаций вызвала снижение показателей функционирования клеток сетчатки по данным объективной методики исследования активности клеток сетчатки (мфЭРГ).
Обсуждение
Результаты нашего исследования и анализ данных литературы подтверждают, что недостаточная обеспеченность детей ключевыми антиоксидантами и витаминами (в частности, витамином D и каротиноидами) в сочетании с высокой экспозицией синего света и высокими школьными нагрузками создают предпосылки для развития и прогрессирования миопии. Это обосновывает необходимость нутрицевтической поддержки.
Использование специально подобранных ВМК в составе комплексных рекомендаций является целесообразным и физиологичным путем для снижения потенциально опасного воздействия повреждающих факторов на ткани глаза (оксидативный стресс, фототоксическое действие синего света) в условиях дефицита нутриентов.
Согласно клиническим рекомендациям по лечению мио-пии 2024 г. ВМК следует применять регулярными курсами 2 раза в год2. Необходимость такой схемы обусловлена особенностями накопления и выведения их компонентов. Наш опыт позволяет рекомендовать использование ВМК прерывистыми курсами периодом 3–4 мес. Например, БАД к пище Окувайт® детский оказывает комплексное воздействие благодаря входящим в его состав компонентам: лютеину, зеаксантину, антоцианам черники и витамину D, 6 витаминам группы В и антиоксидантам, которые взаимодополняют и потенцируют защитное действие. Данная БАД в составе комплексных рекомендаций оказывает положительное действие на функционирование клеток сетчатки уже через 1 мес., что было подтверждено данными мфЭРГ.
Необходимо отметить, что, несмотря на включение ВМК в официальные клинические рекомендации по лечению миопии у детей, их использование пока прочно не вошло в рутинную практику.
Полученные нами результаты согласуются с общепризнанными данными о том, что ОПМП оказывает влияние на функцию макулы при различных патологиях (миопия, возрастная макулярная дистрофия, диабетическая ретинопатия), в том числе и в детском возрасте2. Дополнительный прием специально подобранных ВМК увеличивает ОПМП, при этом значительное увеличение может наблюдаться уже на 42-й день по сравнению с таковым при применении плацебо.
Закономерно, что вследствие улучшения метаболизма сетчатки происходит улучшение функции ее клеток (фоторецепторов и биполяров). Это было зафиксировано при помощи мфЭРГ. Есть также данные, что прием лютеина и зеаксантина с антиоксидантами может улучшать крово-обращение сетчатки уже после 3 нед. приема ВМК [41].
Это может быть объяснением того, что мы наблюдали положительную динамику у пациентов уже через 1 мес. приема ВМК для глаз. С течением времени показатель амплитуды электрических сигналов увеличивался, что свидетельствует об увеличении силы ответа клеток сетчатки и сокращении времени реакции на стимул.
По нашему мнению, в представленных клинических наблюдениях речь идет об активации работы клеток сетчатки, улучшении их функционирования. Сравнение проводилось с начальными показателями функционирования сетчатки одного и того же пациента, что говорит о восстановлении работы клеток из состояния субклинической дисфункции к полноценному функциональному состоянию, специфичному для данного пациента. Подчеркнем, что острота зрения с коррекцией (МКОЗ) у всех пациентов составляла 1,0 и никакого диагноза, помимо миопии, пациенту не было выставлено.
Ситуация, когда происходит отмена приема ВМК или перерыв более 2 мес., может сопровождаться снижением показателей мфЭРГ, что свидетельствует о снижении функционирования клеток сетчатки, поэтому важно, чтобы перерывы в приеме ВМК не были длительными (более 2 мес.). Известно, что скорость выведения витамина С и некоторых витаминов группы В зависит от принятой дозировки, запас этих витаминов в организме может сохраняться не более 2–4 нед., поэтому часть врачей обсуждают с пациентом перерыв в приеме ВМК не более 1–2 нед. [27].
Регулярный прием ВМК для глаз курсами на фоне комплексных рекомендаций по контролю миопии может способствовать уменьшению риска развития проблем с сетчаткой в будущем. Именно со снижением плотности ОПМП связывают такие осложнения миопии высокой степени, как миопическая макулопатия (в частности, ее атрофическая форма), формирование лаковых трещин и развитие миопической хориоидальной неоваскуляризации.
Заключение
Современный образ жизни, характеризующийся активным использованием цифровых устройств и повышенной зрительной нагрузкой, способствует увеличению числа пациентов с миопией в детском и подростковом возрасте. Эта тенденция усугубляется недостатком ключевых нутриентов, таких как лютеин, зеаксантин, а также витамины группы В и витамин D, которые критически важны для поддержания здоровья глаз и организма в целом. Отметим, что Россия входит в топ-5 стран с наибольшей распространенностью миопии, и практически половина детей к окончанию школы имеют близорукость. Прогрессирование миопии существенно возрастает по мере увеличения длительности и интенсивности зрительных нагрузок. Наши данные подтверждают, что подавляющее большинство детей и подростков недостаточно употребляют продукты, содержащие необходимые витамины и каротиноиды. У детей 7–17 лет наибольший дефицит отмечался по витаминам D, B1, B6, B9, B12, а у детей 3–6 лет — по витаминам D, B9, B12.
Для объективной оценки эффективности нутрицевтической поддержки был использован метод мфЭРГ, позволяющий оценить функционирование клеток сетчатки. Клинические примеры продемонстрировали, что даже 1 мес. приема специализированных ВМК в составе комплексных рекомендаций пациентами с миопией приводил к улучшению общего показателя функционирования клеток сетчатки по данным мфЭРГ. Это улучшение затруднительно определить стандартными методами. При курсовом приеме отмечалось улучшение всех показателей мфЭРГ (увеличение амплитуды). Особое внимание следует уделить необходимости курсового применения, поскольку отмена на 2 мес. приема ВМК, в частности Окувайт® детский, приводила к значительному снижению показателей функционирования клеток — на 40–50% по сравнению с данными, полученными на фоне приема ВМК.
Учитывая вышеизложенное, необходимо подчеркнуть роль педиатров. Именно они чаще всего первыми отмечают у ребенка такие неспецифические симптомы, как усталость, снижение концентрации и успеваемости, которые могут быть первыми признаками снижения зрения. До узких специалистов такие пациенты доходят не всегда, поэтому важно своевременно направить их на прием к офтальмологу. Дополнительное назначение специально разработанных ВМК для глаз поможет обеспечить организм необходимыми витаминами и микроэлементами в период активного роста и повышенных зрительных нагрузок, а также поддержать здоровье и улучшить качество жизни детей.
Сведения об авторах:
Малахова Анна Ивановна — к.м.н., главный внештатный офтальмолог Министерства здравоохранения Смоленской области, врач-офтальмолог взрослого офтальмологического отделения ОГБУЗ СОКБ; 214018, Россия, г. Смоленск, пр-т Гагарина, д. 27; ORCID iD 0000-0002-0181-9873
Ершов Антон Валерьевич — д.м.н., профессор кафедры патологической физиологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119048, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0001-5758-8552
Контактная информация: Малахова Анна Ивановна, e-mail: gloft67@mail.ru
Источник финансирования: статья подготовлена при поддержке компании ООО «Бауш Хелс». Позиция авторов статьи может отличаться от позиции компании ООО «Бауш Хелс».
Конфликт интересов отсутствует.
Статья поступила 15.09.2025.
Поступила после рецензирования 08.10.2025.
Принята в печать 31.10.2025.
About the authors:
Anna I. Malakhova — C. Sc. (Med.), Chief Freelance Ophthalmologist of the Ministry of Health of the Smolensk Region, Ophthalmologist of Adult Ophthalmological Department, Smolensk Regional Clinical Hospital; 27, Gagarin Ave., Smolensk, 214018, Russian Federation; ORCID iD 0000-0002-0181-9873
Anton V. Ershov — Dr. Sc. (Med.), Professor of the Department of Pathophysiology, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119048, Russian Federation; ORCID iD 0000-0001-5758-8552
Contact information: Anna I. Malakhova, e-mail: gloft67@mail.ru
Financial Disclosure: the paper was prepared with the support of Bausch Health LLC. The authors’ point of view may differ from that of Bausch Health LLC.
There is no conflict of interest.
Received 15.09.2025.
Revised 08.10.2025.
Accepted 31.10.2025.
1Всемирный доклад о проблемах зрения World report on vision. Женева: Всемирная организация здравоохранения; 2020.
2Клинические рекомендации. Миопия. 2024. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/preview-cr/109_2 (дата обращения: 30.09.2025).
Информация с rmj.ru


