Введение
Общее старение населения является одним из факторов увеличения частоты развития заболеваний, ассоциированных с возрастом. К ним относят сердечно-сосудистые заболевания, онкопатологию, заболевания опорно-двигательного аппарата.
Одним из распространенных заболеваний опорно-двигательного аппарата, связанных с возрастом, является остеоартрит (ОА). В настоящее время эта патология диагностирована более чем у 500 млн человек [1]. В РФ признаки поражения тазобедренных и/или коленных суставов наблюдаются у 13% населения старше 18 лет [2].
Согласно клиническим рекомендациям ОА представляет собой гетерогенную группу заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава: хряща, субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц. ОА характеризуется клеточным стрессом и деградацией экстрацеллюлярного матрикса всех тканей сустава, возникающими на фоне макро- и микроповреждений, при этом активируются аномальные адаптивные восстановительные ответы, включая провоспалительные пути иммунной системы [3].
Среди причин, способствующих поражению опорно-двигательного аппарата, рассматривают не только возрастные изменения, но и такие факторы, как изменение метаболизма, микробиоты, женский пол, травмы, наследственность и др. [2, 4–6]. Большинство исследователей сходятся во мнении, что вне зависимости от причины, обусловившей деструкцию сустава, патогенез развития патологического процесса примерно одинаков при всех формах поражения. Длительное время считали, что ОА является следствием изношенности суставных поверхностей, однако впоследствии была установлена роль воспалительной реакции в генезе заболевания, при которой системе иммунитета отводится ключевая роль. Установлено, что в развитии артрита принимает участие как врожденный, так и адаптивный иммунитет. Дисбаланс в системе провоспалительных и противовоспалительных цитокинов с приоритетом первых запускает целый каскад реакций, которые приводят к синтезу различных медиаторов, таких как простагландин Е2, оксид азота, матричные металлопротеиназы и пр., что способствует деструкции хряща / субхондральной кости, развитию синовита [1, 7–10], при этом синовит рассматривается как фактор риска ОА.
В работе Е.В. Гладковой и соавт. [9] показано, что дебют ОА сопровождается изменениями клеточного звена иммунитета. В обзоре Y.-S. Li et al. [11] представлен детальный разбор участия Т-лимфоцитов и предположительного участия аутоиммунных реакций в патогенезе ОА. Вместе с тем остается неясным, что же служит триггером патологического процесса, включающим в патогенез заболевания систему иммунитета: деградация субхондральной кости, суставного хряща или воспаление синовиальной оболочки [12]. Неясным остается и аутоантиген, сенсибилизация к которому обусловливает участие аутоиммунных реакций в генезе заболевания.
Цель исследования: изучить показатели клеточного иммунитета у пациентов с первичным ОА.
Содержание статьи
Материал и методы
В соответствии с поставленной целью были сформулированы следующие задачи:
изучить пролиферативную активность лимфоцитов в ответ на неспецифический митоген — фитогемагглютинин (ФГА) при первичном ОА;
изучить активность клеток, синтезирующих циклооксигеназу (ЦОГ) при первичном ОА;
изучить частоту сенсибилизации лимфоцитов при ОА к гликозамингликанам (хондроитин сульфату (ХС) / глюкозамин сульфату (ГС)), входящим в состав протеогликанов, являющихся составной частью хряща и синовиальной оболочки;
изучить частоту сенсибилизации лимфоцитов при синовите, ассоциированном с ОА, к ХС/ГС, входящим в состав протеогликанов.
Для решения поставленных задач методом случайной выборки в исследование были включены 80 больных ОА (группа ОА) (76 женщин, средний возраст 58±7 лет). Синовит был выявлен у 31 пациента. У большинства диагностирована коморбидная патология: сердечно-сосудистые заболевания, ожирение, сахарный диабет. В качестве контрольной группы обследовано 15 больных псориазом с признаками псориатического артрита (ПА) (группа ПА) (8 женщин, средний возраст 56±15 лет) и 25 пациентов без признаков патологии опорно-двигательного аппарата (группа контроля) (23 женщины, средний возраст 56±10 лет). Диагноз ОА был установлен на основании жалоб, данных анамнеза и классификационных критериев Американского колледжа ревматологии (American College of Rheumatology, ACR). Всем пациентам проводили клиническое, лабораторное, рентгенологическое обследование, а при подозрении на синовит — ультразвуковое исследование или магнитно-резонансную томографию суставов.
О состоянии системы клеточного иммунитета судили на основании оценки пролиферативной активности лимфоцитов в ответ на стимуляцию ФГА и ХС/ГС. Сенсибилизацию лимфоцитов к митогену и антигенам определяли с помощью реакции бласттрансформации лимфоцитов (РБТЛ) периферической крови (морфологический метод оценки реакции).
Для определения функциональной активности лимфоцитов к культуре клеток добавляли ФГА в пороговой дозе 5 мкг на культуру клеток. Для оценки активности клеток, синтезирующих ЦОГ, к культуре клеток с ФГА добавляли индометацин (0,0025 мг на культуру клеток). Также определяли реакцию лимфоцитов на ХС/ГС (0,01 мг / 0,06 мг на культуру клеток соответственно). Клетки культивировали при температуре 37 °C в течение 72 ч (с ФГА) и 96 ч (с антигенами). После культивирования из осадка готовили мазки и подсчитывали клетки, трансформированные в бластные формы, определяли индекс стимуляции по отношению к контрольной культуре, содержащей физиологический раствор. При показателях >1,5 реакцию расценивали как положительную.
Статистическую обработку результатов (структурный анализ, корреляционный анализ, t-тест) проводили с использованием пакета программ Statistica 8.0 (StatSoft, США). Различия в группах считали достоверными при уровне значимости <5% (p<0,05). Результаты исследования представлены в виде средних значений и среднеквадратичного отклонения.
Результаты и обсуждение
Результаты исследования представлены в таблице.
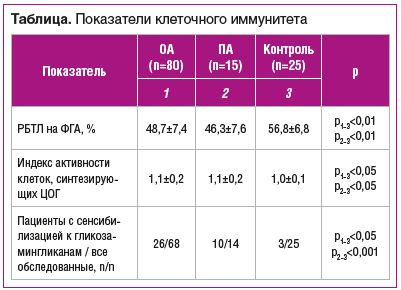
По данным исследований, установлено гендерное различие, указывающее на преобладание женщин в группе больных ОА, что может быть обусловлено не только гормональным влиянием, но и гендерным различием в отношении к своему здоровью [13]. В нашем исследовании среди пациентов также преобладали женщины.
Из представленных в таблице данных следует, что функциональная активность лимфоцитов в ответ на неспецифический митоген снижена как при ОА, так и при ПА, что указывает на причастность клеточного иммунитета к развитию заболеваний.
Аутоиммунные реакции на антигены гликозамингликанов при ОА встречались чаще, чем в контрольной группе без патологии опорно-двигательного аппарата, однако несколько реже, чем при ПА (p<0,05), что свидетельствует о более выраженной реакции системы иммунитета на антигены при этом заболевании.
Активность клеток, синтезирующих ЦОГ, была выше у пациентов как с ОА, так и с ПА (см. таблицу), что свидетельствует о роли воспаления в патогенезе артропатий. Более значимые различия могут наблюдаться при тяжелых, терминальных формах ОА [14], что не встречалось у наших пациентов. Активность клеток, синтезирующих ЦОГ, была несколько выше при наличии аутоиммунных реакций к гликозамингликанам, однако различие не достигало статистически значимых величин, что, возможно, обусловлено наличием вялотекущего воспалительного процесса в организме в целом.
При первичном ОА наличие синовита не отражалось в результатах лабораторных исследований (скорость оседания эритроцитов, С-реактивный белок, показатели активности клеток, синтезирующих ЦОГ), что, возможно, было обусловлено наличием воспаления не только в синовиальной оболочке, но и во всех составных частях сустава. По данным рентгенологического исследования, тяжесть поражения суставов при синовите была выше (p<0,05), а аутоиммунная реакция на антигены гликозамингликанов встречалась чаще (у 19 пациентов из 31 с синовитом по сравнению с 7 пациентами из 37 без синовита, p<0,001). Синовит при этом обусловлен не только участием аутоиммунных реакций, но и связан с более тяжелыми последствиями деградации хряща / субхондральной кости, участием провоспалительных цитокинов и других факторов воспаления. Не исключено, что аутоиммунные реакции к гликозамингликанам вносят определенный вклад в развитие более тяжелых форм ОА, включая синовит. В свою очередь, синовит является провоцирующим фактором дальнейшей деструкции тканей сустава. Сообщения о том, что синовит предшествует рентгенологическим признакам поражения сустава, несомненно, заслуживают внимания [15, 16], хотя существует альтернативная точка зрения, согласно которой синовит не приводит к потере хрящевой ткани [17]. С нашей точки зрения, воспаление синовиальной оболочки все же представляет собой вторичное событие, так как микротрещины субхондральной кости и изменения в прилегающем хрящевом слое на начальном этапе могут быть не зафиксированы при рентгенологическом исследовании. Это заключение подтверждает и выявление сенсибилизации к гликозамингликанам у больных ОА без признаков синовита, а также тот факт, что при ПА не у всех пациентов выявляются его признаки.
В обзоре E. Sanchez-Lopez et al. [8] обсуждается роль ряда факторов риска в развитии как ОА, так и синовита (травма, сопутствующая патология, механическая нагрузка, нарушение микробиоты), что, безусловно, имеет определенное значение, однако синовит развивается далеко не у всех пациентов.
Результаты, полученные в настоящем исследовании, свидетельствуют о важной роли аутоиммунных реакций против антигенов гликозамингликанов, входящих в состав протеогликанов, в развитии синовита. Именно они определяют прогрессирование заболевания, а не синовит, являющийся следствием этой реакции. Не исключено, что синовит, в свою очередь, способствует прогрессированию деградации хряща [18] вследствие секреции фибробластоподобными синовиоцитами цитокинов, факторов роста, матриксных металлопротеиназ и ингибиторов металлопротеиназ, стимулирующих катаболические пути в хондроцитах. Взаимоотношения между хондроцитами и синовиоцитами способствуют созданию порочного круга, что и приводит к прогредиентности течения заболевания.
Предположение о роли аутоиммунных реакций в патогенезе ОА обсуждалось неоднократно [11, 19–21], в качестве антигенов рассматривались коллаген I и II типа, фибронектин, протеогликаны (аггрекан). Вместе с тем известно, что аутоиммунная реакция на коллаген наблюдается преимущественно при ревматоидном артрите, но не при ОА. Наличие аутоиммунной реакции на гликозамингликаны, входящие в состав протеогликанов, продемонстрированное в настоящем исследовании, может свидетельствовать о ее значимости в развитии поражения хряща и синовиальной оболочки у части пациентов. Сравнительный анализ с данными литературы не представляется возможным, так как реакция системы иммунитета на гликозамингликаны ранее не изучалась.
Присутствие в синовиальной оболочке и синовиальной жидкости CD4+- и CD8+- клеток указывает на их значение в развитии воспаления. Появление медиаторов воспаления способствует деградации хряща и, возможно, субхондральной кости. Отсутствие сосудов в хряще не ведет к непосредственной атаке CD4+- и CD8+- клеток на хондроциты, однако это не исключает их участия в патогенезе заболевания.
Патогенез ОА представляется следующим образом: под влиянием различных первичных триггеров происходит деградация хряща и субхондральной кости, продукты разрушения попадают в синовиальную жидкость. Это способствует активации врожденного иммунитета. Дисбаланс в цитокиновой системе с преобладанием провоспалительных цитокинов (интерлейкинов 1β, 6, 8, 17, 18, фактора некроза опухоли α и др.), наряду с влиянием протеолитических ферментов и провоспалительных медиаторов, таких как простагландины, ЦОГ, оксид азота, матриксные металлопротеиназы, определяет дальнейшую деградацию хряща и развитие воспаления [22, 23]. В патогенезе заболевания принимает участие как врожденный, так и адаптивный иммунитет. У генетически предрасположенных пациентов к процессу подключаются аутоиммунные реакции, направленные против гликозамингликанов, входящих в состав протеогликанов. Это еще более ухудшает ситуацию, так как обусловливает дальнейшую деструкцию субхондральной кости и хряща, развитие синовита. Вялотекущее воспаление способствует прогредиентности патологического процесса, и возникает замкнутый круг, что, безусловно требует применения препаратов, способных его прервать. Эффективность глюкокортикостероидов при синовите обусловлена, возможно, не только противовоспалительным действием, но и их воздействием на аутоиммунные процессы, лежащие в основе патологического процесса у части пациентов. Персонифицированный подход к лечению пациентов с ОА [24] должен учитывать роль не только аутоиммунных реакций в патогенезе заболевания, но и других факторов [25].
Выводы
При ОА функциональная активность лимфоцитов в ответ на стимуляцию ФГА снижена.
Сенсибилизация лимфоцитов к антигенам гликозамингликанов (ХС/ГС), являющихся частью протео-гликанов, встречается чаще при первичном ОА, чем у лиц без патологии опорно-двигательного аппарата, что может указывать на их участие в патологическом процессе у части пациентов.
Аутоиммунная реакция к антигенам гликозамингликанов встречается чаще при ОА с признаками синовита и более тяжелых формах поражения суставов, что может свидетельствовать о значимости этих реакций в их развитии.
Полный список литературы Вы можете найти на сайте http://www.rmj.ru
Информация с rmj.ru




