Введение
В настоящее время миокардиты являются одними из самых трудных с точки зрения своевременности диагностики в клинике внутренних болезней, так как фактически отсутствуют патогномоничные симптомы и синдромы. При этом миокардиты способны скрываться под множеством масок и имитировать относительно редкие формы кардиомиопатий, например генетических, а отсутствие связи с инфекцией ни в коей мере не исключает диагноза миокардита. Крайне сложен для диагностики миокардит в случае его первично-хронического течения — при таком варианте дебют заболевания зачастую трудно бывает распознать вовремя [1].
Миокардит определяется совокупностью клинических и морфологических изменений тканей сердца, когда доказано или обоснованно предполагается наличие воспалительных изменений миокарда инфекционной или аутоиммунной природы. По причине высокой вариабельности клинических проявлений четкие сведения об эпидемиологии миокардитов отсутствуют, в частности, распространенность наиболее тяжелой формы, гигантоклеточного миокардита, составляет 0,0002–0,007%. Прогноз в случае гигантоклеточного миокардита крайне неблагоприятный, а наиболее эффективный метод лечения — трансплантация сердца [2, 3].
Решающую роль в диагностике миокардита играет эндомиокардиальная биопсия, являющаяся «золотым стандартом» в верификации морфологического диагноза, согласно актуальным клиническим рекомендациям. Также в клинических рекомендациях констатируется тот факт, что анализ результатов посмертных исследований выявляет значимую клиническую проблему прижизненной гиподиагностики миокардитов, что правомочно можно объяснить уже упомянутой многогранностью клинического дебюта и последующих неспецифических проявлений миокардитов [3]. При этом неинвазивная диагностика наиболее редких и прогностически неблагоприятных миокардитов без биопсии абсолютно невозможна. Этиология гигантоклеточного миокардита однозначно не определена, некоторыми авторами он определяется как идиопатический аутоиммунный вариант миокардита, также описаны и вирус-позитивные случаи, помимо этого, упоминаются клинические случаи, когда этиология осталась невыявленной [4].
Приводим клинический разбор случая гигантоклеточного миокардита, подтвержденного морфологически, без четкого дебюта клинических проявлений на фоне не до конца ясной этиологии.
Содержание статьи
Клиническое наблюдение
История болезни пациента представлена в хронологическом порядке с указанием всех имеющихся задокументированных инструментальных обследований и консультаций специалистов различного профиля.
02.04.2015 — пациенту В. (03.08.1989 г. р.) в возрасте 25 лет была проведена эхокардиография (ЭхоКГ) (табл. 1), по заключению которой определено: «Тахикардия. Пролапс митрального клапана 1-й степени. Митральная регургитация 1-й степени». При этом каких-либо последующих консультаций и рекомендаций специалистов не отмечено.


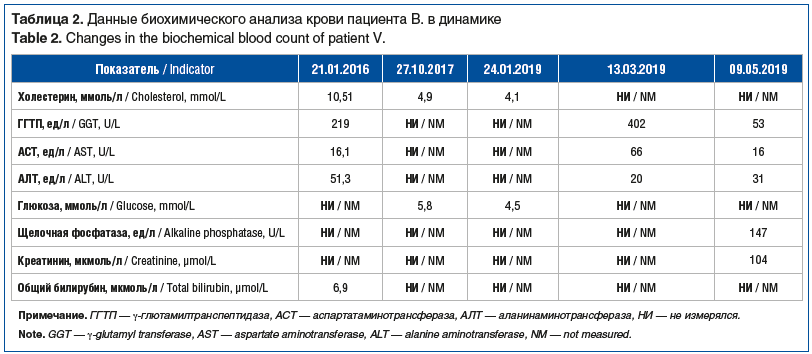
26.01.2016 — первая зафиксированная в амбулаторной карте пациента консультация гастроэнтеролога в возрасте 26 лет. На приеме жалоб не предъявлял, однако указал, что лечится от алкоголизма около 6 мес. (в ФГБУ «НМИЦ психиатрии и наркологии им. В.П. Сербского»), в связи с чем принимал дисульфирам, метионин, амитриптилина гидрохлорид, карбамазепин и из гепатопротекторов — адеметионин. При объективном осмотре состояние оценено как удовлетворительное, конституция нормостеническая, при наружном осмотре отклонений не отмечено, периферические печеночные знаки не выявлены. По бронхолегочной и сердечно-сосудистой системам значимых отклонений не выявлено, кроме тахикардии (дыхание везикулярное, частота дыхательных движений (ЧДД) 16 в 1 мин, тоны сердца ясные, ритмичные, ЧСС 104 в 1 мин, АД 120/80 мм рт. ст.). При оценке состояния желудочно-кишечного тракта и органов мочеиспускания отклонений выявлено не было. Результаты биохимического анализа крови от 21.01.2016 представлены в таблице 2. На основании представленных данных выставлен диагноз: хронический гепатит алиментарно-токсической этиологии с внутрипеченочным холе-стазом, активная фаза. Рекомендована терапия: урсодезоксихолевая кислота 300 мг 1 таблетка 3 р/день в течение 3 мес., метадоксин 500 мг 2 р/день в течение 1 мес., а также контроль уровня печеночных ферментов в динамике.
04.04.2016 пациенту (26 лет) проведена электрокардио-графия (ЭКГ): ритм синусовый, ЧСС 125 в 1 мин, интервал PQ 0,10 с, электрическая ось сердца отклонена вправо на фоне неполной блокады правой ножки пучка Гиса.
28.06.2016 — пациенту (26 лет) проведена ЭКГ, при которой по-прежнему фиксировались синусовый ритм на фоне тахикардии с ЧСС до 99 в 1 мин и отклонение электрической оси вправо, но впервые зарегистрирована отрицательная дельта-волна в отведениях I и aVL, V4–V5, что позволило дать заключение о синдроме Вольфа — Паркинсона — Уайта (Wolff-Parkinson-White, WPW). По данным ЭхоКГ сделано следующее заключение: «Пролапс МК 1-й степени. Митральная регургитация 2-й степени. Дилатация ЛЖ. Фракция выброса ЛЖ близка к нижней границе нормы; эксцентрическая гипертрофия миокарда ЛЖ; диастолическая дисфункция ЛЖ не-определенная».
28.06.2016 пациент в возрасте 26 лет впервые обратился за консультацией кардиолога, где предъявил жалобы на учащенное сердцебиение, особенно при физической нагрузке, жгучие боли за грудиной при физической нагрузке; АД отмечал преимущественно в пределах нормы (120/70 мм рт. ст.), редкие подъемы до 170/80 мм рт. ст.; настоящее ухудшение самочувствия отмечал около 1 мес. При клиническом осмотре состояние удовлетворительное, при наружном осмотре отклонений не выявлено, аускультативно в легких дыхание везикулярное, хрипов нет, ЧДД 16 в 1 мин; тоны сердца приглушены, ритмичные при ЧСС до 100 в 1 мин на фоне АД 100/70 мм рт. ст.; граница нижнего края печени у края реберной дуги; поколачивание по поясничной области безболезненно с обеих сторон; периферических отеков нет. На основании клинического осмотра и данных ранее проведенных ЭКГ и ЭхоКГ установлен заключительный диагноз: «Кардиомиопатия токсической этиологии. Тахикардиальный синдром. Синдром WPW», даны рекомендации: контроль АД и пульса, ивабрадина гидрохлорид 5 мг по 1 таблетке 2 р/день, калия аспаркам по 1 таблетке 3 р/день в течение 1 мес., мельдония дигидрат 500 мг по 1 таблетке 2 р/день в течение 1 мес., при повышении АД каптоприл 25 мг 1 таблетка под язык.
Из ранее рекомендованной терапии пациент принимал амитриптилин периодически 1 год, курит 1–2 пачки сигарет в день.
11.03.2019 — согласно проведенной пациенту в возрасте 29 лет ЭКГ, сохранялся синусовый ритм на фоне тахикардии до 100 в 1 мин, а также поворот электрической оси сердца при отрицательной дельта-волне в отведениях I и aVL, V4–V5 — синдром WPW, что позволяет сделать вывод об отсутствии динамики по сравнению с данными ЭКГ от 28.06.2016.
13.03.2019 — пациент (29 лет) вновь обратился за консультацией гастроэнтеролога спустя более чем 2 года от первичного обращения. Жалобы на изменение самочувствия не предъявлял, но отмечал, что при обследовании по месту жительства обратили внимание на повышение уровня ферментов печени. Также пациент сам указал, что злоупотребляет алкоголем и курит длительное время, лекарственные препараты постоянно не принимает. Назначенную терапию гепатопротекторами по поводу установленного диагноза «алкогольный гепатит» в 2016 г. принимал короткими курсами без улучшения по его субъективному мнению. Объективно при клиническом осмотре состояние пациента было удовлетворительное, при наружном осмотре язык обложен белым налетом у корня; АД 120/80 мм рт. ст., ЧСС 86 в 1 мин; по остальным органам и системам — без значимых клинических отклонений. Результаты лабораторных исследований крови от 13.03.2019 представлены в таблицах 2 и 3. УЗИ органов брюшной полости от 13.03.2019: диффузные изменения печени. На основании клинических, анамнестических и инструментальных данных был сформулирован диагноз: «Хронический гепатит алкогольной этиологии минимальной активности» и даны соответствующие рекомендации: щадящая диета, отказ от алкоголя и курения, по месту жительства: адеметионин в/в 800 мг № 10, тиоктовая кислота 600 мг на физрастворе 200 мл № 10, контроль маркеров вирусных гепатитов и печеночных ферментов.
13.05.2019 — пациент (29 лет) пришел на консультацию к гастроэнтерологу в рамках контрольной явки после лечения с положительной динамикой лабораторных показателей, однако указал, что на фоне лечения дважды употреблял алкоголь и продолжает курить. При объективном осмотре состояние пациента было расценено как удовлетворительное, язык также обложен белым налетом; АД 120/80 мм рт. ст., ЧСС 74 в 1 мин, по органам и системам — без отрицательной динамики по сравнению с осмотром от 13.03.2019. В биохимическом анализе крови от 09.05.2019 (см. табл. 2) определялась некоторая положительная динамика по сравнению с предыдущими данными. На основании клинического осмотра и лабораторных данных был установлен диагноз: «Хронический гепатит алкогольной этиологии, неактивная фаза» и даны рекомендации: отказ от алкоголя и курения, урсодезоксихолевая кислота 250 мг по 1 капсуле 3 р/день в течение 3 мес., шелуха семян подорожника 1 пачка 2 раза в месяц, наблюдение у терапевта по месту жительства.
12.09.2019 на амбулаторном приеме у кардиолога пациент в возрасте 30 лет предъявлял жалобы на недомогание, а именно снижение АД до 95/60 мм рт. ст. (при комфортных цифрах 120/80 мм рт. ст.), эпизоды сердцебиения без связи с физической нагрузкой, ощущение жжения в области груди, а также колющие боли в левой половине грудной клетки, возникающие без связи с физической нагрузкой, больше при психоэмоциональном напряжении, при этом обстоятельства купирования болевого синдрома пациент указать затруднялся. Пациент указал, что данная клиника появилась более 1 года назад, в связи с чем обращался в областную клиническую больницу к врачу-кардиологу (выписка не представлена). Со слов, выставлен диагноз: «Пролапс МК, токсическая кардиомиопатия. Назначена терапия: бисопролол 2,5 мг/сут, мельдония дигидрат 250 мг по 2 капсулы в день, магния оротата дигидрат 500 мг по 2 таблетки 3 р/день в течение 7 дней и далее по 1 таблетке 3 р/день. Также пациент подтвердил прием назначенных препаратов, однако эффективность от терапии оценить затруднился. Пациент предоставил заключение ЭхоКГ от 11.03.2019 (полный протокол утрачен): «Фракция выброса 52%. Левые камеры сердца незначительно расширены. Зон нарушения локальной сократимости нет. Межжелудочковая перегородка 1,1 см. Задняя стенка ЛЖ 1,3 см. Пролапс передней створки МК 5 мм. Тахикардия, единичные экстрасистолы; незначительный пролапс МК с умеренной регургитацией; гипертрофия миокарда ЛЖ; диастолическая дисфункция ЛЖ по гипертоническому типу; патологические потоки на других клапанах не зарегистрированы, сократительная способность миокарда незначительно снижена».
При объективном осмотре состояние оценено как удовлетворительное, рост 162 см, масса тела 78 кг, индекс массы тела 29 кг/м2, площадь поверхности тела 1,83 м2 (формула Du Bois), окружность талии 95 см. По органам и системам значимых отклонений выявлено не было, аус-культативно дыхание везикулярное (ЧДД 16 в 1 мин), тоны сердца ритмичные, ЧСС 88 в 1 мин, АД 115/70 мм рт. ст., перкуторно нижний край печени у края реберной дуги. На основе полученных данных был установлен предварительный диагноз: «Кардиомиопатия неуточненная, тахикардиальная форма? Пролапс МК (по ЭхоКГ от 11.03.2019)» и даны следующие рекомендации: дообследование (общий анализ крови и мочи, биохимический анализ крови, проведение исследований — ЭКГ, ЭхоКГ, суточное мониторирование ЭКГ, УЗИ щитовидной железы); назначено лечение: бисопролол 2,5 мг/сут под контролем АД, ЧСС, триметазидина гидрохлорид 35 мг по 1 таблетке 2 р/день в течение 1 мес., ивабрадина гидрохлорид 2,5 мг при повышении ЧСС; р-р мельдония дигидрат 5,0 в/в № 10, р-р калия аспарагинат + магния аспарагинат 5,0 + NaCl 0,9% 10,0 внутривенно № 10, р-р этилметилгидроксипиридина сукцината 2,0 в/м № 10.

11.10.2019 пациент (30 лет) повторно явился на амбулаторный прием без записи к кардиологу, при этом обследования и рекомендации от 12.09.2019 им не были выполнены. Со слов пациента, свое состояние он определял с положительной динамикой, и целью визита являлась необходимость получить справку о посещении врача 12.09.2019 для предъявления по месту требования. Пациенту повторно было рекомендовано выполнение назначений и обследований, данных 12.09.2019.
Со слов родственников, в дальнейшем пациент конкретных жалоб не предъявлял, но у него сохранялись низкое давление и слабость. В ночь с 19 на 20 октября 2019 г. рано утром, примерно в 05:25, пациент в возрасте 30 лет обнаружен мертвым дома.
По заключению постмортальной макроскопии миокарда (выдержка по миокарду): сердце размерами 13,3×12×7 см, массой 510 г. Полости сердца незначительно расширены. Сосочковые мышцы и хордальные нити визуально не изменены. Толщина мышцы ЛЖ под аортальным клапаном от 1,2 до 1,4 см; правого желудочка под трехстворчатым клапаном — до 0,5 см; межжелудочковой перегородки — 1,3 см. Клапаны сердца и крупных сосудов полупрозрачные, подвижные.
Постмортальное гистологическое исследование миокарда: очаговый продуктивный миокардит с присутствием единичных гигантских многоядерных клеток (см. рисунок). Фиброз интрамуральных артерий, очаговый заместительный, периваскулярный, сетчатый кардиосклероз, неравномерная гипертрофия, липофусциноз кардиомиоцитов. Очаговая фрагментация, диссоциация кардиомиоцитов, исчезновение поперечной исчерченности мелких групп волокон, контрактурные изменения 2–3-й степени, гипер-эозинофилия групп кардиомиоцитов, миоцитолиз единичных кардиомиоцитов.
Обсуждение
Клиническая симптоматика на начальных стадиях миокардита может полностью отсутствовать, и субъективными дебютными симптомами миокардита, по данным различных авторов, могут быть одышка (68,6%), сердцебиение (32,8%), кашель (8,9%), кровохарканье (11,9%), перебои (16,4%), кардиалгии (22,3%), повышение температуры (29,8%) и др. [2]. В большинстве клинических случаев, описанных в литературе, гигантоклеточный миокардит манифестирует быстро прогрессирующей сердечной недостаточностью с развитием кардиогенного шока, поперечной блокады сердца или внезапной сердечной смерти [5, 6].
В обсуждаемом клиническом примере пациент В. в сентябре 2019 г. обратился с жалобами, перекликающимися с данными статистики по миокардитам: упоминались и сердцебиение без связи с нагрузкой, и ощущение жжения в области груди, и колющие боли в левой половине грудной клетки, возникающие без связи с физической нагрузкой, больше при психоэмоциональном напряжении. При этом не отмечалось повышения температуры как на момент осмотра, так и в уточненном анамнезе: в течение 2019 г. у пациента В., согласно амбулаторной карте, дважды проведены консультации гастроэнтеролога, имеются результаты клинического анализа крови и биохимические анализы крови. Также имеется ЭКГ от 11.03.2019, где отмечается синусовая тахикардия на фоне верифицированного ранее WPW-синдрома (28.06.2016). При сравнении данных по ЭхоКГ в 25 и 26 лет можно отметить отрицательную тенденцию в виде дилатации ЛЖ, снижения ФВ ЛЖ к нижней границе нормы и выявления эксцентрической гипертрофии миокарда ЛЖ. При этом утрачен полный протокол ЭхоКГ (от 11.03.2019) за полгода до летального исхода, однако по имеющемуся заключению можно судить о сохраняющемся пролапсе МК с умеренной регургитацией и структурным изменением, характерным для кардио-миопатии, что и было отражено в диагнозе кардиолога от 12.09.2019. Таким образом, выявить четкую достоверную взаимосвязь какого-либо воспалительного процесса и дебюта гигантоклеточного миокардита по анамнезу пациента В. не представляется возможным.
При этом в анамнезе пациента В. к 27 годам задокументированы такие заболевания, как хронический гепатит алиментарно-токсической этиологии с внутрипеченочным холестазом (январь 2016 г.) на фоне лечения от алкоголизма, а также кардиомиопатия токсической этиологии с тахикардиальным синдромом. Определенную социальную характеристику пациенту дает упоминание в консультациях врачей факта курения и употребления алкоголя во время лечения, а также полное игнорирование рекомендаций по дообследованию от 12.09.2019, которые пациент не выполнил на момент повторного визита 11.10.2019. Следовательно, пациент систематически нарушал рекомендации врачей, поэтому нельзя исключить, что в обсуждаемом случае возможна была своевременная диагностика гигантоклеточного миокардита, если бы 12.09.2019 пациент проявил должную приверженность рекомендациям кардиолога по тщательному дообследованию. Также в приведенном клиническом наблюдении остается неустановленной этио-логия гигантоклеточного миокардита, так как у пациента в анамнезе отсутствует указание на аутоиммунные или иммуноопосредованные заболевания, но при этом и целенаправленно данная группа нозологий у него не исключалась в течение жизни, соответственно, подтверждается определение гигантоклеточного миокардита как редкого заболевания неясной этиологии.
В нашем случае смерть пациента была аритмической на фоне гигантоклеточного миокардита, что подтверждено данными гистологического исследования постмортального биоптата миокарда, где указаны патогномоничные патоморфологические критерии продуктивного гигантоклеточного миокардита: наличие гигантских многоядерных клеток при очаговой воспалительной инфильтрации миокарда (см. рисунок) и очагов замещения мышечной ткани сердца соединительной (рубцовой) тканью различной давности; признаки, характерные для тяжелого повреждения мышечных клеток сердца, являющегося специфичным для морфологической идентификации фибрилляции желудочков, — крупные очаги фрагментации, диссоциации кардиомиоцитов, исчезновение поперечной исчерченности мелких групп волокон, контрактурные изменения 2–3-й степени, гиперэозинофилия групп кардиомиоцитов, миоцитолиз единичных кардиомиоцитов.

В приведенном клиническом наблюдении морфологическая диагностика произошла постмортально, притом что «золотой стандарт» диагностики гигантоклеточного миокардита прижизненно возможен исключительно посредством эндомиокардиальной биопсии [7, 8]. Показано, что течение данного заболевания может имитировать большинство распространенных заболеваний сердца [9] и привести к необоснованной лекарственной терапии [10]. Заболевание более чем в половине диагностированных случаев имело первично-хроническое течение, т. е. начиналось без какого-либо клинически выраженного манифеста, а при диагностировании имело явные признаки давнего течения. При этом развитие желудочковых аритмий, нарушения проводимости сердца являются особенностью клинической картины, в связи с чем заболевание зачастую может иметь единственное клинически выявленное проявление — внезапную смерть при развитии фибрилляции желудочков. Годичная смертность при гигантоклеточном миокардите достигает 80%, половина больных умирают через 5,5 мес. от появления первых симптомов заболевания [11].
Заключение
Чаще всего гигантоклеточный миокардит определяют как редкое, быстро прогрессирующее фатальное заболевание аутоиммунной природы. Обнаруживаемый при этом заболевании основной патоморфологический маркер — гигантские многоядерные клетки являются трансформированными макрофагами, содержащими фагоцитированные фрагменты разрушенных собственных кардиомиоцитов. Диагностика этого вида миокардита затруднительна, так как при нем отсутствуют какие-либо специфические клинические симптомы. Объективная доказательная диагностика гигантоклеточного миокардита возможна лишь по результатам эндомиокардиальной биопсии сердца, а лечение в большинстве случаев требует его трансплантации.
Сведения об авторах:
Викентьев Вячеслав Викторович — к.м.н., профессор кафедры клинической функциональной диагностики лечебного факультета НОИ клинической медицины им. Н.А. Семашко ФГБОУ ВО «Российский университет медицины» Минздрава России; 127006, Россия, г. Москва, ул. Долгоруковская, д. 4; ORCID iD 0000-0001-8344-988X
Сапунова Дарья Александровна — к.м.н., доцент кафедры клинической функциональной диагностики лечебного факультета НОИ клинической медицины им. Н.А. Семашко ФГБОУ ВО «Российский университет медицины» Минздрава России; 127006, Россия, г. Москва, ул. Долгоруковская, д. 4; ORCID iD 0000-0001-7847-4693
Контактная информация: Сапунова Дарья Александровна, e-mail: sapunova_darya@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 20.06.2025.
Поступила после рецензирования 15.07.2025.
Принята в печать 07.08.2025.
About the authors:
Vyacheslav V. Vikentiev — C. Sc. (Med.), Professor of the Department of Clinical Functional Diagnostics of the Faculty of Medicine, N.A. Semashko Research Educational Institute of Clinical Medicine, Russian University of Medicine; 4, Dolgorukovskaya str., Moscow, 127006, Russian Federation; ORCID iD 0000-0001-8344-988X
Daria A. Sapunova — C. Sc. (Med.), Associate Professor of the Department of Clinical Functional Diagnostics of the Faculty of Medicine, N.A. Semashko Research Educational Institute of Clinical Medicine, Russian University of Medicine; 4, Dolgorukovskaya str., Moscow, 127006, Russian Federation; ORCID iD 0000-0001-7847-4693
Contact information: Daria A. Sapunova, email: sapunova_darya@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 20.06.2025.
Revised 15.07.2025.
Accepted 07.08.2025.
Информация с rmj.ru






