Введение
Известно, что вирус SARS-CoV-2, возбудитель новой коронавирусной инфекции (COVID-19), поражает не только органы дыхания, но и другие органы и системы, в том числе желудочно-кишечный тракт (ЖКТ)1,2. В нескольких метаанализах и оригинальных исследованиях было показано, что при COVID-19 частота диареи у взрослых пациентов составляет 7,2–49,5%, тошнота или рвота встречаются в 7,1–8,5% случаев, боль в животе — от 2,0 до 3,4% [1–3]. В детской популяции частота этих симптомов варьирует от 5 до 66% [4–6].
Вовлечение ЖКТ в патологический процесс при COVID-19 большинство исследователей связывают с обнаружением вируса в кишечнике [7–11]. В 22–54,5% случаев вирус SARS-CoV-2 может быть обнаружен в стуле пациентов с COVID-19, а иногда вирус обнаруживается в стуле даже после того, как результаты мазков, взятых из дыхательных путей, становятся отрицательными [7–9]. У пациентов с желудочно-кишечными симптомами общее время между появлением симптомов и клиренсом вируса значительно больше, чем у пациентов только с респираторными проявлениями [8, 12].
Активно обсуждается в литературе взаимосвязь желудочно-кишечных симптомов при инфицировании вирусом SARS-CoV-2 и продукции провоспалительных цитокинов [13, 14], развития воспаления кишечного эпителия [15, 16] и нарушения проницаемости кишечной стенки [17, 18]. В основном эти исследования выполнялись с участием взрослых пациентов, имеющих тяжелое течение болезни, исследования в педиатрической популяции немногочисленны.
Большинство исследователей придает большое значение изменениям кишечной микробиоты при инфицировании вирусом SARS-CoV-2 [19–22]. В исследованиях с участием взрослых пациентов с COVID-19, находящихся на лечении в стационаре, было показано, что состав кишечной микробиоты, определяемый метагеномным секвенированием кала, изменялся по сравнению с таковым у здоровых людей: разнообразие сокращалось, доля полезных комменсальных бактерий уменьшалась, а концентрация условно-патогенных микроорганизмов увеличивалась [21, 22]. В то же время другие исследования, также проводимые у взрослых пациентов с COVID-19, демонстрировали значимое увеличение микробного разнообразия при данном заболевании [23].
У детей, имеющих, как правило, легкое и среднетяжелое течение болезни, микробиота кишечника при COVID-19 изучена недостаточно. Между тем именно изменения в микробиоте кишечника и состоянии кишечной стенки могут лежать в основе учащения гастроэнтерологических симптомов и утяжеления существовавших ранее функциональных нарушений ЖКТ в постковидный период как у взрослых, так и у детей [18, 24, 25].
Анализ 14 рандомизированных контролируемых исследований (РКИ) и одного проспективного обсервационного исследования эффективности пробиотиков, зарегистрированных в реестрах клинических исследований по всему миру, позволяет заключить, что добавки с пробиотиками могут снизить тяжесть заболеваемости и смертности от COVID-19. Пробиотики могут ингибировать «цитокиновый шторм», одновременно повышая врожденный иммунитет и избегая чрезмерной активации адаптивного иммунитета, который должен быстро реагировать на вирусную атаку. Индуцированное пробиотиками подавление воспалительного цитокинового ответа может предотвратить как тяжесть, так и возникновение острого респираторного дистресс-синдрома и гастроэнтерологических проявлений, что делает пробиотики привлекательным дополнением к терапии. Однако в настоящее время нет РКИ, в которых были бы получены убедительные доказательства этого. Кроме того, имеются различия в эффективности в зависимости от клинической картины заболевания, возраста пациента, видов применяемых пробиотических штаммов и используемой дозы. Поэтому сегодня во всем мире проводится множество клинических исследований с целью определения роли пробиотиков как в профилактике, так и в лечении COVID-19.
Максилак® Бэби — первый синбиотик, зарегистрированный в РФ, который содержит 9 культур полезных бактерий в концентрации, необходимой для правильной работы кишечника ребенка, составляющей 1×109 КОЕ. Содержащиеся в составе синбиотика Максилак® Бэби лактобактерии подавляют рост патогенной микрофлоры, обеспечивают защитную функцию организма и способствуют укреплению иммунитета [26]. Бифидобактерии, которые также входят в состав синбиотика Максилак® Бэби, участвуют в синтезе аминокислот, белков и витаминов, усиливают всасывание ионов кальция, железа, витамина D. Фруктоолигосахариды (пребиотический компонент в составе синбиотика Максилак® Бэби) стимулируют быстрое размножение полезных микроорганизмов, что тормозит развитие патогенных бактерий; улучшают работу ЖКТ, стимулируют перистальтику, служат в целях профилактики запоров и диареи, способствуют нормализации работы ЖКТ [27].
Максилак® Бэби — синбиотик, специально созданный для детей и выпускаемый с помощью инновационной технологии производства. Данная технология защищает гранулы Максилак® Бэби от действия факторов внутренней и внешней среды, благодаря чему большая часть пробиотических бактерий в составе синбиотика Максилак® Бэби попадает в кишечник, а не растворяется в желудке, что положительно сказывается на восстановлении микрофлоры ЖКТ [28].
Цель исследования: оценить влияние синбиотика Максилак® Бэби на качественный и количественный состав кишечной микробиоты и состояние кишечной проницаемости у детей 3–14 лет с инфекцией COVID-19 легкой или средней степени тяжести.
Содержание статьи
Материал и методы
Проведено клиническое пострегистрационное открытое наблюдательное проспективное одноцентровое исследование с минимальной интервенцией.
Исследование было одобрено локальным этическим комитетом ФГБОУ ВО СПбГПМУ Минздрава России. В исследование были включены 32 ребенка в возрасте 3–14 лет (в том числе 21 мальчик и 14 девочек, средний возраст 9,5 года) с инфекцией COVID-19 легкой и средней степени тяжести.
Критерии включения: возраст 3–14 лет; наличие подтвержденной SARS-CoV-2-инфекции методом ПЦР; легкая или средняя степень тяжести течения COVID-19 по критериям методических рекомендаций (2020 г.)2; подписанное официальным законным представителем информированное согласие.
Критерии невключения: лечение антибиотиками или другими про- и пребиотиками; отказ от участия в исследовании.
Обследованы 2 группы пациентов. Дети 1-й группы в течение 4 нед. после выписки (выздоровления) принимали синбиотик Максилак® Бэби по 2 саше в день. Пациенты 2-й группы после выздоровления данный синбиотик не принимали.
Проводили сбор анамнеза, жалоб, оценку клинического статуса. У всех пациентов изучали структуру кишечного микробиома (методом 16S-секвенирования) и оценивали содержание зонулина в стуле в динамике трижды: в начале заболевания, к моменту выздоровления (14-е сутки), а также через 4 нед. после выздоровления. Исходно структуру кишечного микробиома сравнивали с микробиомом здоровых детей (n=30), сопоставимых по возрасту.
Исследование кала на зонулин проводили методом иммуноферментного анализа с помощью тест-системы IDK Zonulin ELISA (Immundiagnostik AG, Германия). Среднее значение показателя, заявленное производителем тест-системы, по данным обследования 40 практически здоровых лиц — 61±46 нг/мл. При значениях показателя <83,15 нг/мл результат расценивался как норма, при 83,15–110,0 нг/мл — как повышенная концентрация, >110 нг/мл — как высокая концентрация.
Статистическую обработку данных проводили с использованием пакета прикладных программ IBM SPSS Statictics 26. Для сравнения средних показателей количественных признаков в исследуемых группах использовали t-критерий Стьюдента с оценкой достоверности различий (p<0,05).
Результаты и обсуждение
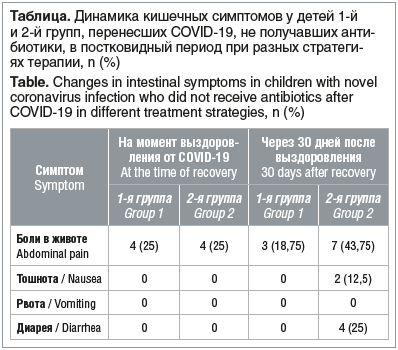
В начале заболевания боли в животе и диарея встречались у 16 (50%) детей, тошнота — у 8 (25%) детей, рвота — у 1 (3,1%) ребенка.
Сравнение микробиома детей в начале заболевания COVID-19 с микробиомом здоровых детей не выявило статистически значимых различий по профилю разнообразия микробиома на уровне родов. В то же время выявлены таксоны, преобладание которых было характерно для каждой группы на уровне вида. У здоровых детей преобладали такие таксоны, как Actinomyces ihuae, Anaerostipes butyraticus/hadrus, Enterococcus azikeevi /casseliflavus/durans/faecalis/faecium/hirae/lactis/mundtii/raffinosus/ratti/rivorum/thailandicus/villorum/xinjiangensis, Achromobacter_aegrifaciens/arsenitoxydans/denitrificans/insolitus/insuavis/marplatensis/piechaudii/ruhlandii/spanius/xylosoxidans, Frisingicoccus caecimuris, Bacteroides bouchesdurhonensis, Anaerotruncus rubiinfantis, Bacteroides caccae, Holdemania filiformis.
У детей с COVID-19 в начале заболевания преобладала Klebsiella pneumoniae, при уменьшенном содержании Erysipelotrichaceae UCG-003 bacterium, Dorea longicatena, Alistipes shahii, Anaerostipes hadrus, Parabacteroides distasonis, Roseburia intestinalis, Dialister succinatiphilus, Alistipes finegoldii, Veillonella atypica/parvula, Staphylococcus aureus/cohnii/nepalensis. Индекс биоразнообразия Шеннона не имел статистически значимых различий у детей с COVID-19 и здоровых детей.
Из всех кишечных симптомов к моменту выздоровления только у 8 (25%) детей сохранялись боли в животе. Остальные симптомы (тошнота, рвота и диарея) были купированы полностью. Различия по частоте всех симптомов статистически значимы. Можно предположить, что симптоматика со стороны ЖКТ связана непосредственно с цитопатогенным действием коронавируса на кишечный эпителий и быстро купируется на фоне его элиминации.
Сравнение микробиома всех детей в начале заболевания COVID-19 (n=32) с микробиомом тех же детей через 2 нед. после начала заболевания COVID-19 не выявило значимых изменений разнообразия на уровне родов; индекс биоразнообразия Шеннона статистически значимо не различался. Эти результаты объясняются тем, что ни один из пациентов не получал в процессе лечения антибиотиков, пре- и пробиотиков и других препаратов, влияющих на кишечную микробиоту.
При выявлении таксонов, преобладание которых характерно для каждой группы на уровне родов, было показано, что по мере выздоровления от COVID-19 выявляется преобладание в микробиоме таких родов, как Marvinbryantia, Anaerosporobacter, Ftlantibacter, Oscillospira, Psevdoscardovia, Lium sensu stricto 2. При выявлении таксонов, преобладание которых характерно для каждой группы на уровне вида, было установлено, что к моменту выздоровления от COVID-19 в микробиоте реже выявлялись Blautia coccoides/hansenii/marasmi/producta/stercoris, Clostridium sensu stricto 1 disporicum, Megamonas funiformis.
Уровни зонулина в стуле в начале болезни (77,38±12,59 нг/мл) и через 14 дней от ее начала на момент выздоровления (76,26±13,10 нг/мл) не имели статистически значимых различий (p=0,75). Средние показатели на всем протяжении наблюдения не превышали референсных значений; в дебюте заболевания 13 (37,14%) детей, а через 14 дней 10 (28,57%) детей имели повышенную концентрацию зонулина в кале (р>0,05 по сравнению с исходным показателем). Корреляции изменения уровня зонулина в стуле с наличием жалоб со стороны ЖКТ не выявлено.
При изучении микробиома детей с COVID-19 на 14-е сутки после начала заболевания и через 30 сут после лечения синбиотиком не установлено статистически значимых различий в разнообразии микроорганизмов на уровне родов. Также не получено различий при сравнении индекса Шеннона (см. рисунок А).
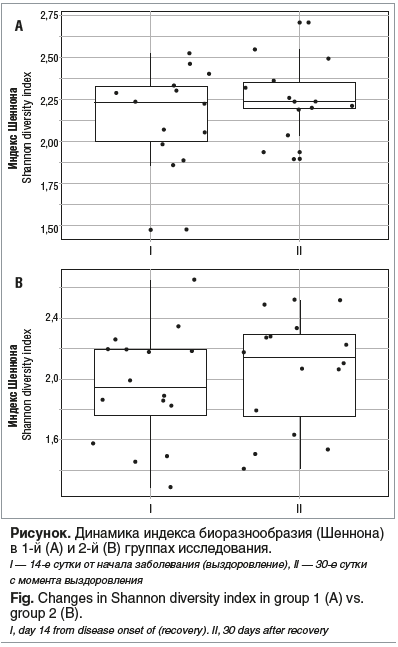
Выявление таксонов, преобладание которых характерно для каждой группы на уровне родов, показало, что у детей из 1-й группы увеличилось количество таких микроорганизмов, как Weissella, Veilonella и Oscillospira, однако это увеличение не было статистически значимым. Поскольку микроорганизмы этих родов отсутствуют в использованном в исследовании синбиотике, это свидетельствует о модифицирующем влиянии этого синбиотика на микробиом, а не о внесении дополнительных пробиотических культур.
Анализ таксонов, преобладание которых характерно для каждой группы на уровне вида, выявил, что после приема синбиотика Максилак® Бэби в микробиоме статистически незначимо уменьшается содержание Prevotella_stercorea, Veillonella_dispar/parvula и Bacteroides_fragilis.
У детей из 1-й группы не зарегистрировано статистически значимых повышений уровня зонулина на 30-е сутки по сравнению с показателем на 14-е сутки (79,02±11,87 нг/мл соответственно; р=0,40).
У детей из 2-й группы выявлено увеличение разнообразия микроорганизмов, в том числе по показателю индекса Шеннона были найдены статистически значимые различия (см. рисунок B). Увеличивалось содержание родов Enterococcus, Prevotellaceae, GCA-900066575, Howardella, Lachnospiraceae NK4A136 grou и видов Bacteroides fragilis, Bacteroides thetaiotaomicron, Anaerostipes hadrus, Parabacteroides distasonis, Roseburia intestinalis, Mitsuokella jalaludinii, Weissella cibaria/confusa/koreensis/minor, Veillonella dispar/parvula, Lactobacillus curvatus/graminis/sakei, Succinatimonas hippei, Bacteroides nordii, Lactobacillus brevis/casei/delbrueckii/paracasei/rhamnosus, Leuconostoc citreum/gelidum/holzapfelii/mesenteroides, Oscillibacter ruminantium, Sneathia sanguinegens, Pseudomonas deceptionensis/fluorescens/fragi/lundensis/psychrophila/putida/syringae/taiwanensis/weihenstephanensis.
Во 2-й группе на фоне повышения разнообразия микроорганизмов уровень зонулина в кале повышался на 30-е сутки по сравнению с показателем на 14-е сутки статистически значимо (87,95±10,96 нг/мл; р=0,048).
На фоне повышения разнообразия микроорганизмов и значимого повышения уровня зонулина в стуле у детей из 2-й группы отмечалось учащение болей в животе и появление диареи и тошноты, в отличие от детей из 1-й группы (см. таблицу).
Выявленное нами повышение уровня зонулина в стуле после перенесенной инфекции СOVID-19 в легкой и среднетяжелой форме, не требующей антибиотикотерапии, может быть связано как с непосредственным повреждением кишечного эпителия, так и со значимыми изменениями кишечного микробиоценоза вследствие действия вируса на микробиоту. Результаты, полученные в 1-й группе с применением синбиотика Максилак® Бэби, демонстрируют протективную роль синбиотика в отношении кишечной проницаемости после перенесенной коронавирусной инфекции. Это может быть обусловлено тем, что Максилак® Бэби, содержащий 9 штаммов изученных лакто- и бифидобактерий в необходимой для кишечника человека концентрации — выше 1×109 КОЕ и пребиотики — фруктоолигосахариды, обеспечивает условия для роста и размножения нормальной микробиоты человека и предотвращает избыточный рост условно-патогенной микробиоты. Повышение проницаемости кишечника именно после перенесенной новой коронавирусной инфекции и связанная с ней эндотоксемия также могут лежать в основе патогенеза развития постковидного синдрома; эту гипотезу подтверждают данные эффективности плазмафереза при Кавасаки-подобном мультисистемном воспалительном синдроме у детей в отсроченном периоде коронавирусной инфекции [28].
Назначение синбиотика Максилак® Бэби детям 3–14 лет в течение 4 нед. после выздоровления от инфекции COVID-19 было безопасным, не имело побочных эффектов и хорошо переносилось детьми.
Выводы
-
У детей с легкой и среднетяжелой формой COVID-19, не получающих антибиотики, в начале заболевания могут отмечаться боли в животе и диарея.
-
У таких детей имеются изменения микробиоты на уровне родов и видов, однако при этом не выявлено статистически значимых различий по профилю разнообразия микробиома на уровне родов с микробиомом здоровых детей аналогичного возраста, уровень зонулина в кале соответствует референсным значениям, что свидетельствует о нормальной кишечной проницаемости.
-
Постковидный период (30 дней наблюдения) у детей 3–14 лет, перенесших COVID-19 в легкой и среднетяжелой форме и не получавших антибиотики, пре- и пробиотики на протяжении всего периода наблюдения, характеризовался возобновлением тошноты, диареи и болевого абдоминального синдрома, повышением уровня зонулина в стуле и значимым повышением биоразнообразия микробиома, в том числе оцененного по показателю индекса Шеннона.
-
Постковидный период (30 дней наблюдения) у детей 3–14 лет, перенесших COVID-19 в легкой и среднетяжелой форме и не получавших антибиотики, но получивших Максилак® Бэби в течение 1 мес. после выздоровления, характеризовался отсутствием тошноты, рвоты и диареи, уменьшением частоты болевого абдоминального синдрома, отсутствием изменений уровня зонулина в стуле и изменений биоразнообразия микробиома, в том числе оцененного по показателю индекса Шеннона. После приема синбиотика Максилак® Бэби отмечалось преобладание таких микроорганизмов, как Weissella, Veilonella и Oscillospira, уменьшение содержания Prevotella_stercorea, Veillonella_dispar/parvula и Bacteroides_fragilis.
-
Учитывая положительные эффекты применения синбиотика Максилак® Бэби у детей 3–14 лет с инфекцией COVID-19 легкой и средней степени тяжести в постковидный период, рекомендуем назначение этого синбиотика в течение 4 нед. после выздоровления от инфекции COVID-19, без антибиотикотерапии, для купирования гастроинтестинальных симптомов, нормализации кишечной проницаемости и кишечного микробиоценоза.
-
Назначение синбиотика Максилак® Бэби детям 3–14 лет в течение 4 нед. после выздоровления от инфекции COVID-19 оказалось безопасным, не имеющим побочных эффектов и хорошо переносимым.
-
Полученные нами данные, а также результаты проведенных ранее исследований с применением пробиотиков при респираторных вирусных инфекциях, являются основанием для внедрения стратегии применения пробиотиков у детей как при инфекции COVID-19, так и при других респираторных вирусных инфекциях.
1. Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 15 (22.02.2022). (Электронный ресурс.) URL: https://static-0. minzdrav.gov.ru/system/attachments/attaches/000/059/392/original/ВМР_COVID-19_V15.pdf (дата обращения: 20.06.2023).
2. Методические рекомендации «Особенности клинических проявлений и лечения заболевания, вызванного новой коронавирусной инфекцией (COVID-19) у детей. Версия 2 (03.07.2020). (Электрон- ный ресурс.) URL: https://static-0.minzdrav.gov.ru/system/attachments/attaches/000/050/914/original/03062020_дети_COVI… (дата обращения: 20.06.2023).
Сведения об авторах:
Новикова Валерия Павловна — д.м.н., профессор, заведующая кафедрой пропедевтики детских болезней с курсом общего ухода за детьми, заведующая лабораторией медикосоциальных проблем в педиатрии ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0002-0992-1709.
Полунина Анна Владимировна — аспирант кафедры пропедевтики детских болезней с курсом общего ухода за детьми, лаборант-исследователь лаборатории медико-социальных проблем в педиатрии ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0003-2613-1503.
Баннова Светлана Леонидовна — к.м.н., доцент кафедры инфекционных заболеваний у детей им. проф. М.Г. Данилевича, заведующая отделением для детей с новой коронавирусной инфекцией COVID-19 с палатами реанимации и интенсивной терапии ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0003-1351-1910.
Балашов Алексей Львович — к.м.н., доцент кафедры пропедевтики детских болезней с курсом общего ухода за детьми ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; главный врач СПб ГБУЗ «ГП № 56»; 192241, Россия, г. Санкт-Петербург, ул. Пражская, д. 40, литер А; ORCID iD 0000-0002-1116-3118.
Дудурич Василиса Валерьевна — биолог-генетик ООО «СЕРБАЛАБ»; 199106, Россия, г. Санкт-Петербург, Большой пр-т В.О., д. 90, корп. 2, литер 3; ORCID iD 0000-0002-6271-5218.
Данилов Лаврентий Глебович — биоинформатик ООО «СЕРБАЛАБ»; 199106, Россия, г. Санкт-Петербург, Большой пр-т В.О., д. 90, корп. 2, литер 3; ORCID iD 0000-0002-4479-3095.
Блинов Александр Евгеньевич — старший научный сотрудник лаборатории медико-социальных проблем в педиатрии ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0002-2895-7379.
Варламова Ольга Николаевна — научный сотрудник лаборатории медико-социальных проблем в педиатрии ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0002-2195-0756.
Контактная информация: Полунина Анна Владимировна, e-mail: anna.polunina.doc@icloud.com.
Прозрачность финансовой деятельности: исследование проведено при финансовой поддержке АО «Биннофарм Групп».
Конфликт интересов отсутствует.
Статья поступила 25.06.2023.
Поступила после рецензирования 18.07.2023.
Принята в печать 10.08.2023.
About the authors:
Valeriya P. Novikova — Dr. Sc. (Med.), Professor, Head of the Department of Propaedeutics of Childhood Diseases with the Course of General Child Care, Head of the Laboratory of Medical Social Issues, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0002-0992-1709.
Anna V. Polunina — post-graduate student of the Department of Propaedeutics of Childhood Diseases with the Course of General Child Care, laboratory researcher of the Laboratory of Medical Social Issues, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0003-2613-1503.
Svetlana L. Bannova — C. Sc. (Med.), associate professor of the prof. M.G. Danilevich Department of Infectious Diseases in Children, Head of the Department for Children
with thr Novel Coronavirus Infection with Intensive Care Unit, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0003-1351-1910.
Aleksey L. Balashov — C. Sc. (Med.), associate professor of the Department of Propaedeutics of Childhood Diseases with the Course of General Child Care, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; Chief Physician, City Polyclinics No. 56; 40, Lett. A, Prazhskaya str., St. Petersburg, 192241, Russian Federation; ORCID iD 0000-0002-1116-3118.
Vasilisa V. Dudurich — biologist-geneticist, CerbaLab Ltd; 90, Build. 2, Lett. 3, Bolshoy av. of the Vasil’evskiy Island, St. Petersburg, 199106, Russian Federation; ORCID iD 0000-0002-6271-5218.
Lavrentiy G. Danilov — bioinformatician, CerbaLab Ltd; 90, Build. 2, Lett. 3, Bolshoy av. of the Vasil’evskiy Island, St. Petersburg, 199106, Russian Federation; ORCID iD 0000-0002-4479-3095.
Alexandr E. Blinov — senior researcher of the Laboratory of Medical Social Issues, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0002-2895-7379.
Olga N. Varlamova — researcher of the Laboratory of Medical Social Issues, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0002-2195-0756.
Contact information: Anna V. Polunina, e-mail: anna.polunina.doc@icloud.com.
Financial Disclosure: the study is supported by JSC «Binnopharm Group».
There is no conflict of interest.
Received 25.06.2023.
Revised 18.07.2023.
Accepted 10.08.2023.
Информация с rmj.ru


