Введение
Фибрилляция предсердий (ФП) широко распространена в российской популяции и является частой причиной обращения за медицинской помощью, плановых и экстренных госпитализаций, временной, а в ряде случаев и стойкой утраты трудоспособности пациентов. Заболеваемость и распространенность ФП увеличиваются с возрастом, однако нередко аритмия поражает и пациентов молодого возраста, что обусловливает дополнительные экономические затраты [1, 2].
Бронхиальная астма (БА) является одним из самых распространенных хронических гетерогенных заболеваний дыхательных путей, характеризуется хроническим воспалением, наличием респираторных симптомов, которые проявляются вместе с вариабельной обструкцией дыхательных путей[1]. Отмечается рост заболеваемости за последние годы как БА [3], так и сочетанной кардиорес-пираторной патологии, в том числе БА и ФП [4]. Данный факт связывают с наличием общих патогенетических звеньев, таких как оксидативный стресс, системное воспаление, легочная гипертензия, эндотелиальная дисфункция. При этом имеются данные, что само снижение бронхиальной проводимости повышает риск развития ФП [5]. В клинической практике существенные трудности возникают при подборе адекватной терапии данной группе пациентов. Применяемые кардиологами лекарственные препараты могут оказывать нежелательные эффекты и дестабилизировать течение заболеваний дыхательной системы, при этом эффективность инвазивных вмешательств (например, катетерной аблации легочных вен) у пациентов с сочтенной патологией ниже [6].
Представляем клиническое наблюдение успешного медикаментозного лечения ФП у пациентки с ранее не диагностированной сопутствующей БА с использованием антиаритмического препарата диэтиламинопропионил-этоксикарбониламинофенотиазина гидрохлорида. Обсуждены практические аспекты мониторинга эффективности и безопасности антиаритмической терапии.
Содержание статьи
Клиническое наблюдение
Пациентка К. 57 лет была госпитализирована в стационар НИИ клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦК им. ак. Е.И. Чазова» Минздрава России по причине ежедневных приступов учащенного неритмичного сердцебиения, которые также имели отчетливые клинические проявления в виде выраженной одышки, слабости. Приступы продолжались от нескольких минут до нескольких часов, неоднократно оказывались причиной вызова скорой медицинской помощи для купирования аритмии посредством внутривенной инфузии амиодарона.
Из анамнеза известно, что в подростковом возрасте наблюдалась у аллерголога в связи с сезонной реакцией на цветение березы в виде ринита и конъюнктивита. В дальнейшем выраженность сезонных обострений не требовала обращений за медицинской помощью. Пациентка отрицала заболевания сердечно-сосудистой системы, курение и злоупотребление алкоголем, ранее систематически не принимала никаких лекарственных препаратов. При ситуационных измерениях подъемы артериального давления не регистрировались. Ни у кого из близких родственников пациентки не было диагностировано нарушений ритма сердца и иных заболеваний сердечно-сосудистой системы в молодом возрасте. Мать пациентки длительное время страдала БА.
Приступы учащенного неритмичного сердцебиения впервые возникли за 4 мес. до госпитализации на фоне острого бронхита, протекавшего с высокой лихорадкой (диагноз установлен в поликлинике по месту жительства). Амбулаторно проводилось лечение антибиотиком азитромицином в дозе 500 мг/сут в течение 3 дней, амброксолом 30 мг 3 р/день в течение 5 дней, на фоне приема которых нормализовалась температура тела, а затем существенно уменьшилось количество отделяемой мокроты и интенсивность кашля вплоть до исчезновения данной симптоматики. Несмотря на улучшение состояния, приступы сердцебиения у пациентки сохранялись. Была обследована у кардиолога по месту жительства. На основании данных ЭКГ, зарегистрированной во время приступа, диагностирована пароксизмальная форма ФП. Пациентке амбулаторно была назначена терапия метопролола сукцинатом в дозе 50 мг/сут, на фоне которого приступы аритмии сохранялись, в связи с чем препарат отменен, и пациентка была госпитализирована.
По результатам проведенного осмотра, оценки анамнеза, лабораторного (общеклинический, биохимический анализы крови, определение сывороточной концентрации тиреотропного гормона) и инструментального (регистрация ЭКГ, рентгенография органов грудной клетки, эхокардиография трансторакальная, суточное мониторирование ЭКГ) обследования, не было выявлено никаких признаков структурного заболевания сердца, а также наиболее значимых преходящих факторов (тиреотоксикоза, нарушений электролитного обмена, признаков инфекционно-воспалительного процесса и др.), способных потенцировать возникновение пароксизмов ФП. По результатам холтеровского мониторирования регистрировалась частая наджелудочковая экстрасистолия (НЖЭ) в количестве 21 624 НЖЭ/сут, отмечено 4 устойчивых пароксизма ФП общей продолжительностью до 124 мин. На основании полученных данных поставлен клинический диагноз I48.0: Пароксизмальная форма фибрилляции предсердий, риск тромбоэмболических осложнений по шкале CHA2DS2-Vasc 0 баллов, выраженность клинических проявлений по шкале ЕHRA: класс III, частая наджелудочковая экстрасистолия.
Учитывая возраст пациентки, тяжесть клинических проявлений ФП и отсутствие значимого ремоделирования предсердий по данным эхокардиографического исследования, рассматривался вопрос о проведении катетерной аблации легочных вен, однако от проведения вмешательства пациентка воздержалась.
В целях предупреждения рецидивов пароксизмов ФП пациентке была инициирована антиаритмическая терапия (ААТ) пропафеноном 150 мг 3 р/день. Через 1 ч после первого же приема препарата отмечено появление жалоб на одышку, приступы сухого непродуктивного кашля. При аускультации легких обращали на себя внимание отсутствовавшие ранее множественные сухие свистящие хрипы. Ситуация была расценена как бронхоспазм на фоне приема вышеуказанного препарата, в связи с чем пациентке был назначен ингаляционно β2-агонист (сальбутамол) 100 мкг 2 дозы однократно с положительным эффектом (значительное уменьшение одышки, отсутствие сухих хрипов при аускультации). Пропафенон был отменен.
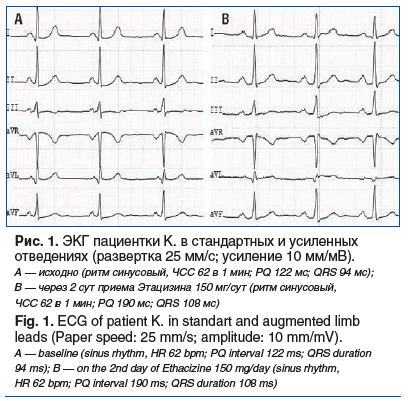
На следующий день пациентке был назначен диэтил-аминопропионилэтоксикарбониламинофенотиазина гидрохлорид (Этацизин, «Олайнфарм») в дозе 50 мг 3 р/день. Прием препарата не сопровождался жалобами на одышку и сухой кашель, аускультативно дыхание проводилось во все отделы, хрипов не было. При регистрации ЭКГ после приема первой дозы Этацизина и на 2-е сутки лечения (рис. 1) значимого увеличения длительности интервалов PQ и QRS зарегистрировано не было. Начиная со 2-го дня приема препарата пациентка отметила улучшение самочувствия, заключавшееся в уменьшении количества перебоев в работе сердца, сокращении продолжительности, а затем и полном отсутствии приступов учащенного неритмичного сердцебиения. Контрольное холтеровское мониторирование на 3–4-е сутки приема Этацизина 150 мг/сут подтвердило отсутствие пароксизмов ФП и подавление наджелудочковой эктопической активности (зарегистрировано 52 НЖЭ/сут) без значимых нарушений проводимости.
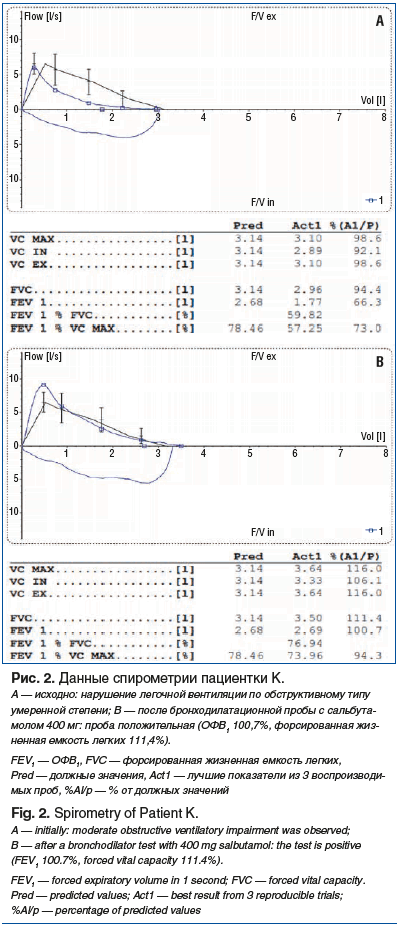
Учитывая, что у пациентки в анамнезе аллергический ринит (аллергическая реакция на цветение березы в виде ринита и конъюнктивита), наличие отягощенной семейной наследственности по БА (мать пациентки страдала БА), возникновения симптомов бронхообструкции после приема препарата, имеющего β-блокирующие свойства, пациентка консультирована пульмонологом. Рекомендовано проведение спирометрии с бронходилатационной пробой, оценки уровня оксида азота в выдыхаемом воздухе (FeNO) (32 ppb, норма ниже 25 ppb), рентгенографии легких (без патологии), анализ крови на содержание IgE (в пределах референтных значений) и эозинофильного катионного протеина (в пределах референтных значений). По результатам спирометрии выявлены нарушения легочной вентиляции по обструктивному типу умеренной степени, проба с сальбутамолом 400 мкг положительная (коэффициент бронходилатации +34%, абсолютный прирост объема форсированного выдоха за 1-ю секунду (ОФВ1) 920 мл). Постбронходилатационный индекс Генслера 76,94% (рис. 2).
На основании клинической картины, результатов лабораторного обследования, данных оценки уровня оксида азота в выдыхаемом воздухе и спирометрии был установлен диагноз: бронхиальная астма, смешанная, легкая персистирующая, частично контролируемая. Дыхательная недостаточность 0 степени. Аллергический ринит. Сенсибилизация к пыльцевым аллергенам (деревья)[2].
Рекомендованы терапия ингаляционным глюкокортикостероидом (будесонид 160 мкг 2 р/день) и β2-агонистом длительного действия (формотерол 4,5 мкг 2 р/сут) длительно, при возникновении приступа — короткодействующий β2-агонист (сальбутамол) 100 мкг 2 вдоха по потребности ингаляционно, не более 3–4 р/сут, пикфлоуметрия, контроль спирометрии через 2–4 нед. и далее через 6 мес., наблюдение пульмонолога.
На фоне проводимого лечения Этацизином в дозе 150 мг/сут в течение 2 лет пароксизмы ФП не рецидивировали, БА оставалась под контролем на фоне назначенной терапии.
Обсуждение
Рецидивирующие пароксизмы ФП являются распространенной причиной обращения за медицинской помощью и экстренных госпитализаций для купирования аритмии [7]. Данные эпидемиологических исследований указывают на рост заболеваемости и распространенности ФП в старших возрастных группах и продолжающееся год от года увеличение количества новых случаев постановки диагноза ФП [8, 9].
Современные подходы к ведению пациентов с ФП в актуальных клинических рекомендациях Европейского общества кардиологов (2024 г.) обобщены мнемоникой AF-CARE. Они включают в себя: 1) оптимальное лечение сердечно-сосудистых заболеваний и контроль факторов риска, способствующих возникновению аритмии (Comorbidities); 2) назначение антикоагулянтной терапии для предупреждения кардиоэмболических осложнений аритмии (Anticoagulation); 3) контроль над симптомами заболевания, достигаемый посредством стратегий «контроля ритма» и «контроля частоты сердечных сокращений» (rate/rhythm-Сontrol); 4) обязательное наблюдение пациента в динамике для определения эффективности проводимых мероприятий (Evaluation) [10, 11].
Результаты исследования EAST AFNET-4, приостановленного досрочно, показали преимущества раннего применения стратегии «контроля ритма» у пациентов с непродолжительным анамнезом ФП и сопутствующими сердечно-сосудистыми заболеваниями, которые заключались в достоверном и увеличивавшемся по мере продолжения наблюдения снижении вероятности достижения комбинированной конечной точки (смерть, острое сердечно-сосудистое осложнение, госпитализация по причине декомпенсации сердечной недостаточности) по сравнению с пациентами, рандомизированными в группу «контроля частоты» [12].
Стратегия контроля ритма включает в себя комплекс мероприятий, направленных на восстановление (медикаментозная и электрическая кардиоверсии) и как можно более длительное удержание синусового ритма (СР), достигаемое посредством назначения медикаментозной ААТ на длительный прием, либо посредством инвазивных вмешательств. Основным методом инвазивного лечения ФП является катетерная аблация легочных вен (радиочастотная, криобаллонная либо аблация импульсным полем). Данные клинических исследований свидетельствуют о преимуществах катетерной аблации перед медикаментозной ААТ [13, 14], однако эффективность данного метода лечения не является абсолютной и вмешательство может иметь опасные для жизни осложнения (ишемический инсульт, гемоперикард, стеноз легочных вен, предсердно-пищеводная фистула) [15]. Кроме того, катетерная аблация является дорогостоящей процедурой, которая выполняется в узкоспециализированных отделениях. Таким образом, медикаментозная ААТ на сегодняшний день по-прежнему является основным способом «контроля ритма», и ситуация в ближайшие годы существенно не изменится.
В соответствии с актуальными клиническими рекомендациями Европейского общества кардиологов (2024 г.), Американской ассоциации сердца (2023 г.) и Министерства здравоохранения Российской Федерации (2020 г.) анти-аритмические препараты (ААП) IC класса являются основными средствами предупреждения рецидивов ФП у пациентов, не имеющих противопоказаний (главным образом, структурного заболевания сердца и нарушений проводимости) [11, 16, 17]. Препаратам класса IC следует отдавать предпочтение перед амиодароном по причине меньшей частоты внесердечных нежелательных эффектов, развивающихся при длительном применении [18]. Отечественный ААП III класса 4-Нитро-N-[(1RS)-1-(4-фторфенил)-2-(1-этилпиперидин-4-ил)этил] бензамида гидрохлорид продемонстрировал высокую эффективность при пароксизмальной и персистирующей формах ФП, однако в настоящее время препарат доступен только в инъекционной форме и показан исключительно для медикаментозной кардиоверсии, а не предупреждения рецидивов аритмии [19, 20].
Следует отметить, что клинических исследований по сравнению эффективности и безопасности различных ААП класса IC между собой не проводилось, поэтому выбор препарата для предупреждения рецидивов ФП в каж-дом случае следует проводить индивидуально, с учетом фармакологических свойств, сопутствующих заболеваний и данных анамнеза пациента о предшествовавших попытках назначения терапии, его эффективности и переносимости.
Пропафенон не только подавляет входящий ток ионов натрия, но и обладает слабовыраженными свойствами неселективного β-адреноблокатора. Благодаря β-адреноблокирующей активности менее вероятно значимое нарастание ЧСС на фоне сохранения ФП, поэтому препарат может быть использован как для предупреждения рецидивов аритмии, так и для купирования пароксизмов у пациентов, не получающих противорецидивной медикаментозной ААТ (внутривенное введение либо самостоятельный пероральный прием пациентом, так называемый подход «таблетка в кармане») [21]. В то же время за счет неселективной β-адреноблокирующей активности препарат может провоцировать бронхоспазм у пациентов с БА, что противопоказано у данной группы пациентов [6]. В представленном клиническом наблюдении у пациентки отсутствовали явные клинические проявления БА, однако после однократного приема пропафенона в стандартной дозе (150 мг) отмечено проявление бронхоспазма, выраженность которого потребовала отмены препарата и назначения бронходилатирующих средств. Отсутствие данной реакции на предшествовавшую попытку назначения β-адреноблокатора (метопролола сукцината в дозе 50 мг/сут) в амбулаторных условиях, возможно, было связано с более выраженной кардиоселективностью метопролола сукцината [22].
Диэтиламинопропионилэтоксикарбониламинофенотиазина гидрохлорид для лечения различных форм нарушений ритма сердца успешно применяется более 40 лет (с 1984 г.). Как и все ААП класса IC, он угнетает входящий быстрый ток ионов натрия. В меньшей степени препарат подавляет ток ионов кальция, а также оказывает умеренное холинолитическое действие. Препарат замедляет скорость проведения электрического импульса по предсердиям, проводящей системе (как по АВ-узлу, так и, в большей степени, системе Гиса — Пуркинье) и миокарду желудочков, а также по добавочным путям проведения. Под действием препарата в предсердиях, системе Гиса — Пуркинье и добавочных путях проведения также увеличивается длительность рефрактерных периодов [23]. Благодаря такому действию Этацизин проявляет активность в отношении как суправентрикулярных аритмий (прежде всего ФП, потенцируемой частой НЖЭ, что имело место у представленной пациентки К., так и при пароксизмальных наджелудочковых тахикардиях, в том числе у больных синдромом Вольфа — Паркинсона — Уайта), а также и желудочковых нарушений ритма сердца (подавляет желудочковую экстрасистолию и предупреждает пароксизмы желудочковой тахикардии). Препарат не проявляет гемодинамически значимого отрицательного инотропного действия, не снижает сердечный выброс. Также не оказывает влияния на тонус кровеносных сосудов, соответственно, не снижает артериальное давление. Кроме того, данный препарат не оказывает существенного влияния на функцию синусового узла, что является важным преимуществом препарата, позволяя применять его у пациентов, имеющих склонность к синусовой брадикардии. Благодаря умеренно выраженной холинолитической активности оказывается эффективным при вагус-зависимых нарушениях ритма сердца (характерны для спортсменов и физически тренированных пациентов) — частой НЖЭ и пароксизмах ФП, возникающих на фоне снижения ЧСС во время сна [24].
Фармакокинетические исследования показали, что всасывание препарата происходит достаточно быстро, существенно не зависит от приема пищи. Уже через 30 мин после приема внутрь препарат определяется в плазме крови. Максимальная концентрация достигается через 2–3 ч, а терапевтическая концентрация в плазме крови сохраняется в течение 6–8 ч, поэтому при назначении диэтиламинопропионилэтоксикарбониламинофенотиазина гидрохлорида необходимо использовать трехкратный прием препарата [25].
При назначении любого ААП на длительный прием обязательным условием является оценка безопасности проводимой терапии, что достигается посредством серийной регистрации ЭКГ на 1–2-е сутки приема и холтеровского мониторирования (целесообразно проводить на 3–4-е сутки приема препарата). У пациентов с частой экстрасистолией и рецидивирующим течением ФП данные методы также позволяют оценивать и эффективность проводимого лечения. На фоне приема Этацизина допустимо увеличение длительности интервала PQ до 300 мс (или до появления эпизодов АВ-блокады 2-й степени в комплексах СР в случае, если такое явление отмечается при меньшей продолжительности интервала PQ), а длительность комплекса QRS не должна увеличиваться более 25% от исходного значения (при этом в комплексах СР не должны регистрироваться полные блокады ножек пучка Гиса). Также не должно отмечаться эпизодов значимой брадикардии с ЧСС <50 в 1 мин в период бодрствования, которые на фоне приема этого препарата наиболее часто обусловлены преходящей СА-блокадой [26].
У представленной пациентки на фоне приема Этацизина в дозе 150 мг/сут отмечалось допустимое увеличение продолжительности интервала PQ (до 190 мс; см. рис. 1) без значимых нарушений внутрижелудочковой проводимости (увеличение продолжительности QRS до 108 мс; см. рис. 1). Контрольное холтеровское мониторирование показало не только безопасность проводимой терапии, но и подавление наджелудочковой эктопической активности, отсутствие пароксизмов ФП.
В случае, если у пациента имеются характерные жалобы и/или высокий риск ишемической болезни сердца (ИБС), перед назначением Этацизина целесообразно проведение пробы с дозированной физической нагрузкой (предпочтительно с эхокардиографическим контролем). Наличие факторов риска ИБС без подтвержденного инструментальными исследованиями диагноза не является противопоказанием к назначению Этацизина и не должно рассматриваться в качестве повода прекращения лечения у пациента, принимающего препарат длительное время.
Следует также отметить, что в последних версиях клинических рекомендаций по диагностике и лечению ФП большинства профессиональных сообществ все большее внимание уделяется контролю факторов риска ее возникновения, правильному ведению сердечно-сосудистых заболеваний и устранению провоцирующих аритмию воздействий (подход AF-CARE; см. выше). Важность такого подхода не вызывает никаких сомнений, поскольку эти действия не только положительно влияют на прогноз пациентов, но и эффективно предупреждают рецидивы ФП. В то же время ни одно из мероприятий не дает быстрого результата, требуются недели, а в ряде случаев месяцы для достижения положительного эффекта, и медикаментозная ААТ нередко оказывается средством, позволяющим выиграть это необходимое время [10, 11, 26].
На сегодняшний день имеются основания рассматривать БА как фактор, способствующий появлению ФП. Проведенное крупное популяционное исследование показало повышенный риск развития ФП у лиц с БА по сравнению с лицами без БА, причем отсутствие контроля БА повышало риск развития ФП на 81% [4]. Уровень контроля БА включает в себя наличие дневных и ночных симптомов, использование дополнительно короткодействующих препаратов, наличие обострений [6]. Отмечено, что пароксизмы ФП нередко провоцируются сопутствующими бронхолегочными заболеваниями, такими как БА, пневмония, хроническая обструктивная болезнь легких (ХОБЛ) [27, 28]. Так, в рассмотренном клиническом наблюдении БА ранее не была диагностирована и никакого контроля за ее течением не осуществлялось, а пароксизмы ФП у пациентки впервые возникли на фоне острого бронхита, т. е. активного воспалительного процесса.
Имеются сведения о том, что адекватное лечение заболеваний дыхательной системы может способствовать снижению количества НЖЭ и вероятности рецидивов ФП [29]. Однако применяемые в лечении БА и ХОБЛ бронходилатирующие препараты могут провоцировать возникновение аритмий и способствовать повышению ЧСС на фоне ФП за счет адреномиметического и холинолитического действия [30].
В представленном клиническом наблюдении слабо выраженной неселективной β-адреноблокирующей активности пропафенона оказалось достаточно, чтобы спровоцировать бронхоспазм у пациентки с ранее не диагностированной БА. У этой категории пациентов назначение Этацизина является предпочтительным, поскольку препарат не воздействует на адренорецепторы и обладает умеренно выраженной холинолитической активностью, а следовательно, не провоцирует бронхоспазмы, а, наоборот, оказывает дилатирующее действие [23].
Кроме того, наличие БА или ХОБЛ тяжелого течения ассоциировано с более высоким риском рецидива ФП после катетерной аблации легочных вен. По-видимому, это связано с более выраженным электрическим и структурным ремоделированием предсердий, которое у этих пациентов в большей степени может затрагивать правое предсердие, и появлением триггеров, локализованных вне легочных вен. Поэтому медикаментозная ААТ у пациентов с бронхолегочными заболеваниями может быть предпочтительным методом лечения [31].
Заключение
Высокая распространенность сердечно-сосудистых и бронхообструктивных заболеваний на практике вызывает значительные трудности в подборе терапии у пациентов с сочетанной патологией в связи с наличием общих звеньев патогенеза, негативным влиянием самих заболеваний друг на друга, возможным появлением нежелательных эффектов применяемых препаратов. Приведенный клинический пример демонстрирует, как недиагностированная БА может влиять на течение ФП, выбор безопасного ее лечения, а также иллюстрирует, что междисциплинарное ведение таких пациентов дает наилучшие результаты, позволяя достигать контролируемого течения бронхообструктивной патологии, эффективно и безопасно предупреждать рецидивы ФП с использованием ААП.
Сведения об авторах:
Миронов Николай Юрьевич — д.м.н., старший научный сотрудник отдела клинической электрофизиологии и рентгенохирургических методов лечения нарушений ритма сердца ФГБУ «НМИЦК им. ак. Е.И. Чазова» Минздрава России; 121552, Россия, г. Москва, ул. Академика Чазова, д. 15а; ORCID iD 0000-0002-6086-6784
Агапова Ольга Юрьевна — к.м.н., доцент кафедры факультетской терапии и профболезней НОИ клинической медицины им. Н.А. Семашко ФГБОУ ВО «Российский университет медицины» Минздрава России; 127006, Россия, г. Москва, ул. Долгоруковская, д. 4; ORCID iD 0000-0001-9480-8999
Контактная информация: Миронов Николай Юрьевич, e-mail: nikmir.7ko@gmail.com
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 09.07.2025.
Поступила после рецензирования 01.08.2025.
Принята в печать 26.08.2025.
About the authors:
Nikolai Yu. Mironov — Dr. Sc. (Med.), Senior Researcher of the Department of Clinical Electrophysiology and X-ray Surgical Methods for Cardiac Arrhythmia Treatment, Acad. E.I. Chazov National Medical Research Center of Cardiology; 15A, Academician Chazov str., Moscow, 121552, Russian Federation; ORCID iD 0000-0002-6086-6784
Olga Yu. Agapova — C. Sc. (Med.), Assistant Professor of the Department of Faculty Therapy and Occupational Diseases, N.A. Semashko Scientific Educational Institute of Clinical Medicine, Russian University of Medicine; 4, Dolgorukovskaya str., Moscow, 127006, Russian Federation; ORCID iD 0000-0001-9480-8999
Contact information: Nikolai Yu. Mironov, e-mail: nikmir.7ko@gmail.com
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 09.07.2025.
Revised 01.08.2025.
Accepted 26.08.2025.
[1] Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2024. Update May 2024. (Electronic resource.) URL: www.ginasthma.org (access date: 15.06.2025).
[2] Клинические рекомендации. Бронхиальная астма. 2021. (Электронный ресурс.) UPL: https://spulmo.ru/upload/kr/BA_2021.pdf (дата обращения: 18.12.2024).
Информация с rmj.ru