Содержание статьи
Введение
Гипофосфатазия (ГФФ) — редкое наследственное метаболическое заболевание, вызванное мутациями в гене ALPL, кодирующем активность фермента тканенеспецифической щелочной фосфатазы (ТНЩФ). Канадский врач J.C. Rathbun при описании пациента с крайне низким уровнем щелочной фосфатазы (ЩФ) впервые применил термин «гипофосфатазия» [1]. Клинические симптомы ГФФ неоднородны: от фатального перинатального варианта с выраженной гипоминерализацией скелета и дыхательной недостаточностью до постепенно прогрессирующего остеопороза у взрослых. На сегодняшний день общепринято выделять пять основных форм заболевания в зависимости от возраста появления первых симптомов: перинатальная, инфантильная, детская, взрослая, а также одонтогипофосфатазия [2].
Точная распространенность заболевания остается неизвестной и может варьировать в зависимости от популяции, метода оценки и формы ГФФ. Этническая группа с самым высоким уровнем заболеваемости ГФФ — это меннониты в Манитобе, Канада. Сообщается, что в этой популяции 1 из 25 человек несет мутацию ALPL и примерно у 1 из 2500 новорожденных имеется летальная форма ГФФ. Распространенность тяжелых форм ГФФ оценивается в 1 на 100 000 рождений в Канаде [3]. Молекулярное исследование показало, что частота тяжелых форм ГФФ в Европе составляет 1 на 300 000, но умеренные формы ГФФ, по результатам того же исследования, встречаются в 50 раз чаще [4]. Данные о распространенности в России отсутствуют, однако предполагаемая частота появления тяжелых форм —
1 на 100 000 новорожденных [5].
Этиология и патогенез ГФФ
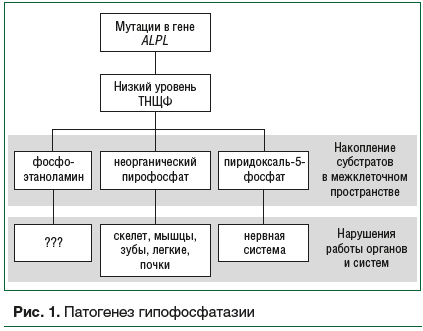
Этиология и патогенез ГФФ до настоящего времени остаются предметом исследований. Мутации в гене ALPL, также известном как TNSALP, картированном на 1 хромосоме (1p36.12), вызывают снижение активности ТНЩФ [6]. Тяжелые формы с ранним началом ГФФ с большей вероятностью будут иметь аутосомно-рецессивный тип наследования, тогда как формы с более поздним дебютом могут быть унаследованы как по аутосомно-рецессивному, так и по аутосомно-доминантному типу наследования [7]. В настоящее время описано не менее 411 мутаций гена ALPL [8],
каждая из которых может снижать активность ТНЩФ.
ТНЩФ играет прямую роль в механизме отщепления фосфатной группы от целого ряда субстратов [9]. При снижении активности ТНЩФ нарушается метаболизм неорганического пирофосфата, пиридоксаль-5-фосфата (витамин B6) и фосфоэтаноламина, происходит их внеклеточное накопление [10].
В норме ТНЩФ расщепляет неорганический пирофосфат до двух молекул фосфата, которые, связываясь с кальцием, формируют кристаллы гидроксиапатита, необходимые для минерализации костного матрикса и роста костной ткани [9]. Внеклеточное накопление неорганического пирофосфата блокирует формирование кристаллов гидроксиапатита [11–13], что препятствует нормальной минерализации костной ткани и приводит к скелетным деформациям. Кроме того, накопленный неорганический пирофосфат активно соединяется с ионами кальция и образует кристаллы пирофосфата кальция, который откладывается либо в почках, вызывая нефрокальциноз, либо в суставах, становясь причиной кристаллического артрита и псевдоподагры [14]. Аномалии формирования костей грудной клетки могут приводить к вторичной гипоплазии легких и, как следствие, к развитию дыхательной недостаточности у пациентов раннего возраста с ГФФ [15].
Известна важная роль витамина В6 в регуляции работы нервной системы, обусловленная его участием в метаболизме ряда нейротрансмиттеров. Для поступления витамина В6 в ЦНС необходимо отщепление фосфатной группы от пиридоксаль-5-фосфата (активная форма витамина B6). Катализатором отщепления фосфата является ТНЩФ. Образовавшийся пиридоксаль проникает через гематоэнцефалический барьер и после обратного присоединения фосфатной группы участвует в синтезе нейромедиаторов (в частности, ГАМК) [16]. При ГФФ нарушается процесс поступления витамина В6 в головной мозг, что обусловливает неврологические нарушения, например витамин В6-зависимые судороги [17].
Функция фосфоэтаноламина, еще одного соединения, которое аккумулируется при ГФФ, широко не исследовалась [18]. Его концентрация в моче может сильно повышаться при тяжелых формах ГФФ. Это естественный субстрат ТНЩФ, но он также может метаболизироваться другими путями. Фосфоэтаноламин был обнаружен в спинномозговой жидкости у пациента с перинатальной формой ГФФ, и ранее предполагалась связь между фосфоэтаноламином и эпилепсией [19]. Таким образом, роль ТНЩФ в патофизиологии головного мозга до конца не ясна и требует дальнейшего исследования, особенно в отношении некоторых плохо изученных симптомов ГФФ.
Патогенез ГФФ представлен на рисунке 1.
Клинические формы ГФФ
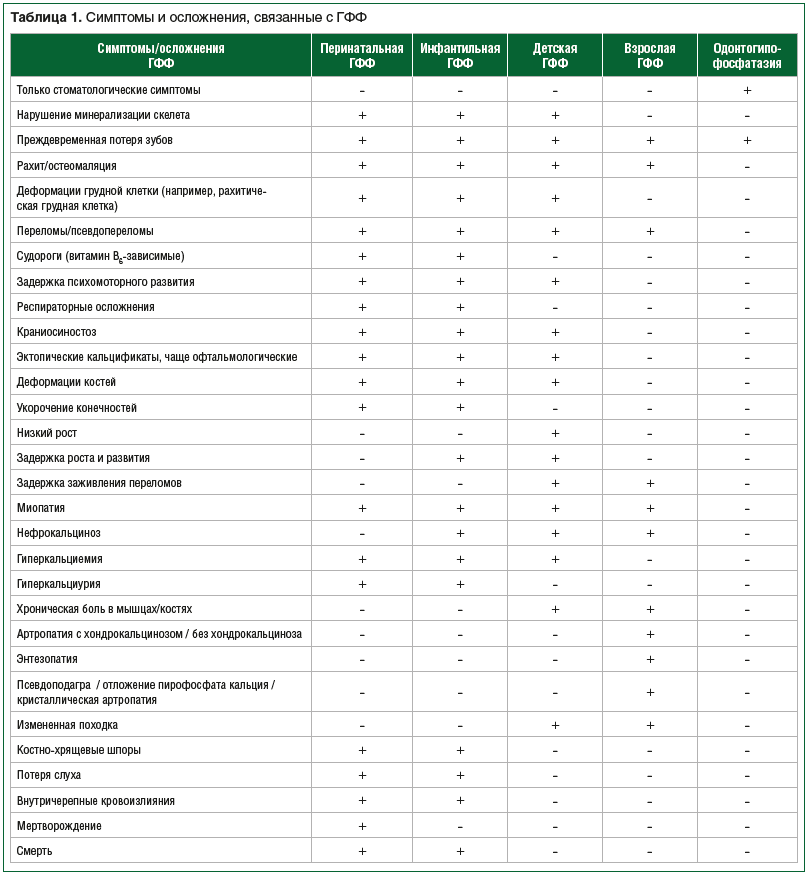
Тяжесть симптомов и возраст манифестации ГФФ определяются типом наследования и конкретными мутациями. Чем раньше возникает дефицит активности ТНЩФ, тем вероятно более фатальными могут быть последствия. Наиболее общепринятая классификация, которая базируется на возрасте появления первых симптомов заболевания, выделяет 4 клинические формы ГФФ: перинатальную (летальную), инфантильную, детскую и взрослую [2]. Перинатальная форма диагностируется внутриутробно (при ультразвуковом исследовании) или непосредственно при рождении, инфантильная форма — в первые дни после рождения до 6 мес. жизни, детская форма — от 6 мес. до 18 лет, взрослая форма — старше 18 лет. Также выделяют одонтогипофосфатазию, когда при отсутствии других симптомов заболевания регистрируют преждевременную потерю молочных или постоянных зубов [20]. Симптомы различаются в зависимости от возраста, но без лечения все пациенты с перинатальной (летальной) формой [21, 22], примерно половина пациентов с инфантильной формой [22] имеют плохой прогноз жизни. Для пациентов с другими формами ГФФ прогноз жизни благоприятен, однако без лечения они могут страдать от прогрессирующих клинических осложнений, часто приводящих к инвалидизации.
ГФФ — заболевание с разнообразными клиническими проявлениями. В таблице 1 представлены признаки, симптомы или осложнения, связанные с различными формами ГФФ, собранные из множества исследований [2, 23–25]. Широкий спектр симптомов отмечается со стороны не только костной системы, но и других органов и систем, таких как мышцы, суставы, органы дыхания, нервная система и почки, что может значительно влиять на физическое здоровье, качество жизни и прогноз для пациента.
Диагностика
ГФФ диагностируется на основании клинической картины, рентгенологических данных и результатов биохимических тестов. Дифференциальная диагностика должна проводиться с другими заболеваниями скелета, включая рахит, остеомаляцию и несовершенный остеогенез. Дефицит активности ТНЩФ является биохимическим маркером, позволяющим исключить другую скелетную патологию, при этом важно интерпретировать результат измерения ТНЩФ согласно референсным интервалам, учитывающим пол и возраст пациента (рис. 2) [10]. Также необходимо подтверждать стабильно низкую активность ТНЩФ в нескольких измерениях. Поскольку низкий уровень ТНЩФ помимо ГФФ может быть связан с многочисленными заболеваниями, такими как нарушение питания, дефицит цинка, синдром Кушинга, клейдокраниальная дисплазия и другие состояния, их исключение также важно. Дополнительные лабораторные тесты, подтверждающие диагноз, включают гиперкальциемию, гиперфосфатемию и гиперкальциурию, особенно при инфантильной и детской формах. Для окончательной диагностики ГФФ проводится тестирование гена ALPL.
![Рис. 2. Референсные интервалы активности ЩФ в зависимости от возраста и пола (адаптировано из [26]) Рис. 2. Референсные интервалы активности ЩФ в зависимости от возраста и пола (адаптировано из [26])](https://medblog.su/wp-content/uploads/2021/04/1617852845_825_gipofosfataziya-obzor-klinicheskih-sluchaev-opublikovannyh-v-rf-gurkina-e-yu-voinova-v-yu-kuzenkova-l-m-sosnina-i-b-vitebskaya-a-v-kostik-m-m-shatohina-n-s-chernyak-i-yu-hramova-e-b-romanenk.png)
Лечение
До недавнего времени лечение ГФФ было только симптоматическим и поддерживающим: гидратация, ограничение потребления кальция, в некоторых случаях — назначение тиазидных диуретиков при гиперкальциемии и гиперкальциурии; витамин В6 при судорогах; хирургические операции при скелетных деформациях; искусственная вентиляция легких для пациентов с дыхательными нарушениями; назначение анальгетиков при хронической боли; реабилитация, включающая физиотерапию и лечебную гимнастику [27]. Также лечить ГФФ пытались, применяя витамин D, бисфосфонаты, терипаратид и даже выполняя трансплантацию костного мозга, однако ни один из этих подходов не привел к положительному результату. Напротив, витамин D может усугубить гиперкальциемию или гиперкальциурию [28], а бисфосфонаты у пациентов с ГФФ угнетают процесс минерализации, ухудшая течение заболевания, и могут вызывать атипичные переломы бедренной кости [29].
В 2009 г. начались клинические испытания лекарственного препарата для заместительной ферментной терапии — асфотаза альфа. Молекула представляет собой человеческий рекомбинантный гибридный белок ЩФ, имеющий высокое сродство к кристаллам гидроксиапатита [30]. Терапевтическое действие реализуется через гидролиз неорганического пирофосфата, снижение накопления внеклеточных субстратов ТНЩФ, что улучшает минерализацию скелета. В пилотном клиническом исследовании у пациентов с инфантильной и детской формами ГФФ с тяжелым течением авторы продемонстрировали увеличение мышечной силы и улучшение процесса минерализации в течение нескольких недель после начала терапии, а также улучшение легочных, когнитивных и двигательных функций, выходящее за рамки первых нескольких недель лечения [30]. Результаты оригинального исследования эффективности и безопасности асфотазы альфа у младенцев с тех пор были подтверждены многочисленными независимыми исследованиями.
В настоящее время во многих странах препарат одобрен для заместительной ферментной терапии пациентов с ГФФ с началом в детском возрасте. Это контрастирует с лечением асфотазой альфа взрослых, относительно которого данных все еще недостаточно [18]. В 2019 г. лекарственный препарат асфотаза альфа зарегистрирован в Российской Федерации.
ГФФ в России
В 2020 г. в публикуемой в Российской Федерации медицинской литературе описаны 16 случаев постановки диагноза «гипофосфатазия» у детей.
Перинатальная форма
Описано 3 случая перинатальной формы ГФФ.
Первое описание верификации перинатальной формы ГФФ в отечественной практике сделано А.Е. Волковым с коллегами [31]. На 37-й неделе беременности у матери пациента наблюдалось выраженное снижение эхогенности костей свода черепа, его клеверообразная форма, венечные синостозы (рис. 3); укорочение деминерализованных конечностей, деминерализация позвоночника и ребер; гипоплазия колоколообразной грудной клетки. Ребенок родился в тяжелом состоянии (вес 1100, рост 38 см, по шкале Апгар 1/1), наблюдалась гиперкальциемия, гипофосфатемия, низкий уровень ТНЩФ — 19 ЕД/л (норма — 35–106 ЕД/л). Через 20 мин после рождения вследствие нарастающей дыхательной недостаточности ребенок умер. Генетическая верификация диагноза на тот момент не проводилась.
![Рис. 3. Ультразвуковое исследование при перинатальной форме ГФФ: А — деформация костей свода черепа под воздействием датчика, В — клеверообразная форма черепа из-за наличия венечных синостозов [31] Рис. 3. Ультразвуковое исследование при перинатальной форме ГФФ: А — деформация костей свода черепа под воздействием датчика, В — клеверообразная форма черепа из-за наличия венечных синостозов [31]](https://medblog.su/wp-content/uploads/2021/04/1617852845_329_gipofosfataziya-obzor-klinicheskih-sluchaev-opublikovannyh-v-rf-gurkina-e-yu-voinova-v-yu-kuzenkova-l-m-sosnina-i-b-vitebskaya-a-v-kostik-m-m-shatohina-n-s-chernyak-i-yu-hramova-e-b-romanenk.png)
Также описаны случаи перинатальной ГФФ у пациента О. [32] и пациента Ч. [33]. В обоих случаях постановка диагноза ГФФ была проведена в 1-й месяц жизни пациентов, подтверждена результатами генетического анализа и низкими показателями активности ТНЩФ. Еще внутри-утробно при УЗИ были обнаружены признаки нарушения развития скелета у плода. При рождении у пациентов наблюдались множественные скелетные диспропорции, укорочение, деформации и переломы конечностей, мягкие кости свода черепа продавливались, формируя «мембранозный» череп, грудная клетка была мягкой, уплощенной (рис. 4). Состояние ребенка О. после рождения оценивалось как более тяжелое, были выявлены мутации в гомозиготном состоянии, уровень ТНЩФ составлял 37 Ед/л (норма — 90–274 Ед/л) [32]. У ребенка Ч. выявлены две мутации в гетерозиготном состоянии, уровень ТНЩФ — 28 Ед/л (норма — 53–128 Ед/л). После верификации диагноза ГФФ обоим детям была назначена фермент-заместительная терапия асфотазой альфа.
![Рис. 4. Перинатальная форма ГФФ: А — рентгенограмма костей скелета и черепа пациента Ч. [33], В — рентгенограмма грудной клетки пациента О. [32] Рис. 4. Перинатальная форма ГФФ: А — рентгенограмма костей скелета и черепа пациента Ч. [33], В — рентгенограмма грудной клетки пациента О. [32]](https://medblog.su/wp-content/uploads/2021/04/1617852845_9_gipofosfataziya-obzor-klinicheskih-sluchaev-opublikovannyh-v-rf-gurkina-e-yu-voinova-v-yu-kuzenkova-l-m-sosnina-i-b-vitebskaya-a-v-kostik-m-m-shatohina-n-s-chernyak-i-yu-hramova-e-b-romanenk.png)
Перинатальная форма ГФФ диагностируется чаще всего без особых затруднений. Верификация диагноза основана на следующей симптоматике: множественные деформации скелета, гипоминерализация костей, переломы, пиридоксин-зависимые судороги, дыхательная недостаточность и гипоплазия легких при низких уровнях ТНЩФ и нормальных значениях паратгормона, витамина D, нормальном или повышенном уровне кальция в крови. Помимо УЗИ плода важной информацией являются положительный семейный анамнез и низкий уровень ТНЩФ в сыворотке крови у родителей. Следует отметить, что у женщин на поздних сроках беременности уровень ТНЩФ в сыворотке выше, чем вне беременности, из-за присутствия плацентарной ЩФ [34].
Инфантильная форма
Описано 4 случая инфантильной формы ГФФ в РФ: первый случай — в 2009 г. [35], в статьях 2016 г. и 2017 г. представлен второй случай [36, 37], третий — в 2017 г. [37], четвертый — в 2019 г. [38].
Все пациенты имели характерную для заболевания симптоматику: рахитоподобные изменения, варусную деформацию нижних конечностей, вальгусную деформацию стоп, «рахитические четки», «нити жемчуга», «рахитические браслетки», воронкообразную грудную клетку, снижение мышечного тонуса, недостаточную прибавку массы тела (рис. 5А). В 2 случаях наблюдалось выпадение молочных зубов [35, 38]. Структурные изменения в почках были выявлены у 2 детей [36, 37]. На рентгенограммах наблюдались различные деструктивные изменения костной структуры: резкое истончение коркового слоя, неровность контуров, множественные участки просветлений (гипоминерализации) метадиафизов длинных трубчатых костей (рис. 5В), с характерными для ГФФ «изъеденными» контурами («языками пламени»), укорочения диафизов костей, расширение эпифизов с мягкотканной плотностью.
![Рис. 5. Инфантильная ГФФ: А — внешний вид ребенка, В — рентгенограмма трубчатых костей [35] Рис. 5. Инфантильная ГФФ: А — внешний вид ребенка, В — рентгенограмма трубчатых костей [35]](https://medblog.su/wp-content/uploads/2021/04/1617852845_91_gipofosfataziya-obzor-klinicheskih-sluchaev-opublikovannyh-v-rf-gurkina-e-yu-voinova-v-yu-kuzenkova-l-m-sosnina-i-b-vitebskaya-a-v-kostik-m-m-shatohina-n-s-chernyak-i-yu-hramova-e-b-romanenk.png)
Биохимические исследования показали, что у всех детей уровень ТНЩФ был значительно понижен. В 2 случаях при обращении пациентов в поликлиники по месту жительства лабораторные анализы проводились неоднократно, однако низкие значения уровня ТНЩФ были проигнорированы и поставлены неверные диагнозы, что привело к назначению в качестве лечения высоких доз витамина D, что в ряде случаев ухудшает течение заболевания [35, 37].
В 3 случаях диагноз был верифицирован генетически. У 2 пациентов были выявлены гетерозиготные мутации гена ALPL [35, 38], у 1 ребенка была обнаружена ранее не описанная гомозиготная мутация C497R [36, 37].
Фермент-заместительная терапия асфотазой альфа была назначена 2 пациентам [36–38]. В работе Е.C. Отрощенко и соавт. не сообщается о терапии асфотазой альфа ввиду отсутствия на тот момент данного препарата [35].
Ребенок К. с рождения наблюдался амбулаторно в связи с перинатальной патологией ЦНС, гипертензионно-гидроцефальным синдромом. В дальнейшем состояние ребенка ухудшалось, пациент умер в возрасте 1 года 4 мес. от прогрессирующей дыхательной и сердечно-сосудистой недостаточности [37].
С учетом того, что при инфантильной форме ГФФ дебют заболевания происходит до 6 мес., в 3 описанных случаях наблюдается довольно поздняя постановка диагноза, несмотря на типичную симптоматику.
Детская форма
В медицинской литературе в РФ описано 9 пациентов с детской формой ГФФ. Симптомы, которые встречались почти у всех пациентов с детской формой, включали задержку роста и развития, гипотонию, нарушение походки («утиная походка»), быструю утомляемость [32, 33, 36, 39–42]. По данным рентгенографии определялись размытые зоны минерализации и участки разрежения костной ткани в виде «языков пламени» в расширенных метафизах костей. У 2 пациентов была отмечена деформация черепа [32, 33]. Встречались выраженная варусная деформация бедер, вальгусная деформация коленных суставов [33, 36]. У 5 детей в анамнезе выявлялось раннее выпадение молочных зубов [33, 39, 41], что является важным диагностическим критерием при постановке диагноза ГФФ, однако только в 1 случае данный симптом был адекватно оценен и привел к назначению дополнительных обследований и постановке правильного диагноза в возрасте 1 года [33].
У всех пациентов были определены низкие значения ТНЩФ, причем у некоторых пациентов впервые анализ был проведен в довольно позднем возрасте, например у мальчика П. [32] снижение активности ТНЩФ было впервые зарегистрировано только в 6 лет.
В некоторых случаях были установлены неверные диагнозы (рахит, соматогенная задержка роста), назначена терапия витамином D, которая ухудшала течение заболевания [33, 40]. Мальчику Р. при обращении к стоматологу был поставлен диагноз «генерализованный пародонтит тяжелой степени» [33].
Во всех описанных случаях была проведена молекулярно-генетическая верификация диагноза ГФФ. Характерно, что все мутации гена ALPL находятся в гетерозиготном состоянии.
Шести пациентам из данной группы назначена фермент-заместительная терапия препаратом асфотаза альфа в дозе 2 мг на 1 кг массы тела 3 раза в неделю, а 1 пациенту в возрасте 18 лет —в дозе 70 мг/сут 6 раз в неделю [40].
В 1 случае отмечается, что вопрос о назначении фермент-заместительной терапии будет решаться при ухудшении состояния в динамике [33]. У всех пациентов с детской формой после постановки диагноза прогноз жизни благоприятный. На фоне терапии асфотазой альфа у всех пациентов наблюдалось улучшение состояния, значительное ускорение темпов роста, повышение мышечной силы и толерантности к физическим нагрузкам.
Обсуждение
Анализ описанных в отечественных медицинских журналах случаев ГФФ показал, что в силу разных причин (полиморф-ность клинических симптомов, ошибки при определении и интерпретации результатов измерения ЩФ, недостаточная осведомленность врачей о ГФФ) наблюдались сложности в своевременной постановке правильного диагноза. Клинические проявления ГФФ разнообразны и затрагивают многие органы и системы, в связи с чем пациенты могут наблюдаться у специалистов самого разного профиля.
Из-за схожих костных проявлений ГФФ пациентам ошибочно были установлены диагнозы более распространенных заболеваний, таких как рахит, несовершенный остеогенез, остеопороз, задержка роста, заболевания пародонта и др. Неверный диагноз может ухудшить прогноз по двум причинам: отсроченное лечение и противопоказания. Во всех описанных случаях в результатах биохимических анализов наблюдались низкие значения активности фермента ТНЩФ, что является главным характерным признаком ГФФ. Однако в большинстве случаев эти данные были проигнорированы многими специалистами, особенно при первичном обращении за медицинской помощью в поликлиниках по месту жительства.
В описанных случаях из отечественной практики мы наблюдаем задержку диагностики: у пациентов с детской формой ГФФ симптомы заболевания проявлялись уже в раннем возрасте, однако диагноз в большинстве случаев был поставлен гораздо позже — в 3–4 года, 6 лет и даже в 15 лет. Глобальное проспективное исследование показало, что у пациентов с ГФФ часто происходит задержка диагностики на 12 и более месяцев у детей и примерно на 10 лет у взрослых. Таким образом, подобные результаты отражают глобальную ограниченную осведомленность о болезни [43]. Тем не менее за 11 лет с первого описания случая ГФФ в РФ [31] наблюдается положительная динамика в своевременной постановке верного диагноза. Интересен опыт ретроспективной диагностики ГФФ, когда при проверке лабораторной базы данных выявлялись низкие значения ТНЩФ, а далее анализировались клинические симптомы и при подозрении на ГФФ образцы крови направлялись на генетическое исследование. Используя этот подход, авторы выявили
3 пациентов с ГФФ [42].
Генетическая верификация была проведена в большинстве описанных случаев ГФФ в РФ. Стоит отметить, что в редких случаях при ГФФ мутации в гене ALPL не обнаруживаются, поэтому для постановки диагноза ведущим является сочетание клинических симптомов заболевания, характерных рентгенологических признаков и снижения активности ТНЩФ ниже нормы [44]. Ключом к диагностике в каждом случае является измерение и соответствующая интерпретация активности ТНЩФ в сыворотке крови. Активность фермента существенно меняется с возрастом, и у детей она значительно выше, чем у взрослых. Таким образом, для правильной интерпретации анализа активности ТНЩФ решающее значение имеет применение референсных показателей с учетом возраста и пола для каждого пациента.
Ранняя диагностика ГФФ имеет существенное значение в связи с появлением фермент-заместительной терапии асфотазой альфа. С учетом прогрессирующего характера врожденного заболевания раннее начало лечения означает лучший прогноз с точки зрения развития осложнений и инвалидизации детей, а для пациентов с тяжелыми ранними формами (перинатальной и инфантильной) вовремя поставленный диагноз может определять прогноз для жизни ребенка.
Заключение
Анализ случаев заболевания ГФФ, описанных к настоящему времени в российских медицинских научных журналах, позволяет рекомендовать практикующим специалистам при наличии у пациента любой костной патологии с рахитоподобными проявлениями проводить обязательную оценку уровня ТНЩФ как основополагающего лабораторного теста для подтверждения диагноза ГФФ. При интерпретации результатов измерения ЩФ крайне важно использовать референсные диапазоны с учетом пола и возраста пациента.
Благодарность
Авторы благодарят группу MAG (Medical Adviser’s Group) в лице Елены Якимовой за помощь в подготовке рукописи при финансовой поддержке ООО «Свикс Биофарма».
.
Информация с rmj.ru






