Эффективность комбинированной противовирусной терапии препаратами интерферона у детей с хроническим гепатитом С по сравнению с монотерапией
Введение
Несмотря на успехи, достигнутые в области вирусологии, диагностики, лечения хронического гепатита С (ХГС), сохраняются трудности, не позволяющие управлять HCV-инфекцией. Лечение ХГС переживает революцию в связи с разработкой нового класса лекарственных средств — противовирусных препаратов прямого действия, которые обеспечивают высокие показатели эффективности и меньшее количество побочных эффектов, чем известные схемы лечения с включением препаратов интерферона (ИФН) [1–3]. Применение противовирусных препаратов прямого действия одобрено только для детей в возрасте старше 12 лет в России, США и Европе. Для детей в возрасте младше 12 лет рекомендована тактика выжидания, но при нарастании синдрома цитолиза и прогрессии фиброза печени для лечения рекомендовано использовать комбинацию Пэгинтерферона альфа-2b и рибавирина [4]. В связи с вероятностью спонтанной элиминации вируса гепатита С (HCV) и высоким риском возникновения побочных эффектов противовирусная терапия (ПВТ) препаратами ИФН у детей до 3 лет не проводится [4–8].
Цель исследования: оценить эффективность противовирусной терапии препаратами ИФН ХГС у детей.
Содержание статьи
Материал и методы
Проведено ретро- и проспективное исследование, в котором обобщены результаты ПВТ в период с 2009 по 2018 г. В исследование включены данные 173 детей с установленным диагнозом ХГС (94 мальчика и 79 девочек) в возрасте от 3 до 17 лет, медиана возраста составила 9 [5; 13] лет. Диагноз устанавливали на основании выявления антител к HCV и РНК HCV в сыворотке крови двукратно с интервалом не менее 6 мес. Исследование являлось открытым, ретро- и проспективным, одобрено локальным комитетом по этике ФГБУН «ФИЦ питания и биотехнологии» и соответствует принципам, изложенным в Хельсинкской декларации «Этические принципы проведения медицинских исследований c участием человека в качестве субъекта исследования» [9]. Информированное согласие получено от всех пациентов и/или их законных представителей.
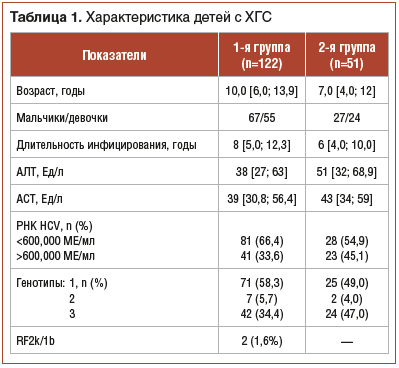
В зависимости от типа ПВТ пациенты были распределены в 2 группы. В исследовании сравнивали 2 использующиеся в реальной клинической практике схемы лечения ХГС. В 1-ю группу включено 122 ребенка с ХГС, получавших курс комбинированной ПВТ (Пэгинтерферон альфа-2b в дозе 60 мкг/м2 площади поверхности тела 1 раз в неделю и рибавирин в дозе 15 мг/кг/сут ежедневно). Количество мальчиков преобладало над количеством девочек (55 против 45%). Медиана возраста пациентов 1-й группы составила 10 [6; 13,9] лет (табл. 1). Предполагаемая длительность инфицирования HCV до начала лечения составила 8 [5,0; 12,3] лет. У 58,2% детей ХГС был ассоциирован с инфицированием генотипом 1 HCV, у 5,7% — с генотипом 2, у 34,4% — с инфицированием генотипом 3. У 2 (1,6%) детей обнаружен межгенотипный рекомбинантный вариант RF2k/1b. Длительность ПВТ при инфицировании генотипом 1 (G1) и RF2k/1b составляла 48 нед., при 2 и 3 генотипах (G2, 3) — 24 нед. У 70% детей установлен естественный (вертикальный) путь передачи инфекции, у 16% — искусственный (медицинские манипуляции), в т. ч. переливания крови у 6%, операции и различные стоматологические манипуляции — у 10%. У 14% детей путь инфицирования неизвестен.
У подавляющего большинства детей естественное течение HCV-инфекции характеризовалось отсутствием или минимальным повышением уровня трансаминаз. Так, до начала ПВТ нормальный уровень АЛТ и АСТ был у 50% детей, а минимальное повышение (1,5–2,0 нормы) — у 37% детей. Низкий уровень цитолиза (2–5 норм) наблюдался у 12% пациентов, умеренный (5–10 норм) — у 0,8% детей. При оценке количественного содержания РНК HCV до начала лечения выявлено преобладание низкой концентрации HCV (менее 1×106 МЕ/мл). Лишь у 1 пациента по данным непрямой эластометрии выявлена степень фиброза F4 по шкале METAVIR, что было обусловлено сочетанной патологией — ХГС и ангиоматозом ствола воротной вены. У остальных пациентов плотность ткани печени составляла F0–F1 по METAVIR.
Во 2-ю группу включен 51 ребенок с ХГС, получавший монотерапию Интерфероном альфа-2а для подкожного введения в дозе 3 млн МЕ 3 раза в неделю на протяжении 48 нед. вне зависимости от генотипа HCV. Число мальчиков незначительно превышало число девочек (табл. 1). Медиана возраста пациентов составила 7 [4,0; 12,0] лет, длительности инфицирования — 6 [4,0; 10,0] лет. Частота инфицирования различными генотипами вируса практически не отличалась от таковой в 1-й группе. Генотип 1 HCV обнаружен у 49%, генотип 2 — у 4%, генотип 3 — у 47% пациентов. Так же, как и у пациентов 1-й группы, вертикальный путь инфицирования был наиболее частым — у 68,6% детей, медицинские манипуляции послужили причиной инфицирования 13,6% пациентов, в т. ч. переливания крови — у 11,7%, стоматологические манипуляции — у 1,9% детей. У 17,6% детей путь инфицирования не удалось установить. Естественное течение HCV-инфекции у пациентов 2-й группы также характеризовалось отсутствием или минимальным повышением уровня трансаминаз: до начала ПВТ нормальный уровень печеночных трансаминаз был у 31,4% пациентов, минимальное повышение — у 49%. Низкий уровень цитолиза выявлен у 13,7%, умеренный — у 5,9% пациентов. Высокая и низкая концентрация HCV выявлена у одинакового количества пациентов. Плотность печени по данным непрямой эластометрии составила F0–F1 по METAVIR.
Все дети имели показания и не имели противопоказаний к проведению ПВТ. До старта терапии проводилось лабораторно-инструментальное обследование (клинический анализ крови, биохимический анализ крови, ПЦР РНК HCV, тиреоидный профиль, ЭКГ, непрямая эластография печени). Контроль эффективности и безопасности ПВТ проводился на 4, 12, 24, 36 и 48-й нед. терапии и с 24-й по 48-ю нед. по окончании лечения.
Клиническое исследование периферической крови с определением гемоглобина, подсчетом форменных элементов и скорости оседания эритроцитов выполняли на гематологическом анализаторе Beckman Coulter LH 750, США. Биохимический анализ крови проводился с помощью тест-системы фирмы Vital Development Corporation (Россия) на анализаторе KONELAB Prime 60i (Thermo Scientific, Финляндия). Количественное содержание РНК HCV определяли методом ПЦР с помощью тест-системы «ОТ-гепатоген-С-количественный» («ДНК-технология», Россия).
Эффективность ПВТ оценивалась по следующим показателям: нормализация печеночных трансаминаз и достижение устойчивого вирусологического ответа (УВО) спустя 24 нед. после окончания ПВТ [4, 10, 11]. Ответ на ПВТ оценивался по следующим критериям [12–16]:
быстрый вирусологический ответ (БВО) — элиминация вируса на 4-й нед. лечения;
ранний вирусологический ответ (РВО) — элиминация вируса на 12-й нед. терапии;
первичная вирусологическая ремиссия — отсутствие РНК HCV в сыворотке крови в ходе лечения и на момент окончания ПВТ.
Неэффективность ПВТ оценивалась по следующим показателям [12–16]:
вирусологический прорыв — повторное появление РНК HCV во время терапии;
рецидив — повторное появление РНК HCV после прекращения терапии;
отсутствие ответа на ПВТ — снижение РНК HCV менее чем на 2 log10 к 12-й нед. лечения.
Безопасность лечения оценивали на основании мониторинга клинических и лабораторных нежелательных эффектов (НЭ). Степень тяжести НЭ оценивали в соответствии с Общими терминологическими критериями нежелательных явлений Национального института рака (NCI CTCAE, версия 4) [17]. Отмена терапии проводилась при выраженности НЭ III степени.
Статистическая обработка данных выполнена с помощью электронных таблиц Microsoft Excel и пакета прикладных программ Statistica for Windows v. 10.0, Stat Soft Inc. (США). Полученные данные имели распределение, отличное от нормального, в связи с чем они описывались в виде медианы, 25-го и 75-го перцентилей — Ме (Q1; Q3). Для оценки статистической значимости различий между группами до и после лечения применялся критерий Вилкоксона. Уровень статистической значимости был принят как достаточный при p<0,05.
Результаты исследования
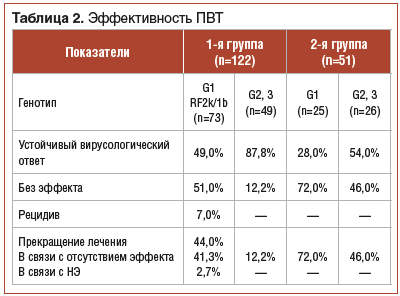
Исследование эффективности комбинированной ПВТ показало, что УВО достигнут у 63% детей, получавших лечение. При инфицировании G1 и RF2k/1b УВО достигнут у 49% детей, у 87,8% пациентов с G2 и 3 (табл. 2). БВО зарегистрирован у 31,5% детей с G1, RF2k/1b и у 81,6% пациентов с G2 и 3 (р<0,001). Достижение РВО выявлено у 24,7% с G1, RF2k/1b и у 6,1% с G2 и 3. Первичная вирусологическая ремиссия диагностирована у 57,7% детей с G1, у 85,7% пациентов с G2, у 88% детей с G3, у 1% — с RF2k/1b. У 4% детей, инфицированных G1, зафиксирован рецидив. У 14% пациентов с G1 и у 4% детей, инфицированных G3, наблюдался вирусологический прорыв на разных сроках лечения, вследствие чего ПВТ была прекращена.
При оценке динамики АЛТ на фоне ПВТ выявлено достоверное снижение уровня цитолиза уже на 4-й нед. лечения: нормализация АЛТ отмечена у 72% детей, инфицированных G1, RF2k/1b, и у 61% пациентов с G2 и 3 (p<0,001). На 24-й нед. терапии нормальный уровень печеночных трансаминаз определялся у 85,5% детей с G1, RF2k/1b. На момент завершения терапии (24-я нед.) у 97,9% пациентов с G2 и 3 определялся нормальный уровень трансаминаз. На 48-й нед. ПВТ у 92,1% детей с G1, RF2k/1b был нормальный уровень АЛТ. У всех детей с сохраняющимся повышенным уровнем трансаминаз не произошло элиминации HCV. УВО достигнут у 33% детей с исходно нормальным уровнем АЛТ и у 25% детей с исходно повышенной концентрацией АЛТ (p>0,05). Таким образом, наличие синдрома цитолиза не является предиктором эффективности терапии ИФН.
У всех (100%) детей отмечались нежелательные эффекты (НЭ) лечения разной степени выраженности (табл. 3). Прекращена терапия вследствие НЭ (III степень по шкале NCI CTCAE, версия 4) у 2 (2%) детей. Повышение температуры тела (от 37,5 С° до 40,5 °C) у 100% детей после введения препарата ИФН наблюдалось в течение 1–2 дней на протяжении первых 4–6 инъекций. Астеновегетативный синдром, выражающийся в виде появления слабости, быстрой утомляемости, отмечался у 72% пациентов. Миалгии/артралгии выявлены у 27,9% детей. Головная боль после инъекции препаратов ИФН зарегистрирована у 30,3%. На фоне проводимого лечения снижение массы тела отмечалось у 87,7% детей. Психоневрологические нежелательные эффекты (раздражительность, лабильность настроения, агрессия) отмечались у 14,8% детей. Из редких побочных эффектов (менее 14%) отмечались рвота, выпадение волос, обострение атопического дерматита, носовые кровотечения, патология со стороны щитовидной железы, AV-блокада I степени.
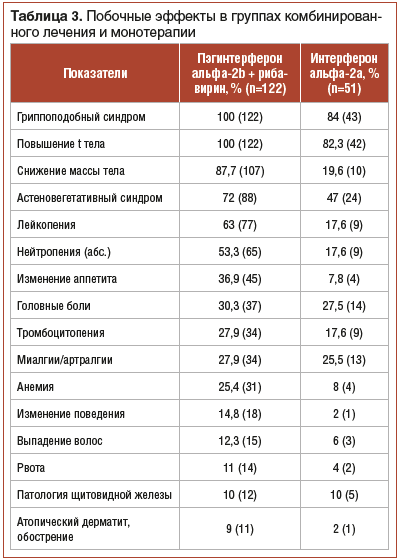
Лейкопения (уровень лейкоцитов 1,5–3,9×109/л) была выявлена у 63% пациентов. Абсолютная нейтропения (0,3–1,0×109/л) диагностирована у 53,3% детей. Анемия выявлена у 25,4% детей, тромбоцитопения (<150×109/л) — у 28% детей. Введения стимуляторов лейкопоэза не потребовалось ни в одном случае.
При катамнестическом обследовании спустя 24 нед. после окончания терапии у всех детей зарегистрирована нормализация показателей клинического анализа крови, спустя 48 нед. после завершения ПВТ — нормализация антропометрических показателей.
При оценке эффективности монотерапии Интерфероном альфа-2а установлено, что УВО достигнут у 41% детей: у 28% пациентов, инфицированных G1, и у 54% пациентов, инфицированных G2 и 3 (табл. 2). БВО выявлен у 24% с G1 и у 50% с G2, 3. РВО зарегистрирован у 8% с G1 и у 11,5% с G2, 3. Первичная вирусологическая ремиссия зафиксирована у 32% детей с G1 и у 54% пациентов с G2, 3. Вирусологический прорыв отмечен у 20% пациентов с G1 и у 19,2% детей с G2, 3 на разных сроках ПВТ.
На 4-й нед. ПВТ нормализация АЛТ отмечена у 41% детей, инфицированных G1, и у 91% — с G2 и 3. На 24-й нед. терапии нормальный уровень печеночных трансаминаз определялся у 53% детей с G1 и у 71% — с G 2, 3; на 48-й нед. — у 70 и 86% детей, инфицированных G1 и G2, 3 соответственно. У остальных пациентов сохранялся цитолиз до 3 норм.
У всех пациентов, получавших монотерапию препаратом ИФН, отмечались НЭ терапии, но они были менее выражены, чем при проведении комбинированной ПВТ (табл. 3). Ни у кого из пациентов в связи с НЭ терапию не отменяли. Гриппоподобный синдром встречался у 84% детей. Повышение температуры тела (от 37,5 °C до 40,5 °C) отмечено у 82,3% детей, астеновегетативный синдром — у 47% детей. Миалгии/артралгии выявлены у 25,5% пациентов. Головная боль после инъекции ИФН зарегистрирована у 27,5% детей. Снижение массы тела — у 19,6% пациентов. Редкие побочные эффекты (менее 10%): выпадение волос, атопический дерматит, агрессивность поведения, патология щитовидной железы. При мониторинге клинического анализа крови признаки лейкопении, абсолютной нейтропении, тромбоцитопении диагностированы у 17,6% детей, анемия обнаружена у 8% пациентов. Введения стимуляторов лейкопоэза не потребовалось. При катамнестическом обследовании через 24 нед. после окончания ПВТ — отсутствие жалоб, нормализация показателей крови и массы тела.
Эффективность комбинированной ПВТ превосходит эффективность монотерапии Интерфероном альфа-2а и по частоте достижения УВО, и по нормализации уровня печеночных трансаминаз. Частота возникновения НЭ выше при проведении комбинированной ПВТ, но катамнестическое обследование спустя 24 и 48 нед. после окончания ПВТ у детей продемонстрировало отсутствие жалоб и нормализацию антропометрических показателей и показателей клинического анализа крови.
Обсуждение результатов
В нашем исследовании результаты эффективности комбинированной ПВТ продемонстрировали достижение УВО у 63% детей, эффективность при инфицировании G2 и 3 составила 87,8%, а при G1 и RF2k/1b — 49%. Кроме генотипа вируса основными предикторами успешности ПВТ были БВО и РВО. Синдром цитолиза не является предиктором эффективности терапии ИФН. Прекращение терапии вследствие неэффективности проведено у 52,2% детей, частота рецидивов составила 7%. Результаты исследования эффективности комбинированной схемы ПВТ в работе Wirth et al. (2010) показали, что УВО достигли 70 (65%) детей. Генотип HCV был основным предиктором ответа: при G1 — 53%; G2, 3 — 93%; G4 — 80%. Базовая вирусная нагрузка была основным предиктором ответа в когорте G1 [18]. В метаанализе Indolfi et al. (2018) обобщены данные 11 различных исследований эффективности комбинированной схемы ПВТ у детей с ХГС. В целом эффективность данного лечения была выше у детей, инфицированных генотипами HCV 2 и 3 (90%), чем у детей, инфицированных G1 (48%). У всех детей с УВО исходно была повышенная активность печеночных трансаминаз, а исходная вирусная нагрузка была низкой. Частота рецидивов, не зависящая от генотипа и продолжительности лечения, составила 6%. Прекращение лечения отмечалось вследствие неэффективности у 17% детей [4].
В нашем исследовании у всех пациентов, получавших курс комбинированной ПВТ, были НЭ разной степени выраженности. Чаще всего встречались: гриппоподобный синдром, повышение температуры тела, астеновегетативный синдром, снижение массы тела, лейкопения и нейтропения. Отмена терапии вследствие побочных эффектов проведена у 2,7% детей. В работе Wirth et al. (2010) НЭ были в основном легкой или средней степени тяжести. Доза была изменена из-за НЭ у 25% детей; у 2% детей лечение прекращено из-за тромбоцитопении [18]. В работе Pawlowska et al. (2010) показано, что среди побочных эффектов чаще регистрировался гриппоподобный синдром (66%), лейкопения (64,2%), лихорадка (50%), терапия из-за серьезных побочных эффектов ни у кого не прекращалась [19]. В исследовании Jara et al. (2008) терапия была прекращена у 10% пациентов в результате побочных эффектов [20]. Доза Пэгинтерферона альфа-2b была снижена у 23% пациентов вследствие нейтропении.
Оценка эффективности монотерапии Интерфероном альфа-2а в нашем исследовании показала, что УВО достигнут у 41% детей: у 28% пациентов, инфицированных G1, и у 54% пациентов, инфицированных G2 и 3. У 43% детей произошел вирусологический прорыв. Достижение БВО и РВО были основными предикторами успешности терапии. В работе Каганова и соавт. (2005) эффективность монотерапии Интерфероном альфа-2а составила 31,6% (6/19) без разделения на генотипы, курс лечения составил 24 нед. У 50% детей произошел рецидив [21].
Побочные эффекты терапии Интерфероном альфа-2а в нашем исследовании были у всех детей, но они были менее выражены, чем при проведении комбинированной ПВТ. Чаще всего регистрировались: гриппоподобный синдром (84%), повышение температуры тела (82,3%), астеновегетативный синдром (47%). Ни у кого из пациентов в связи с НЭ терапия не отменялась. В работе Каганова и соавт. (2005) побочные эффекты терапии Интерфероном альфа-2а включали гипертермию (100%), гриппоподобный синдром (40,0%), астенический синдром (50,0%), снижение в крови уровня тромбоцитов (50,0%) и лейкоцитов (40,0%), отмена терапии проведена у 1 пациента в связи с развитием атриовентрикулярной блокады III степени [21].
Наши данные согласуются с результатами крупных рандомизированных контролируемых клинических исследований, в которых изучалась эффективность комбинированной ПВТ. Для детей младше 12 лет, инфицированных HCV, в настоящее время отсутствует возможность лечения без препаратов ИФН. При принятии решения о начале терапии необходимо учитывать генотип HCV, степень фиброза печени (по результатам непрямой эластометрии), возможности побочных эффектов, вероятности ответа и наличия сопутствующих заболеваний. Учитывая высокий процент эффективности комбинированной ПВТ у детей, инфицированных 2 или 3 генотипами, мы рекомендуем проведение лечения препаратами Пэгинтерферона альфа-2b и рибавирина для детей младше 12 лет, инфицированных вирусом этих генотипов.
Заключение
В нашем исследовании получены результаты, сопоставимые с зарубежными данными об эффективности и безопасности применения ПВТ препаратами ИФН. С учетом низкой эффективности монотерапии Интерфероном альфа-2а нецелесообразно ее применение в качестве выбора терапии ХГС. Мы рекомендуем использовать комбинированную ПВТ у пациентов, инфицированных генотипами 2 и 3, при наличии высокой активности фиброза печени и отсутствии возможности использования лекарственных средств прямой противовирусной активности. У этих пациентов обязательно должны быть исключены межгенотипные рекомбинантные варианты ХГС и сопутствующая патология печени.
Информация с rmj.ru




