Введение
Антикоагулянты играют важную роль в снижении заболеваемости и смертности, связанных с тромбоэмболическими заболеваниями, такими как тромбоз глубоких вен, тромбоэмболия легочной артерии (ТЭЛА), инсульт и инфаркт миокарда. ТЭЛА как причина летального исхода занимает третье место в структуре смертности от сердечно-сосудистых заболеваний. Согласно расчетам это осложнение ежегодно является причиной смерти около 3 млн пациентов по всему миру. Согласно нескольким исследованиям в европейских странах летальность от венозных тромбоэмболических осложнений (ТЭО) составляет более 370 тыс. человек. Кроме того, до 14% пациентов с проксимальным тромбозом и до 17,5% с ТЭЛА погибают в течение 3 мес. от первого эпизода тромбоза. Отсутствие профилактики ТЭО у пациентов ортопедического профиля сопряжено с высоким риском тромботических осложнений, достигающих, по данным различных авторов, 85%. Кроме того, все пациенты, когда-либо перенесшие флеботромбоз, имеют высокий риск повторных венозных ТЭО, частота которых достигает 30% в течение последующих 30 лет [1]. Хотя доступные в настоящее время антикоагулянты доказали свою эффективность в лечении и профилактике тромбоэмболических заболеваний, им не хватает оптимальных характеристик для длительного применения пациентами [2].
Фактор Ха — это фактор свертывания, который действует в точке конвергенции внутренних и внешних путей свертывания крови [3]. Он катализирует расщепление протромбина и, следовательно, имеет решающее значение для выработки тромбина [4]. Непрямые ингибиторы фактора Ха, такие как фондапаринукс натрия и биотинилированный идрапарин (не зарегистрирован в России), оказывают свое антитромбическое действие путем связывания с антитромбином; следовательно, их эффективность зависит от уровня циркулирующего антитромбина. Они являются парентеральными препаратами, и их нельзя применять перорально [5].
Ривароксабан является первым прямым ингибитором фактора Ха, который был лицензирован для профилактики венозной тромбоэмболии (ВТЭ) у взрослых пациентов после планового эндопротезирования тазобедренного или коленного сустава[1].
Ривароксабан ингибирует фактор Ха в зависимости от концентрации (константа ингибирования (Ki) 0,4 нмоль/л) и является конкурентным ингибитором амидолитической активности фактора Ха [6]. Он характеризуется быстрым началом действия (константа кинетической скорости ассоциации (kon), 1,71×107 моль/л за 1 с) и обратимостью эффекта (кинетическая константа скорости диссоциации (koff), 5×10-3 за 1 с) [7]. Ривароксабан ингибирует связывание с протромбиназой (половина максимальной ингибирующей концентрации (IC50) 2,1 нмоль/л) [6] и фактором Ха, связанным со свертыванием крови (IC50, 75 нмоль/л) [8]. Установлено, что ривароксабан селективен в отношении человеческого фактора Ха, к которому он обладает в 10 000 раз большей селективностью, чем к другим биологически значимым сериновым протеазам (IC50, 20 моль/л) [6]. Ривароксабан изменяет такие показатели свертывания крови, как протромбиновое время, активированное частичное тромбопластиновое время, а также значения специфического теста анти-фактор Ха-активности (HepTest) и выработку тромбина при наномолярных концентрациях в цельной крови и плазме человека [9].
На момент написания данной статьи в Российской Федерации зарегистрировано 44 лекарственных препарата ривароксабана в форме таблеток, покрытых пленочной оболочкой, и проведено более 100 клинических исследований различных фаз[2]. Это свидетельствует о высокой востребованности ривароксабана для лечения широкого спектра нозологий, связанных с нарушением свертываемости крови. Компания ООО «Атолл» разработала препарат Круоксабан, таблетки, покрытые пленочной оболочкой, в дозировках 2,5, 10, 15 и 20 мг.
Цель исследования: изучение биоэквивалентности воспроизведенного препарата Круоксабан (МНН ривароксабан), таблетки, покрытые пленочной оболочкой (производства ООО «Озон», Россия), зарегистрированному референтному препарату Ксарелто®.
Материал и методы
Исследуемые препараты
Сравнивались воспроизведенный препарат Ривароксабан, таблетки, покрытые пленочной оболочкой, и зарегистрированный референтный препарат Ксарелто®, таблетки, покрытые пленочной оболочкой, в соответствующих дозировках. В исследованиях были использованы препараты: Ривароксабан, таблетки, покрытые пленочной оболочкой, 2,5 мг, серия 010121, производства ООО «Озон», Россия; Ривароксабан, таблетки, покрытые пленочной оболочкой, 10 мг, серия 010121, производства ООО «Озон», Россия; Ривароксабан, таблетки, покрытые пленочной оболочкой, 15 мг, серия 010820, производства ООО «Озон», Россия; Ривароксабан, таблетки, покрытые пленочной оболочкой, 20 мг, серия 010121, производства ООО «Озон», Россия. В качестве референтного выступали препараты: Ксарелто®, таблетки, покрытые пленочной оболочкой, 2,5 мг, серия BXJG7P1, производства «Байер АГ», Германия; Ксарелто®, таблетки, покрытые пленочной оболочкой, 10 мг, серия BXJJINI, производства «Байер АГ», Германия; Ксарелто®, таблетки, покрытые пленочной оболочкой, 20 мг, серия BXJG2HI, производства «Байер АГ», Германия. Экспериментальная часть была проведена с воспроизведенным препаратом под наименованием Ривароксабан, под которым воспроизведенный препарат был допущен к регистрационным процедурам. На этапе подготовки досье на регистрацию препарату было присвоено торговое наименование Круоксабан (заявка № Z22001997; fips.ru/).
Содержание статьи
Тест сравнительной кинетики растворения (ТСКР)
Изучение высвобождения ривароксабана из исследуемых препаратов в раствор in vitro осуществляли в соответствии с требованиями ФЕАЭС, ОФС 2.1.9.3. «Испытание на растворение для твердых дозированных лекарственных форм», проектом нормативного документа по качеству на лекарственное средство и правилами проведения исследований биоэквивалентности[3]. Тест растворения in vitro проводили в трех средах растворения — буферных растворах со значениями рН 1,2, 4,5 и 6,8. Метод определения — высокоэффективная жидкостная хроматография (хроматографическая колонка из нержавеющей стали размером 55×4,0 мм, заполненная октадецилсилильным силикагелем с размером частиц 3 мкм, Purospher STAR RP-18endcapped) c УФ-спектрофотометрическим детектором.
Статистическую обработку результатов эксперимента проводили в соответствии с требованиями Государственной фармакопеи Российской Федерации. Различия определяли при 0,05% уровне достоверности. Для всех данных применена описательная статистика: подсчитаны среднее арифметическое значение и стандартное отклонение. Кинетика растворения лекарственного средства считается эквивалентной, если значение фактора подобия f2 лежит в пределах от 50 до 100. В том случае, когда более 85% лекарственного средства переходит в раствор в течение 15 мин, кинетика растворения считается эквивалентной без математической оценки.
Исследование биоэквивалентности
Участники исследований. В каждое исследование было рандомизировано 32 здоровых добровольца мужского пола, которые соответствовали всем критериям включения (некурящие, в возрасте от 18 до 45 лет и с индексом массы тела от 18,5 до 30,0 кг/м2) и не соответствовали ни одному из критериев невключения.
Этические принципы. Протоколы исследования, брошюры исследователя, информационные листки добровольца с формой информированного согласия на участие в исследовании были одобрены Советом по этике при Минздраве России до начала исследования (включения добровольцев в исследование). Документы исследования рассматривались на заседании Совета по этике № 261 от 22.12.2020. Министерством здравоохранения было выдано разрешение на проведение клинических исследований по протоколам № RVX001 (разрешение № 85 от 12.02.2021), RVX002 (разрешение № 22 от 20.01.2021), RVX003 (разрешение № 79 от 10.02.2021). Рассмотрение и утверждение материалов исследования прошли и в локальных этических комитетах. Исследования № RVX001 и RVX002 были одобрены комитетом по этике бюро № 1 при ГБУЗ ЯО «Клиническая больница № 2» на заседаниях от 02.03.2021 и 02.02.2021 соответственно, исследование № RVX003 — локальным этическим комитетом при ООО «Серта Клиник» на заседании от 15.04.2021.
Клинические исследования по протоколам № RVX001, RVX002 и RVX003 проводили в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации (ВМА) (в последней редакции, одобренной на 64-й Генеральной Ассамблее ВМА, г. Форталеза, Бразилия, октябрь 2013 г.), трехсторонним соглашением по Надлежащей клинической практике (ICH GCP, 1996) и регламентировались действующими законодательными документами РФ.
Дизайн клинического исследования. Были проведены три проспективных рандомизированных открытых сравнительных двухпериодных перекрестных в двух последовательностях исследования биоэквивалентности с приемом здоровыми добровольцами однократной дозы ривароксабана натощак (исследования № RVX001 и RVX002) или после приема стандартизированного завтрака (исследование № RVX003) (табл. 1).
Исследования проходили в условиях стационара и состояли из четырех периодов: скрининг, период «отмывки», два периода приема препарата (рис. 1). До проведения любых мероприятий, связанных с исследованием, добровольцы в присутствии врача-исследователя подписывали и датировали (с указанием времени подписания) форму информированного согласия в двух экземплярах, и только после этого проводились все необходимые процедуры для оценки критериев включения/невключения в исследование. Был использован стандартный подход рандомизации 1:1, чтобы распределить испытуемых в одну из двух последовательностей: тестируемый препарат в первом периоде, за которым следовал референтный препарат во втором, или наоборот. Во время периодов приема исследуемых препаратов доброволец находился под медицинским наблюдением. В этот период осуществляли забор проб крови для определения параметров фармакокинетики, оценивали безопасность и переносимость исследуемого препарата. После первого приема исследуемого препарата следовал «отмывочный» этап.
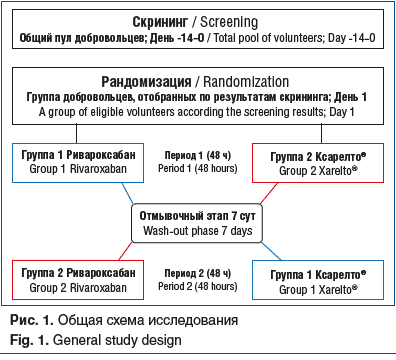
Параметры, оцениваемые в ходе исследования. Основываясь на данных о концентрации ривароксабана в плазме крови, рассчитывали основные и дополнительные фармакокинетические параметры. Основные параметры фармакокинетики: Cmax (максимальная концентрация вещества в плазме крови добровольца); Tmax (время достижения максимальной концентрации вещества в плазме крови добровольца; в случае если фармакокинетический профиль содержит два максимума, Tmax рассчитывали как время первого максимума); AUC0-t (площадь под фармакокинетической кривой «концентрация — время», площадь рассчитана методом линейных трапеций); AUC0-∞ (площадь под фармакокинетической кривой «концентрация — время», экстраполированная до бесконечности); T1/2 (период полувыведения). Дополнительные параметры фармакокинетики (данные в статье не представлены): Tlag (время от точки 0 до первой точки с концентрацией выше нижнего предела количественного определения, НПКО); последней точкой расчета (Clast) является последнее значение больше НПКО, AUC%inf (доля остаточной площади (AUC0-t — AUC0-∞)/AUC0-∞), Kel (λz) (константа элиминации), MRT (среднее время удержания препарата в крови). Фармакокинетические параметры оценивали с использованием специализированного программного обеспечения (например, Phoenix™ WinNonlin®, PK Solution и т. п.) и валидированного кода среды вычислений (SAS™, R Project, Julia).
Параметры безопасности и переносимости оценивали на основании анализа жалоб добровольцев, нежелательных явлений (НЯ) по данным физикального и лабораторного обследования, регистрации основных жизненно важных показателей (АД, ЧСС, температуры тела), результатов ЭКГ в 12 отведениях.
Отбор проб и пробоподготовка. Во время исследования отбирали образцы крови для определения плазменных концентраций ривароксабана. Время забора образцов: до приема препарата (0 ч), далее через 0,33, 0,66, 1, 1,5, 2, 2,5, 3, 3,5, 4, 5, 6, 8, 12, 16, 24, 36 и 48 ч после приема препарата. Для облегчения забора крови и уменьшения дискомфорта добровольца использовали кубитальные катетеры (0–12 ч), а далее (точки 16, 24, 36 и 48 ч) отбор крови проводили с помощью венепункций. Погрешность временных точек отбора крови в период от 0 ч до 12 ч составила ± 1 мин, от 16 до 48 ч — ± 5 мин. Объем крови, забираемой для фармакокинетического исследования, составил не более 5 мл для каждой временной точки, или не более 180 мл за все исследование. С учетом анализов крови на визите скрининга и по завершении исследования общий объем крови, отбираемый за исследование, не превышал 220 мл.
Отбор образцов крови проводили в пробирки с ЭДТА. Плазму отделяли центрифугированием при 2500–3000 оборотах в течение 10 мин. Полученный объем плазмы крови был разделен на две равные части объемом не менее 1,0 мл. Образцы замораживали при температуре не выше -25°С. Пробирки маркировали следующим образом: номер протокола исследования, код добровольца, номер периода исследования, номер образца.
Анализ концентрации ривароксабана в образцах. Количественное определение ривароксабана в образцах плазмы крови здоровых добровольцев проводили валидированным методом жидкостной хроматографии с тандемной масс-спектрометрией. Процедура пробоподготовки включала стадию жидкостно-жидкостной экстракции, выпаривания органического слоя, растворения сухого остатка. Хроматографическое разделение проводили на обращенно-фазовой хроматографической колонке. Аналитический сигнал детектировали методом тандемной масс-спектрометрии с ионизацией электроспреем. Ривароксабан детектировали по расщеплению молекулярного иона 436,0®144,8 для количественного определения в положительном режиме ионизации, 436,0 ®231,1 — для подтверждения специфичности метода. Концентрацию ривароксабана в активных образцах рассчитывали методом внутреннего стандарта. В качестве внутреннего стандарта использовали карбамазепин. Карбамазепин детектировали по расщеплению молекулярного иона 237,1 ®194,1.
Статистический анализ. Основные параметры фармакокинетики AUC0-t, AUC0-∞, Сmах были логарифмически преобразованы (для всех параметров применяли натуральный логарифм). Логарифмически преобразованные параметры использовали при дисперсионном анализе (ANOVA), с помощью которого были оценены значения остаточной (внутрииндивидуальной) вариации основных параметров фармакокинетики AUC0-t, AUC0-∞, Сmах. В качестве статистической модели дисперсионного анализа была принята общая линейная модель (GLM), включающая следующие факторы, вносящие вклад в наблюдаемую вариацию данных: препараты, добровольцы, период исследования, последовательность приема препаратов. На основании результатов дисперсионного анализа параметров фармакокинетики ривароксабана AUC0-t, AUC0-∞, Сmах были получены точечные оценки отношений средних геометрических (f, f’, f») и рассчитаны их двусторонние 90% доверительные интервалы (ДИ). Для статистического анализа использовали пакет «Биоэквивалентность 2.4». Был выполнен описательный анализ данных с указанием числа наблюдений (N) и расчетом параметров описательной статистики: среднего арифметического (Mean), среднего геометрического, стандартного отклонения (SD), стандартной ошибки (SE), медианы (Me), максимального и минимального значения, 1-го квартиля (Q1), 3-го квартиля (Q3). В ходе дисперсионного анализа для параметров AUC0-t, Cmax был вычислен коэффициент внутри- и межиндивидуальной вариации. Расчет внутрииндивидуальной вариации и искомых ДИ выполняли с помощью модуля Phoenix™ WinNonlin®: Winnonlin linear mixed effects modeling / bioequivalence, с помощью аналогичного программного обеспечения (SASTM, IBM® SPSS® Statistics, StatSoft® Statistica) или валидированного кода для среды вычислений. Сравнительная оценка безопасности исследуемых лекарственных препаратов была выполнена с помощью анализа частоты НЯ и серьезных НЯ с использованием критерия χ2 по методу Мак-Немара.
Результаты исследования
Тесты сравнительной кинетики растворения
В целях подтверждения сходимости кинетики перехода в раствор активного вещества при рН, соответствующих разным отделам желудочно-кишечного тракта человека, сравниваемые препараты ривароксабана (тестируемый и референтный) были изучены in vitro во всех сравниваемых дозировках. При использовании ТСКР для оценки эквивалентности профилей высвобождения действующего вещества из двух препаратов были выполнены все необходимые условия (количество принимаемых в расчет временных точек было не менее трех; условия испытания для обоих препаратов были одинаковыми, и отбор проб осуществлялся через одинаковые промежутки времени; для каждой временной точки для каждого препарата было проведено не менее 12 параллельных определений).
Согласно Правилам проведения исследований биоэквивалентности, в связи с тем, что в течение 15 мин в солянокислом буферном растворе рН 1,2, ацетатном буферном растворе рН 4,5 и фосфатном буферном растворе рН 6,8 растворилось менее 85% ривароксабана, кинетика растворения потребовала математического анализа данных. Был рассчитан фактор подобия (f2) для всех исследуемых концентраций действующего вещества в примененных средах растворения, который превысил значение 50, достаточное для установления эквивалентности (табл. 2).
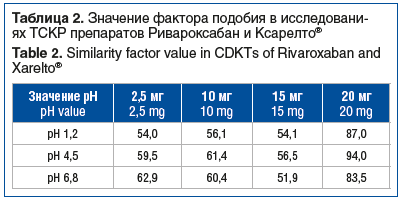
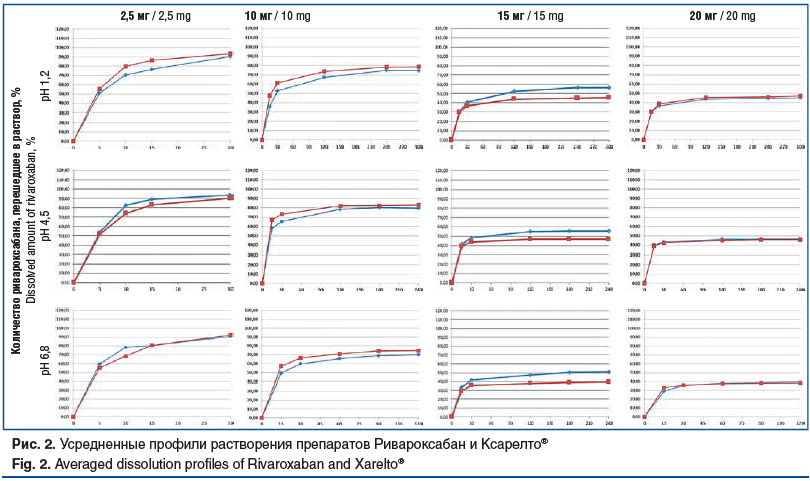
По результатам ТСКР лекарственного препарата Ривароксабан, таблетки, покрытые пленочной оболочкой (производства ООО «Озон», Россия), в дозировках 2,5, 10, 20 мг (исследуемый препарат) и лекарственного препарата Ксарелто®, таблетки, покрытые пленочной оболочкой («Байер АГ», Германия), в дозировках 2,5, 10, 20 мг (референтный препарат) установлено, что профили растворения данных препаратов эквивалентны в солянокислом буферном растворе рН 1,2, ацетатном буферном растворе pH 4,5 и фосфатном буферном растворе pH 6,8. Также было установлено, что профиль растворения препарата Ривароксабан, таблетки, покрытые пленочной оболочкой, 15 мг (производства ООО «Озон», Россия) эквивалентен профилю растворения препарата Ривароксабан, таблетки, покрытые пленочной оболочкой, 20 мг (производства ООО «Озон», Россия) (рис. 2).
Клинические исследования биоэквивалентности и безопасности препаратов ривароксабана
Целью проведенных исследований являлось изучение сравнительной фармакокинетики, доказательство биоэквивалентности и сравнительная оценка безопасности лекарственных препаратов Ривароксабан, таблетки, покрытые пленочной оболочкой, и Ксарелто®, таблетки, покрытые пленочной оболочкой, у здоровых добровольцев, после однократного приема внутрь препаратов (1 таблетка исследуемого препарата или 1 таблетка референтного препарата). В ходе эксперимента определялись концентрации ривароксабана в плазме крови добровольцев, в дискретных интервалах времени с оценкой фармакокинетических параметров и относительной биодоступности лекарственных препаратов Ривароксабан, таблетки, покрытые пленочной оболочкой, и Ксарелто®, таблетки, покрытые пленочной оболочкой, для построения фармакокинетических кривых. Графические изображения усредненных фармакокинетических профилей референтного и исследуемого лекарственных препаратов в непреобразованных и логарифмических координатах приведены на рисунках 3 и 4.
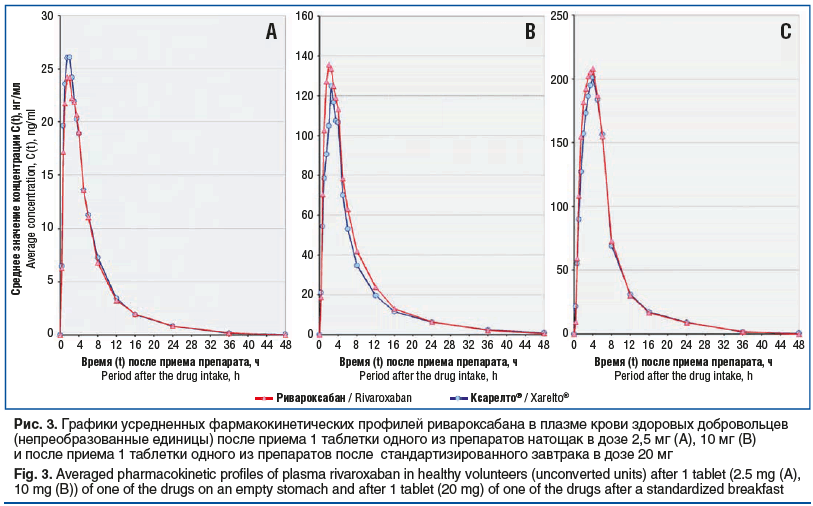
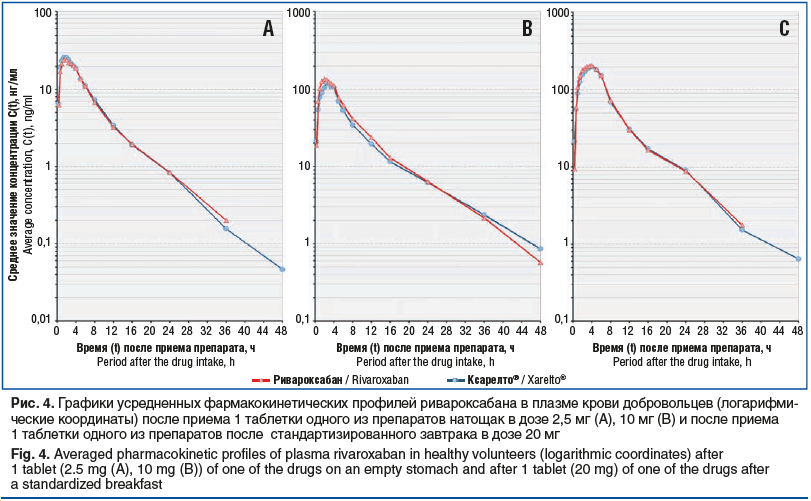
Для каждого добровольца на основе полученных фармакокинетических профилей были рассчитаны индивидуальные значения основных параметров фармакокинетики действующего вещества, необходимые для оценки биоэквивалентности сравниваемых препаратов. Обобщенные результаты статистической оценки с помощью описательной статистики параметров фармакокинетики действующего вещества приведены в таблице 3.
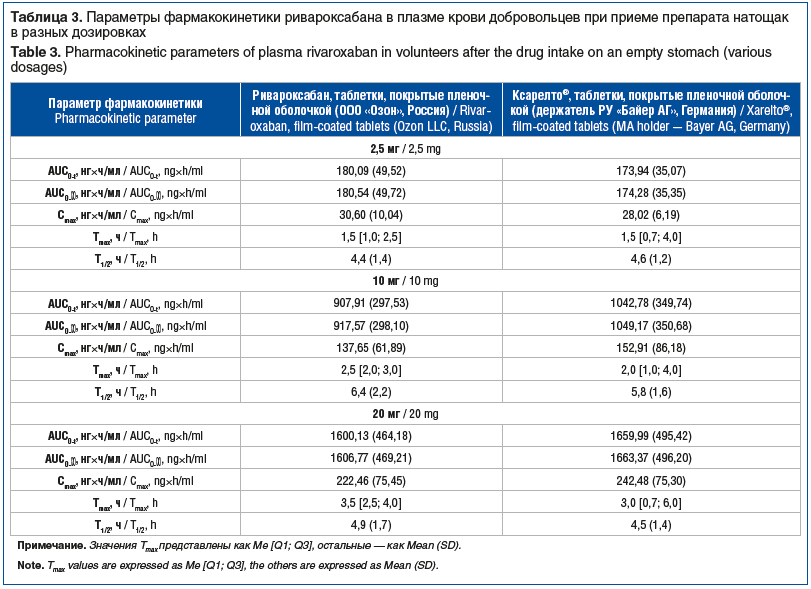
Для исследования биоэквивалентности сравниваемых препаратов использовали подход, основанный на оценке двусторонних 90% ДИ для отношений средних геометрических значений основных фармакокинетических параметров ривароксабана AUC0-t, AUC0-∞, Cmax. Рассчитанные по результатам статистического анализа точечные оценки отношений и их 90% ДИ представлены в таблице 4. В графическом виде двусторонние 90% ДИ для отношения средних геометрических значений основных фармакокинетических параметров показаны на рисунке 5.
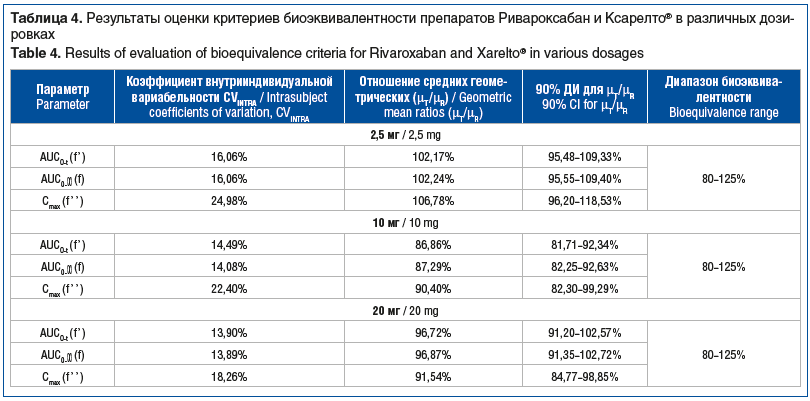
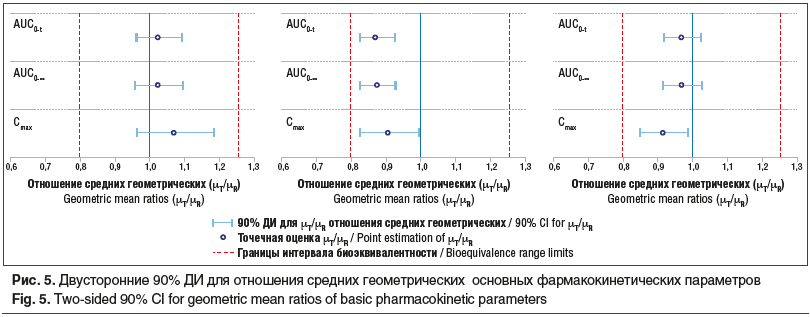
Как видно из представленных данных, 90% ДИ для отношений средних геометрических параметров AUC0-t, AUC0-∞, Cmax не выходят за пределы границ биоэквивалентности, установленных протоколом и Правилами ЕврАзЭС [12]. Следовательно, сравниваемые лекарственные препараты являются биоэквивалентными.
Кроме того, была проведена сравнительная оценка без-опасности исследуемых лекарственных препаратов при их приеме здоровыми добровольцам. Серьезных НЯ и НЯ не было. Добровольцев, исключенных из исследования в связи с НЯ, не было. Двукратный прием препаратов ривароксабана не оказал какого-либо негативного влияния на показатели морфологического состава периферической крови, на уровни ее основных биохимических констант, характеризующих функциональное состояние печени и почек, на показатели общего анализа мочи, на основные показатели сердечной деятельности и гемодинамики. В связи с тем, что побочных эффектов не было, можно утверждать, что в исследовании была продемонстрирована хорошая переносимость добровольцами препаратов ривароксабана. Таким образом, сравниваемые препараты имеют сопоставимый профиль безопасности.
Обсуждение
Исследования воспроизведенных препаратов в целях регистрации в России четко регламентируются и требуют определенного набора обязательных процедур, предваряющих выход нового продукта на рынок. Для воспроизведенного препарата, являющегося копией уже зарегистрированного лекарственного препарата по качественному и количественному составу, необходимо получить данные о результатах ТСКР in vitro и биоэквивалентности, доказывающие их биофармацевтическую сопоставимость.
С целью получения характеристик серии препарата Круоксабан, использованной в исследовании биоэквивалентности, и сравнения ее с характеристиками референтного лекарственного препарата Ксарелто®, были проведены ТСКР in vitro в соответствии с Правилами проведения исследований биоэквивалентности. Кроме того, для дозировки препарата Круоксабан 15 мг результаты исследования ТСКР являлись заменой исследований биоэквивалентности.
Была установлена эквивалентность сравнительных характеристик растворения тестируемого препарата Круоксабан (Ривароксабан), таблетки, покрытые пленочной оболочкой, 2,5, 10 и 20 мг, в сравнении с препаратом Ксарелто®, таблетки, покрытые пленочной оболочкой, в четырех средах для растворения для всех концентраций. Было обнаружено, что для дозировок 2,5, 10 и 20 мг профили растворения одинаковы, поскольку значение f2 превышает 50 в каждой среде растворения. Растворимость препарата Круоксабан, таблетки, покрытые пленочной оболочкой, 15 мг, сравнивалась с таковой у препарата Круоксабан, таблетки, покрытые пленочной оболочкой, 20 мг.
Для оценки биодоступности и параметров фармакокинетики в целях регистрации проводятся сравнительные исследования оригинального и воспроизведенного препаратов, в одной или двух дозировках, в зависимости от свойств лекарственного препарата, согласно положениям раздела 7 Правил проведения исследований биоэквивалентности3. Как правило, исследование биоэквивалентности проводится для наибольшей дозировки3. Но в случае с таблетированным препаратом ривароксабана в научной литературе имеются сведения о разной его биодоступности в зависимости от диапазона доз и поступления препарата в организм натощак или после приема пищи. Так, было показано, что ривароксабан быстро всасывается у здоровых людей натощак, достигая максимальной концентрации в плазме крови (Cmax) примерно через 2 ч после приема одной таблетки (1,25–80 мг) [10]. При приеме внутрь показатель Tmax составляет от 3 до 3,5 ч (таблетки по 10, 15 и 20 мг) [11]. По данным литературы, у ривароксабана наблюдается линейная фармакокинетика при дозе до 10 мг при приеме натощак[4]. Биодоступность таблетки 10 мг при приеме внутрь высока (80–100%) независимо от приема пищи [12]. Однако биодоступность таблетки 20 мг значительно снижается при приеме без пищи (66%). Пища восстанавливает высокий уровень пероральной биодоступности (≥80%) ривароксабана в этой дозе и приводит к увеличению площади под кривой зависимости концентрации от времени в плазме крови (AUC) и Cmax на 39 и 76% соответственно. В связи с этим в инструкции по медицинскому применению препарат ривароксабана рекомендуется принимать в дозе 20 мг во время приема пищи. Учитывая, что дозы 15 и 20 мг используются по одним и тем же показаниям, дозу 15 мг также следует принимать с пищей, чтобы обеспечить соответствие рекомендациям по дозировке [11]. Поскольку существует различный эффект приема пищи на фармакокинетические параметры ривароксабана, приводящий к различным рекомендациям по приему для более низких доз (2,5 и 10 мг) и более высоких доз (15 и 20 мг), зарубежные регуляторные органы выпустили рекомендации по проведению исследований биоэквивалентности, согласно которым требуется проведение нескольких исследований. Рекомендуется проводить исследования с дозировками до 10 мг натощак и исследование с дозировкой 15 мг и более после приема пищи[5].
В проведенные нами исследования были привлечены здоровые добровольцы мужского пола (принимались во внимание фармакодинамическое действие изучаемых препаратов и циклические изменения гормонального фона у добровольцев женского пола, неблагоприятно влияющие на подбор и комплаентность участников исследования). Для расчета количества добровольцев в исследования препарата Круоксабан использовали показатели внутрииндивидуальной вариабельности фармакокинетических параметров, полученные в уже проведенных исследованиях биоэквивалентности препаратов ривароксабана. По данным таких исследований, наибольшие значения внутрииндивидуальной вариабельности составили 24,43 и 14,65% для Cmax и AUC соответственно[6]. В нашем исследовании получены схожие параметры внутрииндивидуальной вариабельности соответствующих параметров у исследуемых препаратов (см. табл. 3). Исходя из данных внутрииндивидуальной вариабельности, в каждое исследование включили 32 рандомизированных добровольца. Нами было проведено изучение сравнительной фармакокинетики и относительной биодоступности препаратов Круоксабан и Ксарелто® в дозировках 2,5 мг и 10 мг у здоровых добровольцев натощак (исследования № RVX001, RVX002), а в дозировке 20 мг — после приема пищи (исследование № RVX003).
Валидация биоаналитического метода была выполнена в соответствии с требованиями Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках ЕврАзЭС: Требования к валидации биоаналитических методик испытаний и анализу исследуемых биологических образцов и на основании опубликованных данных об измерениях концентрации ривороксабана в плазме крови человека [13]. Нижний предел количественного определения ривароксабана в образце плазмы добровольца в рамках проведенной процедуры валидации был установлен на уровне 0,5 нг/мл. Мощность статистических тестов оценивалась с помощью статистической программы NCSS PASS 15. Для всех параметров AUC0-t, AUC0-∞, Cmax мощность статистического теста оказалась выше 80%. Полученные результаты удовлетворяют общепринятому критерию биоэквивалентности и требованиям протокола настоящего исследования (границы 90% ДИ отношений средних геометрических значений для основных фармакокинетических параметров AUC0-t, AUC0-∞, Cmax находятся в диапазоне 80–125%). Следовательно, биоэквивалентность препарата Круоксабан, таблетки, покрытые пленочной оболочкой, 2,5 мг, 10 мг и 20 мг (производства ООО «Озон», Россия) и препарата Ксарелто®, таблетки, покрытые пленочной оболочкой, 2,5 мг, 10 мг и 20 мг (держатель РУ «Байер АГ», Германия) следует считать установленной. Была осуществлена экстраполяция данных о биоэквивалентности препарата Круоксабан, полученных для концентрации 20 мг (протокол № RVX003), на дозировку 15 мг, согласно результатам ТСКР, принимая во внимание способ применения (с пищей) и рекомендации по изучению биоэквивалентности препаратов ривароксабана[7]. Дозировки 15 и 20 мг имеют одинаковый способ приема (с пищей), кроме того, была показана эквивалентность профилей растворимости препаратов Круоксабан, таблетки, покрытые пленочной оболочкой, и Ксарелто®, таблетки, покрытые пленочной оболочкой, в дозировке 20 мг. Таким образом, дозировка 15 мг была зарегистрирована по процедуре биовейвер, согласно Правилам проведения исследований биоэквивалентности3.
Заключение
Рассмотренные в данной работе биофармацевтические исследования препаратов ривароксабана проведены в Российской Федерации по протоколам № RVX001, RVX002 и RVX003, одобренным Минздравом России, в полном соответствии с требованиями российского законодательства, Правилами надлежащей клинической практики ЕврАзЭС, Правилами проведения исследований биоэквивалентности лекарственных препаратов в рамках ЕврАзЭС и международными правилами проведения клинических исследований (ICH GCP). В ходе исследований изучена сравнительная фармакокинетика и биоэквивалентность препаратов ривароксабана: исследуемый препарат — Круоксабан, таблетки, покрытые пленочной оболочкой (производства ООО «Озон», Россия), и препарат сравнения, разрешенный к медицинскому применению в России, — Ксарелто®, таблетки, покрытые пленочной оболочкой (держатель РУ «Байер АГ», Германия), в дозировках 2,5 мг, 10 мг и 20 мг. Биоэквивалентность сравниваемых препаратов ривароксабана была обоснована и доказана, препарат прошел государственную регистрацию (РУ № ЛП-№(004773)-(РГ-RU)) и находится в обороте на территории государств — членов Европейского экономического союза.
Сведения об авторах:
Сотников Илья Евгеньевич — PhD в клеточной и молекулярной иммунологии, главный эксперт в планировании, организации, проведении и оценке клинических исследований, главный научный эксперт-консультант, директор международного сотрудничества компании ООО «ЭЮЦ Клиник»; 109147, Россия, г. Москва, ул. Таганская, д. 3, эт. 5, пом. 1, ком. 4; ORCID iD 0000-0001-9968-2803
Касаткина Ирина Сергеевна — к.м.н., генеральный директор ООО «ЭЮЦ Клиник»; 109147, Россия, г. Москва, ул. Таганская, д. 3, эт. 5, пом. 1, ком. 4; ORCID iD 0000-0002-6177-3360
Муратов Кирилл Михайлович — врач-терапевт, врач клинический фармаколог ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-4195-8907
Контактная информация: Сотников Илья Евгеньевич, e-mail: i.sotnikov@expert-lc.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 10.01.2025.
Поступила после рецензирования 04.02.2025.
Принята в печать 27.02.2025.
About the authors:
Il’ya E. Sotnikov — PhD in Cellular and Molecular Immunology, Chief Expert for Design, Arrangement, Management and Evaluation of Clinical Trials, Chief Scientific Expert Consultant, Director for International Cooperation of ELC Clinic LLC; room 4, office 1, floor 5, 3, Taganskaya str., Moscow, 109147, Russian Federation; ORCID iD 0000-0001-9968-2803
Irina S. Kasatkina — C. Sc. (Med.), General Director of the ELC Clinic LLC; room 4, office 1, floor 5, 3, Taganskaya str., Moscow, 109147, Russian Federation; ORCID iD 0000-0002-6177-3360
Kirill M. Muratov — General Physician, Clinical Pharmacologist, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0002-4195-8907
Contact information: Il’ya E. Sotnikov, e-mail: i.sotnikov@expert-lc.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 10.01.2025.
Revised 04.02.2025.
Accepted 27.02.2025.
[1] Xarelto. Summary of Product Characteristics. (Electronic resource.) URL: https://www.bayer.com/sites/default/files/xarelto-10mg-smpc-dec-2022.pdf (access date: 15.02.2025).
[2] Ривароксабан. (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/GRLS.aspx?isfs=0®type=1%2c6&pageSize=10&order… (дата обращения: 15.02.2025).
[3] Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 85 «Об утверждении Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза».
[4] Clinical pharmacology and biopharmaceutics review(s). XARELTO® immediate release tablets (rivaroxaban). 2009. (Electronic resource.) URL: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2011/022406orig1s000clinpharmr.pdf (access date:15.02.2025).
[5] Committee for Medicinal Products for Human Use (CHMP) Rivaroxaban film-coated tablets 2.5, 10, 15 and 20 mg 5 product-specific bioequivalence guidance EMA/CHMP/PKWP/151340/2015 24 September 2015.
[6] Public Assessment Report. Scientific discussion. Rivaroxaban Vocate 10 mg, 15 mg and 20 mg, film-coated tablets (rivaroxaban) NL/H/5417/001-003/DC. Date: 21 May 2024. (Electronic resource.) URL: https://www.geneesmiddeleninformatiebank.nl/pars/h128304.pdf (access date:15.02.2025).
[7] EMEA Committee for Medicinal Products for Human Use (CHMP). Assessment report Rivaroxaban Accord EMA/550657/2020 17 September 2020.
Информация с rmj.ru






