Введение
В настоящее время сохраняется рост заболеваемости и распространенности коинфекции вирус иммунодефицита человека (ВИЧ) / туберкулез. Среди заболевших преобладают лица молодого и среднего возраста [1, 2]. Поражение органа зрения развивается у большинства (более 70%) пациентов с ВИЧ-инфекцией [3]. Диагностика офтальмологических заболеваний в 43,7% случаев осуществляется на поздних стадиях, нередко уже с наличием необратимых изменений, стойким снижением зрительных функций, поскольку в 97,4% случаев пациенты обращаются к офтальмологу только при появлении жалоб [3, 4].
Наиболее значимым в структуре офтальмологических заболеваний при ВИЧ-инфекции, особенно в продвинутых стадиях, остается цитомегаловирусный (ЦМВ) ретинит [5–8], при котором, в зависимости от площади поражения и вовлечения в процесс макулярной зоны сетчатки, зрительного нерва, отмечается стойкое снижение зрительных функций вплоть до полной слепоты [5, 7]. Данные литературы [3, 5, 8, 9] свидетельствуют о снижении доли ЦМВ-ретинита у пациентов на фоне приема высокоактивной антиретровирусной терапии (ВАРТ), но высокий уровень поражения органа зрения и нарушение зрительных функций в этой группе сохраняются и обусловлены развитием катаракты, увеита (токсоплазмоз, вирусы герпеса, IRU — immune recovery uveitis, увеит, развивающийся на фоне восстановления иммунитета у пациентов с ВИЧ-инфекцией), макулярного отека, эпиретинальных мембран, отслойки сетчатки и прочих патологических процессов.
У больных ВИЧ-инфекцией нарушение зрительных функций может быть вызвано наличием ВИЧ-ассоциированной ретинопатии, в том числе ватообразных очагов (cotton-wool spots), микроаневризм, телеангиэктазий, отсутствием капиллярной перфузии (зоны ишемии). В качестве причин данной патологии рассматривают изменение реологических показателей крови, отложение в эндотелии иммунных комплексов и непосредственное поражение клеток эндотелия сосудов, повреждение и дисфункцию митохондрий [10–12]. Длительная ВАРТ сопровождается уменьшением диаметра артериол глазного дна, а вирусная нагрузка — увеличением диаметра венул [13].
По данным литературы [12], у ВИЧ-позитивных пациентов имеет место истончение слоя нервных волокон сетчатки (СНВС), зафиксированное методом оптической когерентной томографии (ОКТ). Таким образом, состояние сетчатки, в том числе слоя нервных волокон в перипапиллярной зоне, и сосудов сетчатки имеет значение в отношении прогноза развития поражений органа зрения у лиц с коинфекцией ВИЧ/туберкулез.
Возможности визуализации структур глаза с помощью ОКТ позволяют оценить состояние сетчатки, в том числе СНВС и калибр сосудов сетчатки. В диагностике патологических изменений глаза при таких заболеваниях, как глаукома, сахарный диабет, артериальная гипертензия, и прочих, метод ОКТ нашел широкое применение в практике офтальмологов [15–17].
Цель исследования: изучение состояния сетчатки, в том числе СНВС в перипапиллярной зоне и калибра ретинальных сосудов, с помощью метода ОКТ у пациентов с туберкулезом и коинфекцией ВИЧ/туберкулез при отсутствии патологических изменений, фиксируемых при стандартном офтальмологическом обследовании.
Материал и методы
В клинике УНИИФ — филиала ФГБУ «НМИЦ ФПИ» Минздрава России проведено проспективное открытое исследование с участием пациентов с туберкулезом легочной и внелегочной локализации, с ВИЧ-инфекцией и без нее, которые обследовались и получали терапию согласно клиническим рекомендациям «Туберкулез у взрослых». Исследование выполнялось в рамках научно-исследовательской работы, отдельные результаты которой были опубликованы авторами ранее и защищены патентами Российской Федерации (патент № 119188 «Схема «Диагностические и лечебные мероприятия у пациентов с верифицированным диагнозом «туберкулез» и с коинфекцией туберкулез/ВИЧ», 03.02.2020; патент № 2744678 «Способ доклинической диагностики патологии заднего отрезка глаза у пациентов с коинфекцией ВИЧ/туберкулез», 15.03.2021).
Критерии включения: пациенты обоих полов в возрасте 30–40 лет с туберкулезом легочной и внелегочной локализации, выявленные не более 1 года назад, и пациенты с коинфекцией ВИЧ/туберкулез с количеством СD4-лимфоцитов от 200 до 750 клеток/мкл, вирусной нагрузкой не более 5 тыс. копий. Критерии исключения: наличие в анамнезе перенесенных заболеваний глаз, патологических изменений в офтальмологическом статусе, в том числе ангиопатии сетчатки, диагностированной ранее, сахарный диабет 1 или 2 типа, помутнение оптических сред, нистагм, а также любая патология, исключающая возможность фиксации взора во время обследования.
В зависимости от наличия у пациентов ВИЧ-инфекции были сформированы 2 основные группы, сопоставимые по возрасту и сопутствующей патологии: 1-ю группу (n=19, 38 глаз) составили пациенты с ВИЧ-инфекцией (СD4-лимфоциты от 200 до 750 клеток/мкл, вирусная нагрузка не более 5 тыс. копий), получающие ВАРТ. У всех пациентов данной группы имелось сопутствующее заболевание — туберкулез легочной или внелегочной локализации, выявленный не более 1 года назад; 2-ю группу (n=18, 36 глаз) составили ВИЧ-негативные пациенты с туберкулезом легочной и внелегочной локализации, выявленным не более 1 года назад. Пациенты обеих групп получали непрерывную химиотерапию специфическими антибактериальными препаратами согласно результатам определения чувствительности возбудителя к ним. Контрольную группу (n=20, 40 глаз) составили здоровые добровольцы.
Всем пациентам выполнено стандартное офтальмологическое обследование (визометрия, тонометрия, периметрия, определение цветоощущения, биомикроскопия и офтальмоскопия, биомикроофтальмоскопия с фоторегистрацией).
Оптическую когерентную томографию с определением состояния СНВС выполняли с помощью аппарата iVue-100, версия 3.2 (Optovue, США), с использованием карты Nerve Fiber ONH. При этом скан СНВС создает диаграмму 3,45 мм TSNIT (диаграмма девиации) и карту толщины СНВС радиусом 4,93 мм от центра диска зрительного нерва (ДЗН). Для оценки состояния сетчатки измеряли толщину всей сетчатки в макулярной области с помощью опции Retina Map. Далее проводили измерение диаметра сосудов сетчатки с использованием линейного скана. Для измерения калибра ретинальных сосудов использовали карту Nerve Fiber 3D Disc в режиме SLO и EnFace. В режиме SLO горизонтальный и вертикальный ползунки оси скана устанавливали на выбранные для исследования артерию или вену сетчатки первого порядка (верхние темпоральные и назальные артерии и нижние темпоральные и назальные вены) и создавали точку перекреста в месте измерения на расстоянии 0,5–0,75 диаметра диска от края ДЗН. Затем в режиме En Face выполняли поиск изучаемого сосуда на томограмме, выбирали базовый уровень ILM и, используя опцию «Толщина», измеряли высоту его тени с помощью вертикального ползунка. Полученные результаты показывали количество микрометров и соответствовали внутреннему диаметру кровеносного сосуда.
Статистическую обработку данных осуществляли с помощью пакетов программ Statistica 10.0 и Microsoft office Еxcel 2016. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
В 1-ю группу (n=19 человек, 38 глаз) вошли пациенты обоих полов в возрасте 34±1 год с ВИЧ-инфекцией, получающие ВАРТ. В 12 (63%) случаях было зафиксировано бактериовыделение, в 7 (37%) случаях — множественная лекарственная устойчивость M. tuberculosis. Во 2-ю группу (n=18, 36 глаз) вошли ВИЧ-негативные пациенты обоих полов в возрасте 38±4 года с туберкулезом легочной и внелегочной локализации. В 10 (56%) случаях методом посева было выявлено бактериовыделение, пациенты с множественной лекарственной устойчивостью M. tuberculosis в данной группе отсутствовали. Группу контроля (n=20, 40 глаз) составили здоровые добровольцы обоих полов в возрасте 35±6 лет.
При стандартном офтальмологическом обследовании патологических изменений в состоянии глаз во всех случаях выявлено не было.
По результатам измерения толщины СНВС в перипапиллярной зоне методом ОКТ (табл. 1) установлено, что данные параметры у пациентов с сочетанием ВИЧ-инфекции и туберкулеза в секторах SN, NU, NL и IN (соответствует носовой зоне) достоверно выше на 13,4–18,3% (р<0,05), чем у участников группы контроля, в то время как толщина СНВС в секторах TU, ST, IT и TL (соответствует височной зоне) сопоставима с данными группы контроля.
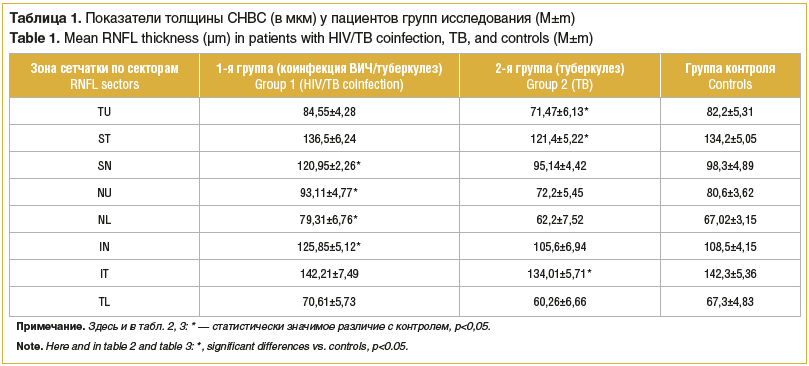
В то же время у больных туберкулезом без ВИЧ-инфекции средние значения толщины СНВС в секторах TU, ST и IT достоверно меньше, чем у представителей контрольной группы, на 5,8–13,1% (p<0,05). В остальных секторах показатели толщины СНВС у пациентов 2-й группы сопоставимы с результатами, полученными у здоровых добровольцев.
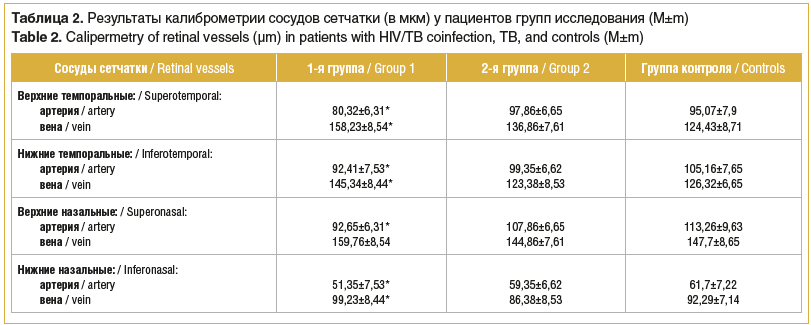
При первичном обследовании мы зафиксировали вариабельность показателей калиброметрии ретинальных сосудов, выполненной по описанной методике (табл. 2), только у больных с коинфекцией ВИЧ/туберкулез (1-я группа). Отмечено сужение диаметра практически всех артерий первого порядка на 12,1–16,8% и увеличение калибра вен первого порядка на 15,1–7,7%, более выраженное в отношении темпоральных сосудов, по сравнению с соответствующими показателями в группе здоровых добровольцев (р<0,05). У пациентов с туберкулезом без ВИЧ-инфекции (2-я группа) результаты калиброметрии ретинальных сосудов были сопоставимы и не имели значимых отличий от результатов группы контроля.
Оценка состояния макулярной зоны сетчатки выполнена с помощью опции Retina Map, в таблице 3 представлены результаты измерения толщины всей сетчатки у пациентов исследуемых групп.
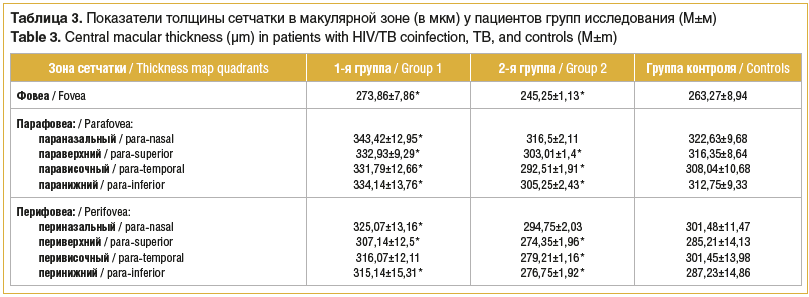
Полученные данные свидетельствуют об увеличении толщины сетчатки во всех зонах макулярной области у пациентов с коинфекцией ВИЧ/туберкулез. Средние значения толщины всей сетчатки достоверно превышали показатели группы контроля: в зоне фовеа — на 4%, парафовеа — на 6,6%, перифовеа — на 7,5% (p<0,05). У пациентов с туберкулезом без ВИЧ-инфекции аналогичные показатели неоднородны: зафиксировано истончение сетчатки на 6,8% в зоне фовеа, на 3,4% — перифовеа, в то время как в зоне парафовеа имело место увеличение толщины всей сетчатки на 7,5% по сравнению с данными, полученными у здоровых добровольцев.
Необходимость исследования состояния сетчатки с применением метода ОКТ у пациентов с коинфекцией ВИЧ/туберкулез была обусловлена имеющимися в нашей практике случаями развития жалоб на нарушение зрительных функций и клинических проявлений, не связанных с инфекционным процессом, у данной группы больных.
Клиническое наблюдение
Пациент Б., 46 лет, находился в клинике УНИИФ — филиала ФГБУ «НМИЦ ФПИ» Минздрава России с целью эндопротезирования левого тазобедренного сустава. Диагноз: Двусторонний инфильтративный туберкулез с обсеменением в фазе рассасывания. Микобактерия туберкулеза (-). Широкая лекарственная устойчивость выявлена посевом от 11.2018 (HRSEKCmOfl). ВИЧ-инфекция, стадия 4В, ВАРТ, СД4 — 700 клеток/мкл (29.04.2019). Хронический вирусный гепатит С. ЦМВ-ретинит, отслойка сетчатки, частичная атрофия зрительного нерва левого глаза.
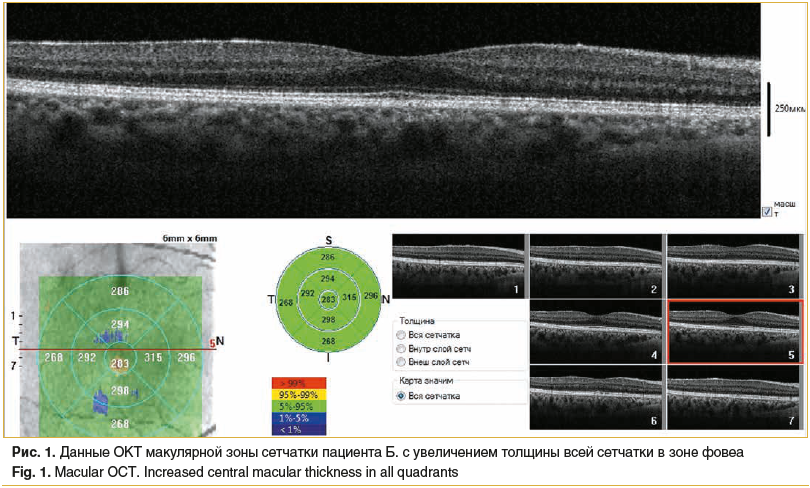
Пациент обратился к офтальмологу с жалобами на искажения линий перед правым глазом. Офтальмологический статус: VisOD=1,0, VisOS — светоощущение снаружи. Правый глаз спокоен, подвижность в полном объеме. Роговица сферична, прозрачна. Передняя камера средней глубины, влага ее прозрачна. Рисунок радужки четкий, зрачок круглый. Оптические среды прозрачны. Глазное дно: ДЗН бледно-розовый, контуры его четкие. Ход и калибр сосудов не изменены, очаговой патологии не просматривается. Левый глаз спокоен, подвижность в полном объеме. Роговица сферична, прозрачна. Рисунок радужки четкий, зрачок круглый. Субкапсулярное помутнение хрусталика, деструкция и плавающие помутнения в стекловидном теле. Глазное дно: ДЗН бледный монотонный, контуры его четкие. Распространенные зоны отслойки сетчатки. Правый глаз: периферические границы поля зрения в норме, определяются искажения по сетке Амслера, цветоощущение в норме, внутриглазное давление (по Маклакову) — 18 мм рт. ст. По данным ОКТ выявлен небольшой участок утолщения сетчатки в зоне фовеа (рис. 1).
С учетом отсутствия признаков увеита, ретинита правого глаза, соматического состояния пациента, высокой лекарственной нагрузки выбор терапии для лечения глазного процесса был ограничен препаратами для местного применения. Вместе с тем необходимы были высокая проницаемость, возможность адекватного режима дозирования, безопасность применения и минимизация неблагоприятного воздействия препарата. С учетом клинической картины наиболее обоснованным в таком случае является применение нестероидных противовоспалительных средств в виде глазных капель. На основании данных литературы [18, 19] и собственных наблюдений мы выбрали оригинальный препарат бромфенак 0,09% (Накван®) в режиме по 1 капле 2 р/сут 15 дней. Препарат содержит минимальное количество консерванта бензалкония хлорида, что минимизирует риск возникновения побочных эффектов, в том числе синдрома «сухого глаза», повреждения роговицы при длительном применении [20]. Терапевтически значимая концентрация бромфенака сохраняется в водянистой влаге глаза в течение 12 ч после однократного применения препарата, следовательно, его двукратное применение обеспечивает достаточный противовоспалительный эффект в течение суток [21].
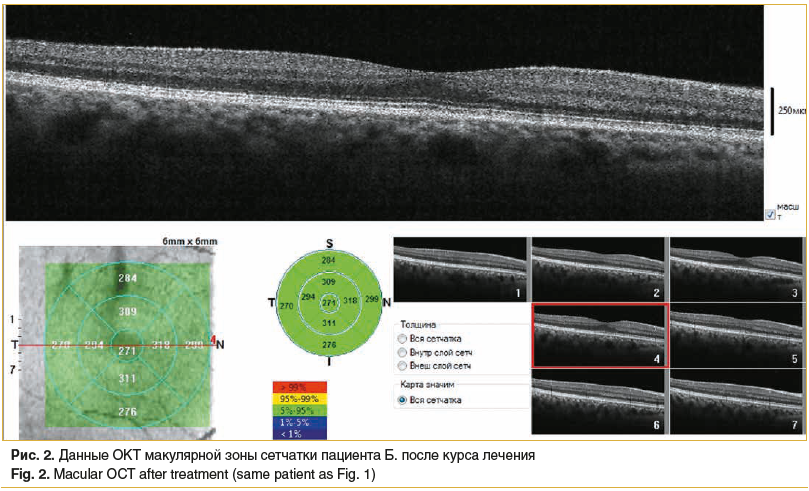
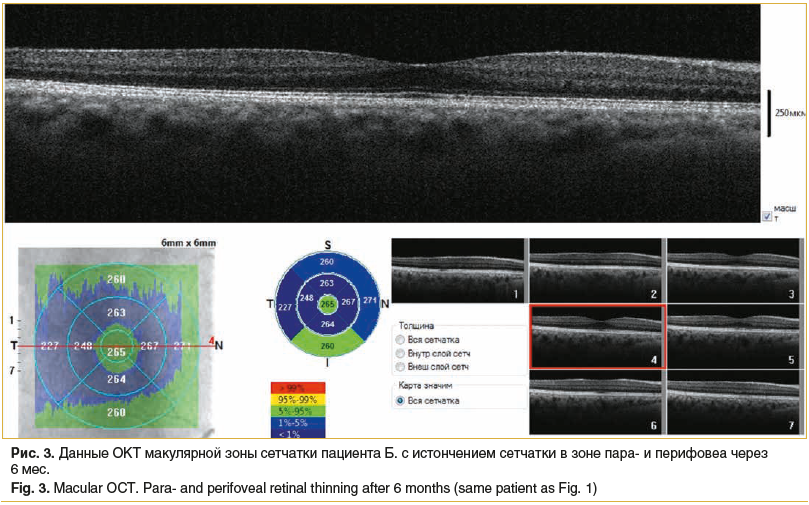
Осмотр офтальмологом проводился через день. Пациент отмечал хорошую переносимость препарата и постепенное улучшение зрительных функций правого глаза. Исчезли искажения, сохранялась высокая острота зрения правого глаза. По данным ОКТ (рис. 2) толщина сетчатки в макулярной зоне нормализовалась. При дальнейшем наблюдении пациента через 6 мес. отмечалось сохранение высоких зрительных функций и отсутствие жалоб. Результаты ОКТ (рис. 3) демонстрируют истончение сетчатки в зоне пери- и парафовеа.
Заключение
Исследовано состояние сетчатки с применением ОКТ у пациентов с коинфекцией ВИЧ/туберкулез и туберкулезом в сравнении со здоровыми добровольцами при отсутствии жалоб, клинических проявлений, а также нарушений зрительных функций, регистрируемых при стандартном офтальмологическом обследовании. Наибольшая вариабельность полученных данных имела место в группе пациентов с ВИЧ-инфекцией и туберкулезом по сравнению с аналогичными показателями у здоровых добровольцев (p<0,05) — значимое утолщение СНВС в носовых секторах перипапиллярной области на 13,4–18,3% и увеличение толщины сетчатки во всех зонах макулярной области (фовеа — на 4%, парафовеа — на 6,6%, перифовеа — на 7,5%) сопровождались сужением калибра ретинальных артерий (на 12,1–16,8%) и увеличением калибра вен (на 15,1–7,7%), преимущественно темпоральных.
Представленные результаты исследования структур сетчатки и ретинальных сосудов с помощью метода ОКТ могут как отражать состояние микроциркуляции сетчатки на фоне патологического процесса (коинфекции ВИЧ/туберкулез, в том числе на фоне ВАРТ), так и служить предвестником дальнейших патологических изменений структур глаза и ЦНС. Для оценки значимости и изучения дальнейших изменений исследуемых параметров необходимо наблюдение представленных групп пациентов в динамике на протяжении не менее 6 мес. Таким образом, нами показана информативность и значимость метода ОКТ для оценки состояния сетчатки у пациентов с коинфекцией ВИЧ/туберкулез и туберкулезом на стадии доклинических изменений.
Сведения об авторах:
Бурылова Елена Анатольевна — к.м.н., ведущий научный сотрудник, группа координации научных исследований, врач-офтальмолог; ORCID iD 0000-0002-4440-4686.
Демин Алексей Петрович — врач-офтальмолог клинико-диагностического отделения; ORCID iD 0000-0003-2053-2103.
Скорняков Сергей Николаевич — д.м.н., заведующий научно-клиническим отделом; ORCID iD 0000-0003-0366-9634.
Сабадаш Елена Венидиктовна — к.м.н., старший научный сотрудник научно-клинического отдела; ORCID iD 0000-0003-4951-7708.
УНИИФ — филиал ФГБУ «НМИЦ ФПИ» Минздрава России. 620039, Россия, г. Екатеринбург, ул. 22-го Партсъезда, д. 50.
Контактная информация: Бурылова Елена Анатольевна, e-mail: science@urniif.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 07.09.2021.
About the authors:
Elena A. Burylova — C. Sc. (Med.), leading researcher, Group of Scientific Research Coordination, ophthalmologist; ORCID iD 0000-0002-4440-4686.
Aleksey P. Demin — ophthalmologist, Clinical Diagnostic Department; ORCID iD 0000-0003-2053-2103.
Sergey N. Skornyakov — Dr. Sc. (Med.), Head of Scientific Clinical Department; ORCID iD 0000-0003-0366-9634.
Elena V. Sabadash — C. Sc. (Med.), senior researcher, Scientific Clinical Department; ORCID iD 0000-0003-4951-7708.
Ural Scientific Research Institute of Phtysiopulmonology – Branch of the National Medical Research Center of Phthisiopulmonology and Infectious Diseases, 50, 22nd Pats’ezd str., Ekaterinburg, 620039, Russian Federation.
Contact information: Elena A. Burylova, e-mail: science@urniif.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 07.09.2021.
.
материал rmj.ru
