Введение
Сквозной макулярный разрыв (СМР) характеризуется полнослойным дефектом нейроретины в области фовеа и является одним из распространенных вариантов патологии витреомакулярного интерфейса преимущественно у пациентов старшего возраста и чаще у женщин [1]. В основе патогенеза СМР лежит тракционное воздействие стекловидного тела при его задней отслойке на область фовеа [2]. Но, помимо сквозного дефекта, при формировании СМР регистрируются вторичные изменения сетчатки вокруг зоны разрыва — интраретинальный отек с кистозными полостями, отслойка нейроретины по краю разрыва и нарушение структуры наружных слоев сетчатки, которые также влияют на функциональное состояние сетчатки [3–5]. В ряде работ [5–7] также отмечено изменение перфузии сетчатки при СМР.
Стандартом лечения СМР является проведение задней витрэктомии, при этом предложено много различных вариантов закрытия разрывов, учитывающих клинические особенности СМР [8]. Современные хирургические технологии позволяют добиваться анатомического закрытия СМР уже при первичном вмешательстве, особенно при малых и средних разрывах [9–12]. Однако хирургические техники не обеспечивают гарантированного высокого функционального результата, в связи с чем продолжается изучение различных предикторов успешного лечения СМР.
Такие показатели, как апикальный (минимальный) и базальный диаметр разрыва, минимальный дефект нейроретины на уровне эллипсоидной зоны, минимальное повреждение наружной пограничной мембраны и сохранение нормальной, по данным оптической когерентной томографии (ОКТ), морфологии сетчатки в области фовеа после закрытия разрыва являются важными предикторами функционального послеоперационного восстановления сетчатки [13–15]. Кроме того, для прогнозирования анатомического и функционального результата лечения предложены различные индексы на основе морфометрии при ОКТ: индекс макулярного разрыва, фактор формы разрыва, индекс диаметра разрыва, тракционный индекс разрыва [16, 17]. Тем не менее все они дают только ориентировочную прогностическую информацию, а на их расчеты могут оказывать влияние особенности выбора ОКТ-сканов и погрешности разметки и измерения. В то же время расширение возможностей мультимодальной визуализации с топографической интеграцией функциональных методов исследования может позволить не только расширить знания об особенностях патофизиологии СМР и послеоперационных процессах в сетчатке, но и получить прогностические модели, обладающие высокой предсказательной способностью.
Цель исследования: изучить взаимосвязь отдаленных результатов хирургического лечения СМР с предоперационными структурными и функциональными показателями с помощью мультимодального диагностического подхода.
Содержание статьи
Материал и методы
В когортное проспективное одноцентровое открытое исследование, выполненное в СПб филиале ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России, включили 104 пациента (104 глаза), средний возраст которых составил 64,5±6,5 года, с идиопатическими СМР II–IV стадии по D. Gass [1], которым хирургическое лечение провели впервые. Исследование выполнено в период 2022–2024 гг., соответствовало требованиям Хельсинкской декларации (в редакции 2003 г.), все участники подписывали информированное добровольное согласие на диагностическое обследование и хирургическое вмешательство.
Критерии включения: верифицированный диагноз идиопатический СМР, по поводу которого хирургическое лечение проводилось впервые.
Критерии исключения: помутнения оптических сред, препятствующие визуализации и проведению функционального тестирования, сопутствующая макулярная патология, глаукомная нейрооптикопатия, воспалительные и сосудистые заболевания, аномалии рефракции более 6 дптр, а также силиконовая тампонада как этап хирургического лечения, наличие атрофии пигментного эпителия сетчатки в зоне разрыва перед проведением хирургического лечения.
Хирургическое лечение СМР проводилось по стандартному протоколу задней витрэктомии с удалением внутренней пограничной мембраны, закрытием дефекта обогащенной тромбоцитами плазмой (PRP) или аутологичной кондиционированной плазмой (ACP) и газовоздушной тампонадой.
Обследование пациентов с использованием мультимодального подхода проводили перед хирургическим лечением, через 1, 3, 6 и 12 мес. после лечения.
Визометрия: исследование максимальной корригированной остроты зрения (МКОЗ) проводили в стандартных условиях с использованием проектора знаков Huvitz CCP-3100 (Huvitz, Корея).
Фундус-контролируемая микропериметрия: световую чувствительность (СЧ) в точке фиксации и площадь зоны фиксации исследовали с помощью микропериметра Compass (CenterVue, Италия) по протоколу 10–2 (68 точек и 1 точка фиксации, пороговая стратегия 4-2, ахроматический объект III по Гольдману, время предъявления стимула 200 мс). Результаты тестирования принимали для анализа при частоте ложноположительных и ложноотрицательных результатов менее 20%.
Биоэлектрическую активность сетчатки в фовеа исследовали с помощью мультифокальной электроретинографии (мфЭРГ) на электроретинографе «Нейро-ЭРГ» (Нейрософт, Россия), используя паттерн из 61 гексагона с угловыми размерами 17,9° на сетчатке, при этом учитывали латентность и амплитуду компонента Р1 в центральном гексагоне паттерна мфЭРГ, соответствующем фовеа.
ОКТ и ОКТ-ангиография (ОКТ-А): исследование структурных показателей и перфузии макулы осуществляли на приборе Solix (Optovue, США), используя протокол AngioVue Retina (6,4×6,4 мм). Количественный анализ таких структурных показателей, как апикальный и базальный диаметр разрыва, площадь кистозных изменений на уровне внутреннего ядерного (ВЯС) и наружного плексиформного слоя — слоя Генле (НПС+СГ), площадь дефекта эллипсоидной зоны проводили с помощью программы Image J по описанному ранее протоколу [5]. Анализ толщины комплекса ганглиозных клеток сетчатки в фовеа (КГКС), а также анализ показателей перфузии в зоне фовеа (площадь фовеальной аваскулярной зоны (ФАЗ), плотность сосудов в поверхностном и глубоком капиллярных сплетениях (ПКС и ГКС) в зоне фовеа в соответствии со схемой ETDRS)) осуществлялся автоматически в программном обеспечении прибора (AngioVue Analysis SW Ver: 11.0.0.29946). При анализе использовали изображения с качеством не ниже Q8, сегментация слоев сетчатки проводилась прибором автоматически.
Статистический анализ выполнен в DATAtab: Online Statistics Calculator (DATAtab e.U. Graz, Австрия). Количественные результаты представлены в формате M±SD. Оценку нормальности распределения в анализируемых выборках проводили с помощью теста Колмогорова — Смирнова. Сравнение показателей до и после хирургического лечения проводили с помощью t-критерия Стьюдента для связанных выборок. Для определения связи между значениями функциональных и структурных параметров, показателей перфузии до хирургического лечения, а также их изменения в течение 12 мес. после закрытия разрыва и функциональными показателями через 12 мес. после лечения использовали расчет коэффициента корреляции Пирсона, а также проводили множественный регрессионный анализ. Статистически значимыми считали результаты с уровнем значимости p<0,05.
Результаты исследования
Общая характеристика группы представлена в таблице 1. В группе преобладали СМР IV стадии по D. Gass и преимущественно средние разрывы. Длительность симптомов составила 0,5–14 мес. Кистозные изменения вокруг разрыва были выявлены во всех случаях, при этом на уровне НПС+СГ полости имели более мелкокистозный характер с большей площадью, а на уровне ВЯС имели звездообразный паттерн. Площадь ФАЗ была увеличена в сравнении с парными глазами (0,32±0,09 и 0,25±0,08 мм2 соответственно, p<0,001), а плотность сосудов уменьшена как на уровне ПКС (21,43±6,13 и 28,93±5,61% соответственно, p<0,001), так и на уровне ГКС (20,96±4,77 и 29,94±5,72% соответственно, p<0,001).

Хирургическое лечение было проведено в соответствии с протоколом, без интра- и послеоперационных осложнений, во всех случаях закрытие разрыва было достигнуто при первичном вмешательстве, рецидивов СМР в течение периода наблюдения не было. После проведения хирургического лечения не было выявлено признаков повреждения слоя пигментного эпителия сетчатки ни в одном из случаев.
По данным визометрии, исходные показатели МКОЗ составили 0,25±0,13, через 1 мес. после закрытия разрыва увеличились до 0,42±0,17 (p=0,001) (рис. 1) и в дальнейшем в течение 12 мес. достигли уровня 0,65±0,24 (p<0,001). При проведении микропериметрии, СЧ в точке фиксации до лечения составляла 14,22±10,56 дБ, через 1 мес. значимо увеличилась до 26,06±4,07 дБ (р=0,001), а через 12 мес. составила 29,69±4,33 дБ (р<0,001). Одновременно значимо уменьшилась площадь зоны фиксации с 14,1±12,8о2 до операции до 4,68±4,04о2 через 12 мес. после лечения (p=0,001). Показатели биоэлектрической активности в зоне фовеа, по данным мфЭРГ, также значимо изменились в послеоперационном периоде: латентность Р1 снизилась с 52,88±5,49 мс перед операцией до 51,51±3,43 мс через 12 мес. после закрытия СМР (р=0,005), амплитуда Р1 в течение того же периода увеличилась с 0,24±0,14 мкВ до 0,47±0,15 мкВ (р<0,001).
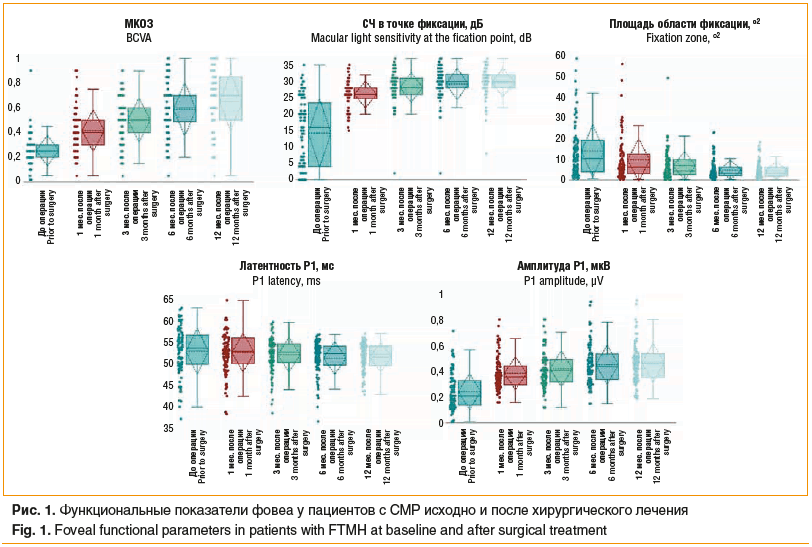
Средняя толщина КГКС в фовеа после хирургического закрытия разрыва значимо увеличилась с 56,2±6,34 до 63,57±7,57 мкм через 1 мес. (p<0,001) (рис. 2), а в дальнейшем уменьшилась, но через 12 мес. после лечения оставалась более высокой, чем в предоперационном периоде (58,61±8,23 мкм, р=0,003). Площадь дефекта эллипсоидной зоны, составляя до лечения 0,58±0,38 мм2, в послеоперационном периоде значимо уменьшалась в течение всего периода наблюдения и через 12 мес. составила 0,10±0,14 мм2 (р<0,001).
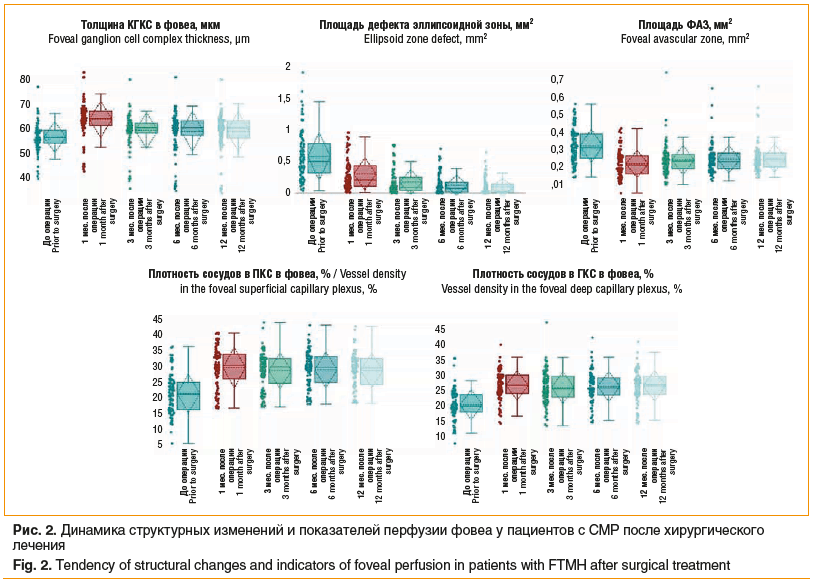
При анализе показателей перфузии фовеа выявлено значимое уменьшение площади ФАЗ с 0,32±0,1 мм2 до закрытия разрыва до 0,22±0,08 мм2 через 1 мес. (p<0,001) (см. рис. 2). В дальнейшем площадь ФАЗ незначительно увеличилась и составила через 12 мес. 0,25±0,08 мм2. Плотность сосудов в ПКС и ГКС в проекции фовеа в течение первого месяца после закрытия разрыва значимо увеличилась с 21,43±6,13% и 20,96±4,77% до 29,68±6,43% и 27,19±4,73% соответственно (p=0,001), при этом в дальнейшем в течение 12 мес. показатели значимо не изменились, составив к концу периода наблюдения 28,72±5,48% в ПКС и 27,04±4,94% в ГКС соответственно (p=0,532 и p=0,643).
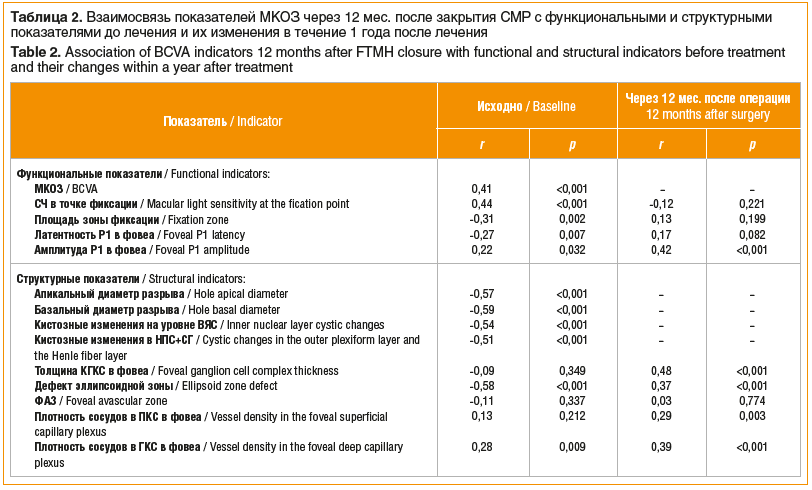
При анализе взаимосвязи значений МКОЗ через 1 год после операции с предоперационными функциональными и структурными показателями выявлена слабая корреляция с показателями биоэлектрической активности и плотностью сосудов в ГКС в фовеа, умеренная корреляция с уровнем МКОЗ, СЧ в точке фиксации и площадью зоны фиксации, а также высокая корреляция с апикальным и базальным диаметром разрыва, площадью интраретинальных кистозных изменений и площадью дефекта эллипсоидной зоны (табл. 2). Уровень МКОЗ через 1 год значимо коррелировал с изменением в течение года после закрытия СМР таких показателей, как амплитуда Р1, толщина КГКС в фовеа, площадь дефекта эллипсоидной зоны и плотность сосудов в ПКС и ГКС в фовеа.
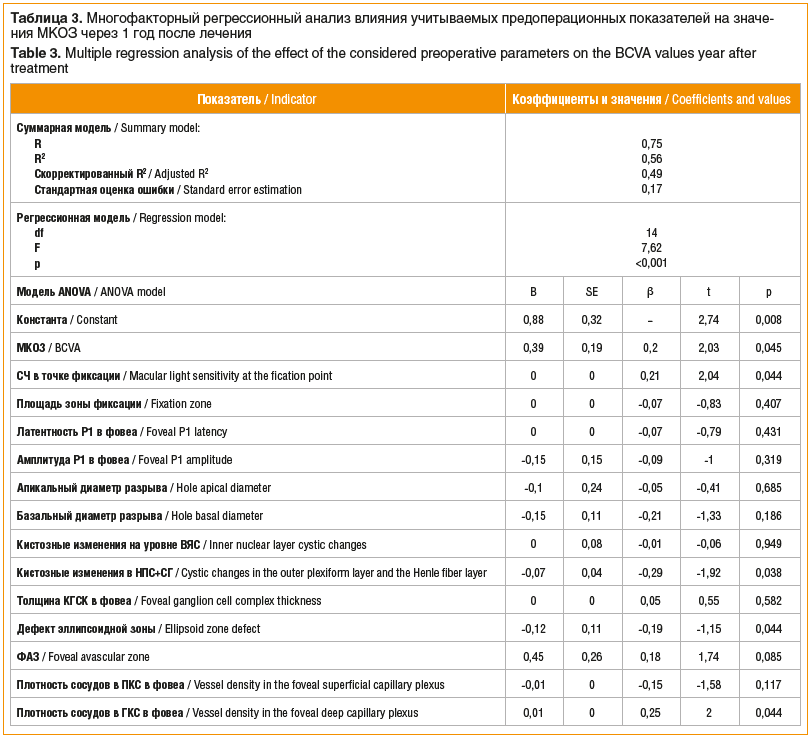
Влияние исходных (предоперационных) функциональных и структурных параметров на степень улучшения МКОЗ через год после хирургического закрытия СМР было дополнительно изучено с помощью модели множественной регрессии (табл. 3). При проведении анализа получена статистически значимая регрессионная модель (F=7,62, p<0,001), при этом учитываемые независимые переменные (предоперационные показатели) объясняют 56,0% дисперсии зависимой переменной (значение МКОЗ через 12 мес.) с возможным отклонением прогноза в среднем на 0,17 единицы от фактических значений. Скорректированный коэффициент детерминации R2 составил 0,49, что также указывает на высокое прогностическое значение модели. Согласно полученной регрессионной модели наибольшее влияние на итоговую МКОЗ оказывают такие параметры, как предоперационные МКОЗ (β=0,2, p=0,045), СЧ в точке фиксации (β=0,21, p=0,044), площадь кистозных изменений в НПС+СГ (β=-0,29, p=0,038), площадь дефекта эллипсоидной зоны (β=-0,19, p=0,044) и плотность сосудов в ГКС (β=0,25, p=0,044).
Обсуждение
В проведенном исследовании мультимодальный подход позволил получить расширенный спектр функциональных и структурных характеристик зоны фовеа при СМР, а также изучить их изменения в послеоперационном периоде.
Показатель МКОЗ, хотя и является субъективно определяемым параметром, зависящим от множества факторов (состояние оптических сред сетчатки и зрительного анализатора в целом) и не характеризующим все особенности функционального состояния сетчатки, тем не менее служит основным клиническим критерием функционального успеха проводимого лечения. В исследовании наиболее значимая связь итоговой МКОЗ отмечена с ее исходными значениями, что соответствует полученным ранее данным [16, 18, 19]. В то же время выявленная корреляция не позволяет рассматривать предоперационный уровень МКОЗ как единственный и достаточный для прогнозирования предиктор.
Определяемая при фундус-контролируемой микропериметрии локальная СЧ более точно характеризует функциональное состояние фовеа, при этом в проведенном исследовании исходная СЧ в точке фиксации, в сравнении с исходной МКОЗ, имела более выраженную корреляцию с итоговым значением МКОЗ, а также оказалась более сильным предиктором, по данным многофакторного регрессионного анализа. Площадь зоны фиксации позволяет судить о степени сохранности центральной фиксации, а ее уменьшение после закрытия разрыва, выявленное в работе, также свидетельствовало о восстановлении функций фовеа в послеоперационном периоде.
В качестве объективных функциональных предикторов в работе были изучены показатели локальной био-электрической активности сетчатки — амплитуда и латентность Р1, регистрируемые в зоне фовеа. Ранее нами было показано, что при СМР происходит значимое снижение амплитуды и увеличение латентности Р1, более выраженные в зонах сетчатки вокруг разрыва, в которых были вторичные структурные изменения — интраретинальные кистозные изменения, отслойка нейроэпителия [20]. В то же время результаты данного исследования показали, что при закрытии разрыва биоэлектрическая активность восстанавливается, при этом степень увеличения в течение года амплитуды Р1 коррелирует с итоговой МКОЗ, а также согласуется со структурным восстановлением сетчатки.
Такие структурные показатели, как размеры разрыва, определяемые по данным ОКТ, являются известным предиктором анатомического и функционального результата хирургического лечения СМР: на их основе разработаны применяемые в клинической практике индексы [16, 17, 21]. Тем не менее, несмотря на наблюдаемые в данной работе корреляционные связи итоговой МКОЗ с диаметром разрыва, по данным многофакторного регрессионного анализа, в выборке, состоящей преимущественно из разрывов среднего диаметра, эти параметры оказали меньшее влияние на итоговую МКОЗ.
Интраретинальные кистозные изменения в различных слоях сетчатки относятся ко вторичным изменениям при СМР, при этом их наличие и площадь позволяют косвенно судить о длительности существования разрыва [22, 23]. Кроме того, нами ранее было показано, что площадь кистозных изменений коррелирует с такими функциональными показателями, как СЧ и амплитуда Р1 [20]. В данной работе выявлена значимая корреляция площади кист на уровне ВЯС и НПС+СГ с итоговой МКОЗ, а при проведении многофакторного регрессионного анализа площадь кист на уровне НПС+СГ оказала более значимое влияние на МКОЗ через 1 год после закрытия разрыва.
Наличие дефекта эллипсоидной зоны служит важным прогностическим критерием при лечении различной патологии макулы, в том числе ранее было показано значение этого показателя и при СМР [13, 14]. Результаты проведенной работы также согласуются с опубликованными данными, при этом МКОЗ через 1 год после лечения значимо связана не только с исходной площадью дефекта эллипсоидной зоны в фовеа, но и с ее изменением в течение послеоперационного периода.
Толщина комплекса ганглиозных клеток сетчатки рассматривается как еще один предиктор функционального восстановления макулы после проведения хирургического лечения СМР — большая сохранность внутренних слоев сетчатки после хирургии обосновывает технологии хирургического лечения с сохранением внутренней пограничной мембраны [12]. При этом как результаты исследования, так и опубликованные ранее нами данные [24] свидетельствуют о том, что значение имеет не исходная толщина КГКС, а ее изменение в послеоперационном периоде: чем меньше фиксируемая при ОКТ толщина, тем ниже МКОЗ в отдаленные сроки.
Показатели перфузии, регистрируемые при выполнении ОКТ-А, являются новым и малоизученным инструментом в разработке прогностических моделей лечения не только СМР, но и другой патологии макулы. В проведенных ранее работах, в том числе нами, было выявлено, что при СМР регистрируется снижение перфузии в капиллярных сплетениях вокруг разрыва, преимущественно в ГКС, что, вероятно, обусловлено кистообразованием со смещением и механическим сдавлением капилляров, при этом существует корреляция между значениями плотности сосудов и СЧ и показателями биоэлектрической активности [5, 23]. Результаты настоящей работы согласуются с имеющимися сведениями, а по данным многофакторного регрессионного анализа, из используемых показателей перфузии наибольшее значение для прогнозирования МКОЗ через 1 год после лечения имеет плотность сосудов в ГКС в зоне фовеа.
В целом использование предоперационных показателей позволило построить значимую регрессионную модель с высоким прогностическим потенциалом, при этом увеличение выборки и включение дополнительных параметров в будущем может еще увеличить возможности прогнозирования функциональных результатов хирургии СМР. Кроме того, использованный мультимодальный подход в дальнейшем может быть апробирован и в отношении отдельных хирургических техник или клинических ситуаций.
Исследование имеет ограничения. В частности, в исследование хотя в ходе последовательного набора, но были включены преимущественно первичные разрывы среднего диаметра, поэтому результаты анализа нельзя в полной мере экстраполировать на большие разрывы, а также случаи вторичных разрывов. Еще одним ограничением является возможное различие в технике закрытия разрыва разными витреоретинальными хирургами, хотя все пациенты прооперированы двумя операторами, а величина выборки является достаточной для корректного статистического анализа. Также не были учтены тип закрытия разрыва и возможные изменения состояния пигментного эпителия сетчатки в послеоперационном периоде, но в рамках прогностических моделей нами был сделан акцент именно на предоперационных параметрах, которые в перспективе могут помочь выбрать оптимальный вариант вмешательства.
Заключение
Для прогнозирования функциональных результатов хирургического лечения СМР может быть использован комплекс функциональных и структурных показателей, получаемых с применением инструментов мультимодальной визуализации, при этом наиболее значимыми предикторами являются, помимо исходной МКОЗ, СЧ в точке фиксации, кистозные изменения на уровне НПС+СГ, площадь дефекта эллипсоидной зоны и плотность сосудов в ГКС. Мультимодальный подход может позволить в дальнейшем проводить более всесторонний анализ и сравнение применяемых и разрабатываемых хирургических техник закрытия СМР.
Сведения об авторах:
Докторова Таисия Александровна — врач-офтальмолог СПб филиала ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 192283, Россия, г. Санкт-Петербург, ул. Ярослава Гашека, д. 21; ORCID iD 0000-0003-2162-4018
Бойко Эрнест Витальевич — д.м.н., профессор, директор СПб филиала ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 192283, Россия, г. Санкт-Петербург, ул. Ярослава Гашека, д. 21; заведующий кафедрой офтальмологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; Санкт-Петербургский государственный университет; 199034, Россия, г. Санкт-Петербург, Университетская наб., д. 7–9; ORCID iD 0000-0002-7413-7478
Суетов Алексей Александрович — к.м.н., врач-офтальмолог СПб филиала ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 192283, Россия, г. Санкт-Петербург, ул. Ярослава Гашека, д. 21; ORCID iD 0000-0002-8670-2964
Сосновский Сергей Викторович — к.м.н., доцент, заместитель директора СПб филиала ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 192283, Россия, г. Санкт-Петербург, ул. Ярослава Гашека, д. 21; ORCID iD 0000-0001-8969-6240
Контактная информация: Докторова Таисия Александровна, e-mail: ophtalm@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 17.06.2025.
Поступила после рецензирования 10.07.2025.
Принята в печать 04.08.2025.
About the authors:
Taisiya A. Doktorova — ophthalmologist, St. Petersburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 21, Yaroslav Gashek str., 192283, St. Petersburg, Russian Federation; ORCID iD 0000-0003-2162-4018
Ernest V. Boyko — Dr. Sc., (Med.), Professor, Director of the St. Petersburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 21, Yaroslav Gashek str., 192283,
St. Petersburg, Russian Federation; Head of the Department of Ophthalmology, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; St. Petersburg State University;
7–9, Universitetskaya nab., St. Petersburg, 199034, Russian Federation; ORCID iD 0000-0002-7413-7478
Alexey A. Suetov — C. Sc. (Med.), ophthalmologist, St. Petersburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 21, Yaroslav Gashek str., 192283, St. Petersburg, Russian Federation; ORCID iD 0000-0002-8670-2964
Sergey V. Sosnovsky — C. Sc. (Med.), Associate Professor, Deputy Director of the St. Petersburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 21, Yaroslav Gashek str., 192283, St. Petersburg, Russian Federation; ORCID iD 0000-0001-8969-6240
Contact information: Taisiya A. Doktorova, e-mail: ophtalm@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
Conflict of interest: no conflict of interest.
Received 17.06.2025.
Revised 10.07.2025.
Accepted 04.08.2025.
материал rmj.ru
