Введение
Возрастная макулярная дегенерация (ВМД) в экономически развитых странах является одной из причин инвалидности по зрению среди населения старше 65 лет и третьей по распространенности причиной слепоты в мире. В частности, прогнозируется, что заболеваемость ВМД в ближайшие годы резко возрастет, что подчеркивает острую необходимость в эффективных стратегиях лечения [1, 2].
Возрастная макулярная дегенерация — это прогрессирующее заболевание глаз, которое в первую очередь поражает пожилых людей, приводя к значительной потере зрения и ухудшению состояния сетчатки и сосудистой оболочки [3, 4]. Классификация ВМД по Age-Related Eye Disease Study (AREDS) [5] выделяет 4 категории заболевания в зависимости от выраженности патологических изменений.
Категория 1 (отсутствие ВМД): отсутствие изменений, небольшое количество мелких друз (диаметр <63 мкм).
Категория 2 (ранняя стадия ВМД): множественные мелкие друзы, небольшое число друз среднего размера (диаметр от 63 до 124 мкм) или начальные изменения пигментного эпителия сетчатки.
Категория 3 (промежуточная стадия ВМД): множество друз среднего размера, по крайней мере, одна большая друза (диаметр ≥125 мкм) или очаги географической атрофии, не затрагивающие центральную ямку.
Категория 4 (поздняя стадия ВМД): характеризуется одним или несколькими из следующих признаков (при отсутствии других причин):
очаги географической атрофии, затрагивающие центральную зону сетчатки;
макулярная неоваскуляризация с различными проявлениями (отслойкой нейроэпителия и/или пигментного эпителия, отеком нейроэпителия, геморрагиями, твердыми (липидными) экссудатами и др.), образованием рубцово-атрофических изменений.
С возрастом уменьшается количество оксикаротиноидов, которые участвуют в антиоксидантной защите сетчатки. В результате продукты перекисного окисления липидов активно накапливаются в наружных слоях сетчатки [4, 6, 7]. Поэтому ВМД дебютирует с «сухой» формы, которая характеризуется формированием друз, их слиянием и последующими атрофическими изменениями в нейроэпителии и хориокапиллярах, которые приводят к образованию участков географической атрофии. В дальнейшем друзы прогрессируют с формированием новообразованных сосудов в слое хориокапилляров и развивается «влажная» форма ВМД [7–11].
«Влажная» форма ВМД (категория 4 AREDS) с успехом лечится анти-VEGF-препаратами, которые, несмотря на свою эффективность, требуют частых инъекций и имеют ограничения, что подчеркивает необходимость поиска инновационных терапевтических возможностей [12–14]. Однако единого подхода в консервативном лечении «сухой» формы ВМД (категории 2–3 AREDS) в современной офтальмологии к настоящему времени не существует [15].
В то же время известно, что необходимым условием нормального функционирования ферментных систем, обеспечивающих обмен веществ в тканях глаза и высокую антиоксидантную защиту, является достаточный уровень цитомединов. Цитомедины — это вещества полипептидной природы, получаемые из различных органов и тканей (головного мозга, сетчатки, кровеносных сосудов, сердца, легких, печени, поджелудочной железы, вилочковой железы, предстательной железы и др.) и используемые для лечения различных заболеваний [16, 17]. Эти вещества выступают в роли биорегуляторов и принимают участие в межклеточном и тканевом взаимодействии, а также в процессах метаболизма тканей и дифференцировки клеточных популяций. Именно поэтому использование цитомединов при ВМД патогенетически оправдано, поскольку их антиоксидантные и ретинопротективные свойства предотвращают дистрофические процессы в пигментном эпителии, хориокапиллярах, мембране Бруха и фоторецепторных клетках центральной области глазного дна, способствуя улучшению зрительных функций [18].
Пептидные биорегуляторы, которые представляют собой короткие цепочки аминокислот, полученных из тканей животных, привлекли внимание своим потенциалом для усиления клеточной регенерации и процессов восстановления в сетчатке [19–23]. Они взаимодействуют с клеточными рецепторами, модулируя физиологические функции, потенциально предлагая новый терапевтический путь для пациентов с переходной ВМД [24–26].
Среди них особое место занимает Ретиналамин® — пептидный биорегулятор, полученный из сетчатки глаз животных и демонстрирующий нейропротективные, антиоксидантные и регенеративные свойства.
Ранние клинические исследования по изучению эффективности и безопасности применения пептидных биорегуляторов при ряде офтальмологических заболеваний, в том числе глаукоме, диабетической ретинопатии, ВМД, показали, что пептидные биорегуляторы могут усиливать клеточный метаболизм и защищать клетки сетчатки от окислительного повреждения, потенциально стабилизируя или улучшая остроту зрения, способствуя здоровью клеток сетчатки и устраняя основные патофизиологические механизмы, такие как воспаление и окислительный стресс, связанные с прогрессированием ВМД [27, 28].
Цель исследования: оценить эффективность применения пептидных биорегуляторов на основе анализа функциональных и структурных показателей у пациентов с переходными формами ВМД (категории 2–3 AREDS). Именно эти стадии представляют наибольший интерес с точки зрения и возможной профилактики прогрессирования до более тяжелых форм заболевания.
Содержание статьи
Материал и методы
Проспективное одноцентровое клиническое исследование проводилось на базе кафедры факультетской терапии им. академика А.И. Нестерова ИКМ ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет) в период с октября 2023 г. по апрель 2025 г. Исследование было одобрено локальным этическим комитетом. Все пациенты подписали добровольное информированное согласие.
Критерии включения:
пациенты обоих полов в возрасте 60–80 лет;
установленный диагноз на исследуемом глазу «сухой» формы ВМД, промежуточных стадий (категории 2–3 AREDS) и наличие на парном глазу «влажной» формы ВМД в виде активной хориоидальной неоваскуляризации или исхода «влажной» формы ВМД.
Критерии невключения:
установленный диагноз или впервые выявленная диабетическая ретинопатия;
перенесенная в анамнезе окклюзия центральной артерии или центральной вены сетчатки;
значимое нарушение прозрачности оптических сред (препятствующее проведению диагностическим процедурам) на исследуемом глазу;
любые офтальмохирургические операции, планируемые на момент проведения исследования, и отсутствие оперативного лечения за последние 3 мес.;
наличие острой или хронической офтальмопатологии.
В исследовании приняли участие 34 пациента (сила выборки равна 0,8) в возрасте от 60 до 80 лет (медиана 68 лет). Большинство составили женщины — 23 (67,65%) человека.
Всем пациентам до начала лечения и в процессе исследования проводили комплекс диагностических исследований:
визометрию — определение максимально корригированной остроты зрения (МКОЗ) с помощью таблицы Сивцева;
биомикроскопию передних структур глаза, осмотр глазного дна обоих глаз с использованием щелевой лампы и бесконтактной асферической линзы VOLK 90 D;
пневмотонометрию — измерение внутриглазного давления (ВГД);
оценку контрастной чувствительности исследуемого глаза по таблице Пелли — Робсона;
оптическую когерентную томографию (ОКТ) центральной зоны сетчатки обоих глаз на аппарате Topcon 3D OCT-1 Maestro.
С помощью ОКТ оценивали следующие параметры: количество друз, размер (диаметр и высота) друз (расчет проводили с использованием линейного инструмента), общую площадь друз (расчет выполняли с использованием обводки контура).
Всем пациентам лечение проводилось препаратом Ретиналамин® (5 мг), растворенным в 2 мл 0,9% NaCl, который вводили внутримышечно. Курс лечения — 10 дней ежедневных инъекций. Повторные курсы проводили с интервалом в 3–4 мес., все пациенты получили 5 курсов лечения.
Контрольные обследования проводили до начала лечения и после каждого курса терапии. Общий период наблюдения составил 19 мес.
После каждого курса лечения рассчитывали средние значения МКОЗ и контрастной чувствительности по шкале Пелли — Робсона. Кроме того, проводилась классификация индивидуальных результатов в соответствии с категориями: «улучшение», «стабильно» и «ухудшение». В категорию «улучшение» относили случаи увеличения функциональных показателей (МКОЗ и контрастная чувствительность) на 5% и более от исходного значения; «ухудшение» фиксировалось при снижении этих показателя на 5% и более от исходного значения; изменения показателя в пределах±5% от исходного значения относились к категории «стабильно».
Статистическую обработку полученных результатов осуществляли в программе Statistica 13.3 (Tibco Software Inc., США). Данные пациентов были внесены в электронную таблицу Excel. Перед проведением сравнительного анализа была выполнена проверка нормальности распределения полученных данных. Для оценки нормальности применяли критерий Шапиро — Уилка, визуальный анализ гистограмм, показатели асимметрии и эксцесса. Распределение в большинстве случаев соответствовало нормальному, в связи с чем для оценки достоверности изменений использовали парный t-критерий Стьюдента. Статистическую значимость изменений оценивали по p-значению с уровнем значимости α=0,05. Изменения считали статистически значимыми при p<0,05.
Результаты исследования
В результате проведенного исследования были получены данные о динамике функциональных и структурных показателей у пациентов с переходными формами ВМД (категории 2–3 AREDS) на фоне лечения пептидным биорегулятором.
Динамика функциональных показателей. По завершении курса лечения улучшение МКОЗ наблюдалось у 18 (52,9%) пациентов, стабилизация показателей — у 16 (47,1%). Случаев ухудшения зрительных функций не наблюдалось. МКОЗ статистически значимо улучшилась с 0,61±0,10 до 0,67±0,11 (p<0,001, парный t-критерий). Значимый эффект появлялся к 3–4-му курсу (табл. 1).
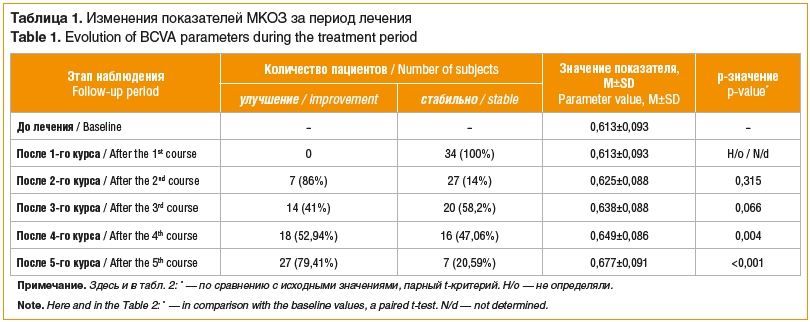
По завершении курса лечения улучшение контрастной чувствительности наблюдалось у 26 (76,5%) пациентов, стабилизация показателей — у 8 (23,5%). Случаев ухудшения зрительных функций не отмечено. Контрастная чувствительность по шкале Пелли — Робсона статистически значимо улучшилась с 147,6±17,2 до 160,3±16,8 (p<0,001). Значимый эффект также появлялся к 3–4-му курсу (табл. 2).

Динамика структурных показателей. У всех пациентов до лечения были обнаружены как минимум одна крупная друза (диаметр ≥125 мкм) или локализованные участки атрофии пигментного эпителия сетчатки вместе с множественными мелкими друзами и друзами среднего размера (диаметр от 63 до 124 мкм) без резкого снижения остроты зрения (средняя острота 0,5–0,7).
По завершении 5-курсового лечения уменьшение количества мелких и средних друз наблюдалось у 6 (17,6%) пациентов, стабилизация морфологических характеристик — у 28 (82,4%). Случаев прогрессирования друзообразования не зафиксировано. Уменьшение высоты и площади крупных друз отмечено у 17 (50,0%) пациентов, стабилизация морфометрических параметров — у 17 (50,0%). Прогрессирования размеров крупных друз не наблюдалось.
Положительная динамика морфологических характеристик друз (уменьшение размеров и/или количества) зафиксирована у 23 (67,6%) пациентов, стабилизация процесса — у 11 (32,4%). Ни в одном случае не отмечено прогрессирования друзообразования или увеличения размеров существующих друз, что свидетельствует о стабилизирующем эффекте проводимой терапии на дегенеративные процессы в сетчатке.
За весь период наблюдения (19 мес.) ни у одного пациента не было выявлено значимых изменений при оценке ВГД и биомикроскопии глаза. Также не наблюдалось развития «влажной» формы ВМД на исследуемом глазу.
Следует отметить хорошую переносимость препарата, системных и местных побочных эффектов не наблюдалось.
Обсуждение
Результаты проведенного исследования демонстрируют положительное влияние пептидных биорегуляторов на функциональные и структурные показатели у пациентов с переходными формами ВМД (AREDS 2–3). Полученные данные согласуются с ранее опубликованными работами, показывающими эффективность пептидных биорегуляторов при различных дегенеративных заболеваниях сетчатки [27–41].
Так, в исследовании под руководством Н.Н. Нероева, проведенном в 2016 г., была проведена оценка эффективности применения внутримышечных инъекций Ретиналамина с различными стадиями «сухой» формы ВМД, кратность курсов лечения составила 1 и 2 раза в течение полугода. В 80% случаев с начальной и промежуточной стадией ВМД после курса Ретиналамина по данным мультифокальной электроретинографии выявлена положительная динамика функционального состояния сетчатки, которая была максимальной через 2 мес. после лечения. Повторный курс препарата (через 3 мес.) сопровождался более выраженным повышением функциональных показателей с наибольшим эффектом на 5-й месяц наблюдения. Более чем в 70% случаев атрофической формы ВМД положительная динамика макулярной функции отмечена только после повторного курса инъекций с максимальным проявлением лечебного эффекта на 5-й месяц наблюдения [39].
Опираясь на эти данные, наше исследование было направлено на углубленное изучение терапевтического эффекта пептидных биорегуляторов с акцентом на переходные стадии ВМД (AREDS 2–3), имеющие ключевое значение для профилактики прогрессирования заболевания. В отличие от работы Н.Н. Нероева и соавт. [39], мы проводили долгосрочное наблюдение (19 мес.) с многоэтапной схемой из 5 курсов, что позволило выявить кумулятивный эффект препарата. Наряду с традиционными функциональными показателями (МКОЗ), в критерии оценки мы впервые включили контрастную чувствительность и количественные морфометрические характеристики друз по данным ОКТ, что обеспечило современный и объективный подход. Нами впервые продемонстрировано не только улучшение функционального состояния сетчатки, но и положительная динамика ее морфологических изменений, что расширяет представления о терапевтическом и профилактическом потенциале пептидных биорегуляторов при переходных формах ВМД и обосновывает их применение в клинической практике.
Также, согласно результатам метаанализа клинических исследований эффективности ретинопротективной терапии «сухой» формы ВМД, проведенного на основе 11 российских публикаций за период 2006–2017 гг., было установлено, что 3-месячный срок оценки результатов является переломным моментом для определения необходимости в проведении повторного курса терапии, так как он способствует увеличению и пролонгации положительного эффекта при различных стадиях ВМД [42].
Опираясь на данные литературы и собственный опыт, можно рекомендовать следующую схему применения препарата пептидных биорегуляторов (Ретиналамин®) при переходной форме ВМД: курс внутримышечных инъекций (5 мг в течение 10 дней) с повторением через 3–4 мес. Число курсов должно составлять не менее 5 в течение 18–20 мес., что обеспечит выраженный и пролонгированный терапевтический эффект. Регулярное применение препарата в рамках многоэтапной схемы позволяет достичь не только функционального, но и морфологического улучшения у пациентов с ранними и промежуточными стадиями ВМД.
Особый интерес представляют полученные данные о влиянии пептидных биорегуляторов на структурные изменения сетчатки. Уменьшение количества и размера друз, а также общей площади поражения, наблюдавшееся у значительной части пациентов, может свидетельствовать о способности пептидных биорегуляторов влиять на процессы утилизации продуктов перекисного окисления липидов и других метаболитов, накапливающихся в друзах. ОКТ остается ключевым неинвазивным методом визуализации для мониторинга морфологических изменений при ВМД. С появлением спектрально- и поляризационно-чувствительных модификаций ОКТ стало возможно количественно оценивать такие параметры, как объем друз, толщина нейросенсорной сетчатки и характеристики ретинального пигментного эпителия, что повышает точность стратификации риска. Ранее F.G. Schlanitz et al. [43] показали, что динамика объема друз, оцененная с помощью ОКТ, может служить ранним маркером прогрессирования ВМД и предшествовать развитию как неоваскулярной формы, так и гео-графической атрофии. Таким образом, количественный анализ структурных изменений по данным ОКТ приобретает все большее значение в ранней диагностике и индивидуализации наблюдения пациентов с ВМД.
Исследование, проведенное в 2020 г. под руководством T.J. Heesterbeek, также показало, что количественный анализ объeма друз с помощью спектральной ОКТ имеет независимую прогностическую значимость: чем больше исходный объем друз, тем выше вероятность перехода в позднюю стадию ВМД в течение двух лет. В комбинации с другими ОКТ-биомаркерами — гиперрефлективными фокусами, ретикулярными псевдодрузами — оценка объема друз обеспечивает целостное представление о морфологии сетчатки и раннее прогнозирование индивидуального риска прогрессирования [44]. Полученные в настоящем исследовании результаты согласуются с вышеизложенными данными литературы о прогностическом значении структурных изменений сетчатки. Положительная динамика, зафиксированная нами по данным ОКТ (уменьшение размеров и количества друз, стабилизация морфометрических параметров), подтверждает выводы F.G. Schlanitz et al. [43] о том, что количественный анализ морфологических изменений может служить ранним маркером прогрессирования ВМД. Таким образом, терапия пептидными биорегуляторами не только положительно влияет на функциональные показатели, но и способствует стабилизации структурных параметров сетчатки, что подтверждает их патогенетическую направленность и перспективность в профилактике прогрессирования заболевания.
Следует отметить, что наше исследование имеет ряд ограничений. Во-первых, относительно небольшой размер выборки (34 пациента) не позволяет с высокой достоверностью экстраполировать полученные результаты на всю популяцию пациентов с ВМД. Во-вторых, отсутствие контрольной группы затрудняет оценку эффективности лечения в сравнении с естественным течением заболевания. В-третьих, период наблюдения (19 мес.), хотя и является достаточно длительным для оценки краткосрочных результатов, не позволяет сделать однозначные выводы о долгосрочной эффективности терапии.
Тем не менее полученные результаты демонстрируют перспективность применения пептидных биорегуляторов в качестве патогенетически обоснованного метода лечения переходных форм ВМД и обосновывают необходимость проведения дальнейших исследований в этой области.
Заключение
Проведенное проспективное клиническое исследование обосновывает патогенетическую направленность терапии пептидными биорегуляторами при ВМД категории 2–3 AREDS. Выявленная способность пептидных биорегуляторов влиять как на функциональные параметры зрения, так и на морфологические характеристики дегенеративных изменений сетчатки подтверждает, что данный класс препаратов воздействует на ключевые механизмы патогенеза заболевания, а не ограничивается симптоматическим эффектом.
Установлен принцип кумулятивности терапевтического воздействия пептидных биорегуляторов. Эффективность препарата реализуется через множественные курсы лечения, что указывает на необходимость пересмотра традиционных подходов к краткосрочной терапии дегенеративных заболеваний сетчатки в пользу долгосрочных терапевтических стратегий.
Доказан профилактический потенциал данного направления терапии. Отсутствие случаев прогрессирования заболевания и перехода в неоваскулярную форму у пациентов высокого риска свидетельствует о возможности использования пептидных биорегуляторов в качестве превентивной меры, направленной на предотвращение развития тяжелых осложнений ВМД.
Различная степень ответа пациентов на лечение указывает на перспективы персонализированного подхода к терапии ВМД и необходимость разработки критериев стратификации больных для оптимизации схем применения пептидных биорегуляторов.
Совокупность полученных данных формирует научную основу для включения пептидных биорегуляторов в стандарты оказания медицинской помощи пациентам с переходными формами ВМД и определяет направления дальнейших исследований в области ретинопротективной терапии дегенеративных заболеваний сетчатки.
Сведения об авторах:
Егоров Алексей Евгеньевич — д.м.н., профессор, заведующий офтальмологическим отделением ГБУЗ МО «ПОКБ», ОСП № 4; 142133, Россия, г. Подольск, мкр. Кузнечики, Парковый пр-д, д. 9, к. 1; профессор кафедры офтальмологии им. акад. А.П. Нестерова Института клинической медицины ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-2637-1830
Иванова Ксения Сергеевна — аспирант кафедры офтальмологии им. акад. А.П. Нестерова лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1.
Контактная информация: Иванова Ксения Сергеевна, e-mail: ksushanja111@gmail.com
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 26.06.2025.
Поступила после рецензирования 17.06.2025.
Принята в печать 29.07.2025.
About the authors:
Alexey E. Egorov — Dr. Sc. (Med.), Professor, Head of the Ophthalmological Department, Podolsk Regional Clinical Hospital, Separate Structural Division no. 4; building 1, 9, mcr. dstr. Kuznechiki, Park ave., Podolsk, 142133, Russian Federation; Professor of the Acad. A.P. Nesterov Department of Ophthalmology, Faculty of General Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0003-2637-1830
Kseniya S. Ivanova — Postgraduate Student of the Academician A.P. Nesterov Department of Ophthalmology, Faculty of General Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 26.06.2025.
Revised 17.07.2025.
Accepted 29.07.2025.
материал rmj.ru
