Введение
Термин «акантолитическая пузырчатка» объединяет группу гетерогенных аутоиммунных хронических буллезных дерматозов, при которых возможно поражение кожи и слизистых оболочек. Ведущим патогенетическим механизмом акантолитической пузырчатки считается формирование аутоантител (в подавляющем числе случаев относящихся к классу G), направленных против эпидермальных адгезионных комплексов (десмосом) кератиноцитов, что приводит к нарушению межклеточной адгезии — акантолизу [1]. При этом исследование биоптатов видимо здоровой кожи методом прямой иммунофлуоресценции позволяет выявить фиксацию IgG (реже IgA) в межклеточной склеивающей субстанции (МСС) кератиноцитов различных слоев эпидермиса. Иногда в данной локализации также удается обнаружить фиксацию С3-компонента комплемента [2, 3].
Такие формы заболевания, как вульгарная пузырчатка (ВП) и паранеопластическая пузырчатка (ПНП), зачастую вызывают значительные сложности в дифференциальной диагностике в связи со сходством клинических проявлений и гистологической картины. Особенно это касается тех случаев, когда поражается только слизистая полости рта.
Не стоит забывать, что кандидозная инфекция может затруднять диагностику пузырчатки, а частота обнаружения грибов рода Candida у пациентов с поражением полости рта достигает 90% [4]. Кандидоз может являться одним из нежелательных явлений при терапии высокими дозами кортикостероидных гормонов широкого спектра заболеваний, в том числе и при терапии пузырчатки [5, 6].
В случае ВП, как указывалось выше, целевыми антигенами для действия аутореактивных антител являются белки клеточной адгезии (десмоглеин (Dsg) 1, Dsg3), кроме того, меняется продукция ряда цитокинов, регулирующих функцию десмоглеинов, что приводит к ослаблению межклеточных взаимодействий и формированию буллезных элементов [7].
Паранеопластическая пузырчатка — редкий вариант акантолитической пузырчатки, который всегда связан с лежащими в основе новообразованиями [8]. Иммунопатогенез ПНП определяется выработкой молекулярных продуктов опухолевой прогрессии, что приводит к изменению физиологических процессов в организме и образованию различных аутоантител, направленных не только против классических антигенов-мишеней, характерных для пузырчатки (Dsg1 и Dsg3), но и против целого ряда различных белков, в том числе компонентов базальной мембраны: десмоплакина 1 (250 кД) и 2 (210 кД), антигена буллезного пемфигоида 1 (230 кД), энвоплакина (210 кД), эпиплакина (>700 кД), периплакина (190 кД), плакофилина 3 [1].
Накопленные к настоящему времени данные показывают, что плакофилин 3 играет важную роль в прогрессировании опухолевого процесса, включая метастазирование, инвазию, образование опухолей, аутофагию и пролиферацию. Участие плакофилина 3 в онкогенезе отмечается при различных видах рака, в частности при раке молочной железы, яичников, толстой кишки и легких. Выработка аутоантител против плакинов также способна запускать каскад реакций, вовлекающих в патологический процесс целый ряд органов-мишеней. Такое мультиорганное поражение при ПНП получило название паранеопластического аутоиммунного мультиорганного синдрома (ПАМС). Одно из самых опасных проявлений ПАМС связано с нарушением адгезии эпителия легких (облитерирующий бронхиолит), что может привести к летальному исходу [9]. При этом многообразие потенциально уязвимых органов обусловливает разнообразие клинических проявлений и зачастую затрудняет постановку диагноза.
До настоящего времени единых критериев диагностики ПНП не существует, однако попытки их создания предпринимались неоднократно. Так, в 1993 г. G.J. Anhalt et al. [10] предложили диагностические критерии ПНП, которые в настоящее время дополнены S.A. Svoboda et al. и включают в себя три основных и два второстепенных критерия, в соответствии с которыми наличие либо всех трех основных критериев, либо двух основных и двух второстепенных позволяет установить диагноз ПНП. Основными критериями являются: буллезно-эрозивные поражения слизистых оболочек с поражением кожи или без него; наличие системной неоплазии; серологическое выявление антител к плакину. К второстепенным критериям относятся: акантолиз при гистологическом исследовании и обнаружение позитивной реакции прямой иммунофлуоресценции в зоне МСС при иммуноморфологическом исследовании [11]. Важно подчеркнуть, что, несмотря на внешнюю схожесть клинических проявлений ВП и ПНП при изолированном поражении слизистой оболочки полости рта, подход к лечению пациентов кардинально отличается. Высокие дозы системных глюкокортикостероидов, ритуксимаб, метотрексат и другие препараты, применяемые в терапии ВП, закономерно будут способствовать развитию онкологического процесса за счет иммуносупрессивного воздействия, что в большинстве случаев усугубит и тяжесть течения ПНП. Применение иммуносупрессивных препаратов в случае ПНП может рассматриваться только как паллиативные и симптоматические методы лечения. При установлении диагноза ПНП терапией выбора будет лечение неоплазии, что в ряде случаев позволяет добиться полного разрешения и кожного процесса [12].
Однако необходимо подчеркнуть, что нередко кожа (или слизистая полости рта) является манифестным органом и поражение кожи (или слизистой) может проявляться за некоторое время до выявления опухолевого процесса. При этом, как упоминалось выше, клинические и гистологические изменения при ВП и ПНП могут быль неотличимы. В данной ситуации именно иммунофлуоресцентное исследование становится ведущим, позволяет обнаружить атипичную иммуноморфологическую картину, заподозрить наличие неоплазии и нацелить клиницистов на онкологический поиск. Именно такой случай мы и приводим ниже (информированное согласие пациентки на публикацию данных получено).
Содержание статьи
Клиническое наблюдение
Пациентка В., 1989 года рождения (34 года), наблюдается в ГБУЗ МО МОНИКИ им. М.Ф. Владимирского с диагнозом: пузырчатка с поражением слизистой оболочки полости рта с 25.07.2023.
Заболевание дебютировало в середине мая 2023 г., когда пациентка впервые отметила появление эрозий на слизистой оболочке боковых поверхностей языка, субъективно сопровождающихся болью и дискомфортом, после окончания курса лечения от лакунарной ангины. Пациентка обращалась к стоматологу и оториноларингологу, был установлен диагноз «стоматит», однако эффект от назначенного лечения отсутствовал.
С июля 2023 г. пациентка отметила появление эрозий на слизистой оболочке в области десен, твердого неба, а также красной каймы губ. Обратилась к дерматовенерологу, после чего была госпитализирована в отделение дерматовенерологии ГБУЗ МО МОНИКИ им. М.Ф Владимирского с предварительным диагнозом «вульгарная пузырчатка» для дальнейшего обследования и лечения.
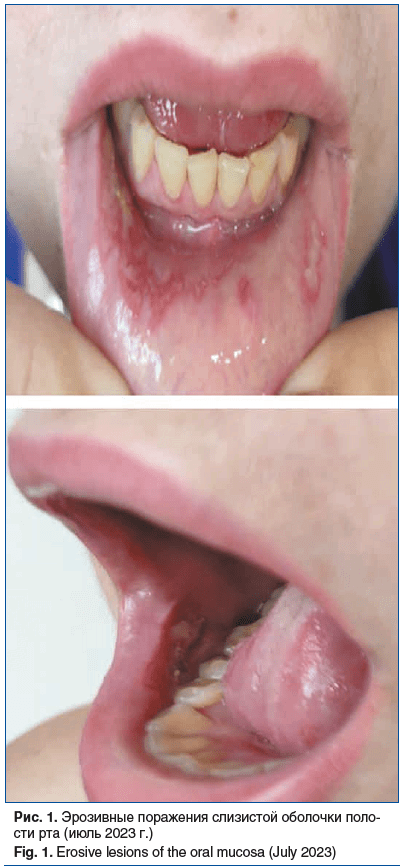
При поступлении: на слизистой оболочке десен, буккальной поверхности слизистой полости рта, боковых поверхностях языка, слизистой поверхности губ и твердом небе отмечались множественные эрозии, округлых очертаний, с нечеткими границами, диаметром до 5 мм; дно эрозий алого цвета; на эрозиях в области слизистой поверхности губ ярко выраженные пленки фибрина; феномен Никольского — положительный; субъективно — контактная болезненность (рис. 1). При оценке степени тяжести патологического процесса значение индекса PDAI составило 6, ABSIS — 4 [13, 14].
В сыворотке крови пациентки был выявлен высокий уровень антител к Dsg3, IgG от 01.08.2023 — >200 ед/мл (N<20 ед/мл), что характерно для истинной пузырчатки. При дальнейшем обследовании в мазках-отпечатках с эрозий в области боковой поверхности языка обнаружены акантолитические клетки. Гистологическая картина также свидетельствовала в пользу диагноза «вульгарная пузырчатка»: при исследовании поврежденного фрагмента слизистой оболочки полости рта выявлен эрозивный дефект, дно которого представлено акантолитически измененными клетками базального слоя. В субэпителиальных отделах — периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов и эозинофилов.
Заключение: гистологические изменения более всего соответствуют вульгарной пузырчатке.
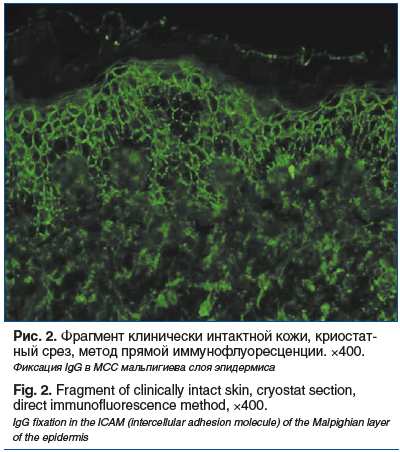
Необходимо отметить, что иммуноморфологическое исследование неповрежденной кожи с использованием дополнительных маркеров позволило нам не только подтвердить диагноз истинной пузырчатки, но и предположить ее паранеопластический характер. Выявлена четкая фиксация IgG в МСС мальпигиева слоя эпидермиса, что является патогномоничным признаком истинной пузырчатки (рис. 2).
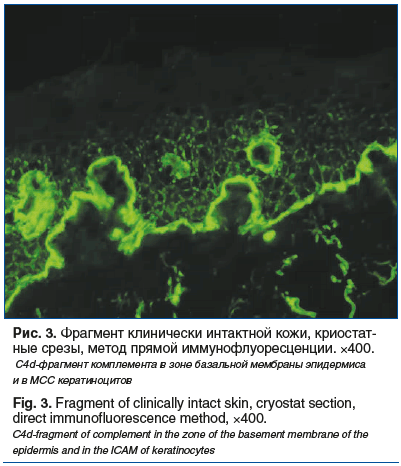
С3-компонент комплемента визуализировался лишь в цитоплазме некоторых кератиноцитов в виде пылевидных включений. При обработке срезов антителами против С4d-фрагмента комплемента была обнаружена сочетанная реакция и в зоне базальной мембраны эпидермиса, и в МСС кератиноцитов базального и нижних отделов шиповатого слоя. Такая необычная фиксация комплемента (рис. 3) натолкнула нас на мысль о вероятной связи заболевания с неопластическим процессом.
Пациентке проведены дополнительные исследования и консультации специалистов с целью исключения онкологического процесса. При УЗИ матки и придатков выявлены УЗ-признаки мультифолликулярного яичника справа, неоднородность структуры шейки матки. С целью исключения онкопатологии проведена консультация гинеколога и онколога в ГБУЗ МО «МООД». Заключение МРТ органов малого таза (ОМТ) от 18.08.2023: опухоль шейки матки с распространением на прилежащую клетчатку и верхний свод влагалища. По результатам обследования пациентке установлен диагноз: рак шейки матки IIIB cT3bN0M0, плоскоклеточный ороговевающий, гистологически подтвержден от 25.09.2023: инвазивный плоскоклеточный ороговевающий рак.
Пациентка госпитализирована для проведения курса химиолучевой терапии (ХЛТ) с 11.10.2023 по 10.11.2023 (4 курса введения цисплатина на фоне гипергидратации, антиэметиков и дексаметазона), также проведен курс 3D-конформной дистанционной лучевой терапии по технологии IMRT на аппарате Varian Halcyon с энергией 6 МэВ, на область верхней трети влагалища, лимфоузлов таза с РОД 2 Гр до СОД 46 Гр, лечение перенесла удовлетворительно.
На фоне ХЛТ развилась лейкоцитопения легкой степени, проводилась стимулирующая лейкопоэз терапия — филграстим 10 млн МЕ п/к 08.11.2023.
С 27.11.2023 по 14.12.2023 пациентке выполнен курс внутриполостной лучевой терапии на аппарате MultiSourceHDR с источником Со-60 с помощью аппликаторов типа «Манчестер» (системы эндостатов, включающей метростат, овоиды), с РОД 5 Гр до СОД 30 Гр. Лучевую терапию перенесла удовлетворительно на фоне местной санационной терапии. Выписана под наблюдение онколога по месту жительства.
После второго курса ХЛТ пациентка отметила ускоренную эпителизацию эрозий на слизистой оболочке полости рта, а к моменту окончания курса высыпания полностью регрессировали. Спустя 2 нед. после окончания курса ХЛТ снова отмечалось появление дискомфорта и болезненных ощущений при приеме пищи, появление налета в области слизистой полости рта и языка. Данное состояние сохранялось без изменений длительное время, при контрольном исследовании сыворотки крови методом ИФА на наличие циркулирующих антител к Dgl3 было отмечено их резкое снижение до референсных значений: антитела к Dgl3, IgG от 11.01.2024 — 3,10 ед/мл (N<20). Наличие болезненных эрозивных высыпаний, покрытых творожистым налетом, в этот период заболевания можно объяснить активацией кандидозной инфекции с развитием кандидозного стоматита: при культуральном исследовании отделяемого эрозий обнаружены Candida spp., уровень КОЕ — 4,8×106. Пациентке проведена местная и системная противокандидозная терапия, что привело к практически полной эпителизации эрозий на фоне нормализации уровней КОЕ Candida spp. — 2,7×102.
После перенесенного ОРВИ в апреле 2024 г. пациентка отметила кратковременное ухудшение: появление высыпаний на слизистой оболочке полости рта, болезненные ощущения и дискомфорт при приеме пищи. При прохождении динамического контроля у онколога ГБУЗ МО «МООД» выполнено МРТ ОМТ от 05.05.2024: шейка матки размером 24×23 мм, контуры бугристые, со стороны задней стенки накопления контрастного вещества нет, дополнительных образований полости таза не выявлено, отрицательной динамики не выявлено. Высыпания в полости рта через 3 нед. от их манифестации приобрели тенденцию к активной эпителизации, однако проведенное серологическое исследование позволило зафиксировать резкий рост титра антител к Dsg3 в крови, значения титра вернулись к исходным (как до проведения химиотерапии по поводу неопластического процесса): IgG от 30.05.2024 — >200 ед/мл.
В июне 2024 г. пациентка была госпитализирована в отделение дерматовенерологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского с диагнозом «обострение вульгарной пузырчатки» (с учетом верифицированного отсутствия неопластического процесса). При поступлении: на боковых поверхностях языка отмечались множественные эрозии округлых очертаний, с нечеткими границами, диаметром до 2 мм; дно эрозий алого цвета; субъективно — контактная болезненность. Остальные участки кожного покрова и слизистые оболочки свободны от высыпаний (рис. 4). Оценка степени тяжести пузырчатки: PDAI=3, ABSIS=2.
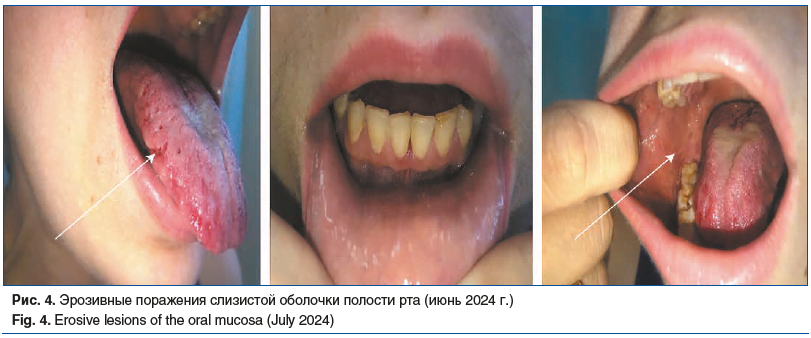
Полученные данные, а также отсутствие рецидива онкологического процесса позволили констатировать обострение ВП с изолированным поражением слизистой полости рта, которая протекает на фоне пролеченного онкологического процесса. Дальнейшее назначение системной терапии (преднизолон, метотрексат, ритуксимаб) должно быть согласовано с онкологом с учетом рисков рецидивирования неопластического процесса.
Обсуждение
Пузырчатка с изолированным поражением слизистой оболочки полости рта относится к потенциально паранеопластическим заболеваниям. Данный факт требует от клиницистов тщательного онкологического поиска. Важно помнить, что кожные проявления могут манифестировать раньше обнаружения злокачественного ново-образования, поэтому необходимо учитывать все особенности течения болезни, как клинические, так и лабораторные: необычную локализацию, полиморфность проявлений, резистентное течение, не поддающееся стандартной терапии, необычную гистологическую или иммуноморфологическую картину.
В описанном нами наблюдении клинические и гистологические изменения не выходили за рамки стандартных проявлений аутоиммунной пузырчатки. Однако необычная иммуноморфологическая картина, продемонстрировавшая одновременную вовлеченность в патологический процесс белков клеточной адгезии кератиноцитов и белков базальной мембраны эпидермиса, позволила заподозрить наличие фонового неопластического процесса. При этом следует подчеркнуть, что для обнаружения данных изменений нам пришлось использовать дополнительный маркер (антитела против C4d-фрагмента комплемента), не входящий в стандартную панель, которая применяется в большинстве случаев для диагностики аутоиммунных пузырных дерматозов. С4d-фрагмент комплемента устойчив к расщеплению и способен длительно сохраняться в тканях. Эта его особенность давно известна в трансплантологической практике, данный компонент является основным маркером гуморальной иммунной реакции [15, 16].
Принято считать, что паранеопластическое поражение кожи исчезает после адекватного лечения опухоли и вновь манифестирует при ее рецидиве или метастазировании, что служит доказательством связи онкологического процесса с кожными проявлениями [12]. Дополнительным подтверждением паранеопластического характера аутоиммунного дерматоза также является небольшой временной интервал между его развитием и формированием неоплазии.
В нашем случае оба процесса были обнаружены практически одновременно (хотя, вероятнее всего, рак шейки матки сформировался ранее, однако обратиться к врачу пациентку заставили именно кожные проявления). При этом, согласно предложенным критериям [11], правомочен диагноз ПНП: у пациентки присутствовали эрозивные поражения слизистой оболочки полости рта, обнаружен рак шейки матки (2 основных критерия); при морфологическом исследовании отмечен акантолиз и фиксация IgG в МСС кератиноцитов. Кроме того, после выполненных сеансов ХЛТ эрозии в полости рта полностью исчезли, уровень антител к Dsg3 в крови резко снизился до нормальных значений. Данное состояние сохранялось на протяжении 5 мес. Однако после перенесенного ОРВИ аутоиммунный процесс вновь обострился (резко повысился уровень антител до исходных перед лучевой терапией значений, вновь появились эрозии на слизистой). При этом рецидива злокачественного процесса обнаружено не было. Данный факт свидетельствует о возможности самостоятельного течения аутоиммунного заболевания вне зависимости от того, что послужило пусковым механизмом: продукты метаболизма опухоли или иные факторы (наша пациентка непосредственно перед манифестацией обострения пузырчатки перенесла ангину). Кроме того, можно предположить, что при ХЛТ не происходит абсолютного и полного истощения В-клеточного звена иммунного ответа. Вероятнее всего, сохраняются длительно живущие клетки памяти, способные довольно быстро формировать необходимый пул клеток после стимуляции (в нашем случае ОРВИ) [17]. В любом случае механизм истощения В-лимфоцитов зависит от целого ряда факторов, включающих и свойства препаратов, и особенности организма самого пациента.
Заключение
Таким образом, обострение акантолитической пузыр-чатки у пациента с пролеченным сопутствующим неопластическим процессом может трактоваться не только как рецидив онкологического заболевания, но и как самостоятельное аутоиммунное заболевание, протекающее параллельно с онкопроцессом. В любом случае дальнейшая тактика в отношении ведения пациента должна определяться при междисциплинарном взаимодействии онколога, дерматолога и морфолога с учетом обоих возможных вариантов течения заболевания.
Сведения об авторах:
Карзанов Олег Валерьевич — к.м.н., старший научный сотрудник отделения дерматовенерологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0002-2461-546X
Куприянова Анна Геннадьевна — к.м.н., ведущий научный сотрудник отделения морфологической диагностики и лаборатории дерматоонкологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0002-1096-5717
Баранов Илья Алексеевич — младший научный сотрудник отделения дерматовенерологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0009-0006-1225-0420
Рудакова Виолетта Юрьевна — ординатор курса дерматовенерологии кафедры детских болезней Государственного университета просвещения; 105005, Россия, г. Москва, ул. Радио, д. 10А, стр. 2; ORCID iD 0009-0001-9393-7972
Корнюшенко Владислава Олеговна — младший научный сотрудник отделения дерматовенерологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0009-0009-1989-2364
Зотов Александр Игоревич — врач отделения дерматовенерологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0009-0007-9139-340X
Молочков Антон Владимирович — д.м.н., профессор, заведующий кафедрой дерматовенерологии и дерматоонкологии ФУВ ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0002-6456-998X
Контактная информация: Баранов Илья Алексеевич, e-mail: ilya.baranov98@inbox.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 29.01.2025.
Поступила после рецензирования 21.02.2025.
Принята в печать 18.03.2025.
About the authors:
Oleg V. Karzanov — C. Sc. (Med.), Senior Researcher at the Department of Dermatovenerology, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0002-2461-546X
Anna G. Kupriyanova — C. Sc. (Med.), Leading Researcher at the Department of Morphological Diagnostics and the Laboratory of Dermatooncology, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0002-1096-5717
Ilya A. Baranov — Junior Researcher at the Department of Dermatovenerology, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0009-0006-1225-0420
Violetta Yu. Rudakova — Resident of the Course of Dermatovenerology at the Department of Pediatric Diseases, Federal State University of Education; 10A build. 2, Radio str., Moscow, 105005, Russian Federation; ORCID iD 0009-0001-9393-7972
Vladislava O. Kornyushenko — Junior Researcher at the Department of Dermatovenerology, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0009-0009-1989-2364
Alexander I. Zotov — medical physician of the Department of Dermatovenerology, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0009-0007-9139-340X
Anton V. Molochkov — Dr. Sc. (Med.), Professor, Head of the Department of Dermatovenerology and Dermatooncology of the Faculty of Advanced Medical Training, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0002-6456-998X
Contact information: Ilya A. Baranov, e-mail: ilya.baranov98@inbox.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 29.01.2025.
Revised 21.02.2025.
Accepted 18.03.2025.
Информация с rmj.ru