Введение
Бактериальный кератит (БК) — опасное инфекционно-воспалительное заболевание, которое может приводить к быстрому поражению роговицы, язве и даже перфорации, угрожая потерей зрения и глаза [1]. В мировом масштабе инфекционные кератиты остаются одной из основных причин монокулярной слепоты, особенно в развивающихся странах. Несмотря на достижения терапии, увеличение антибиотикорезистентности осложняет лечение бактериальных язв роговицы [2]. В ряде случаев исходом тяжелого БК становится рубцовое помутнение роговицы, требующее проведения сквозной кератопластики (СКП) для восстановления прозрачности оптической зоны роговицы.
Известно, что СКП на фоне активной инфекции значительно повышает риск несостоятельности трансплантата: возможно повторное инфицирование трансплантированной роговицы, ее отторжение или помутнение. Поэтому крайне важно максимально купировать бактериальный процесс перед пересадкой роговицы. В последние годы (особенно в период после пандемии COVID-19) отмечаются изменения спектра возбудителей БК и рост устойчивости к антибиотикам [2]. Это создает новые вызовы в подборе эффективной антибактериальной терапии и напрямую влияет на успех приживления роговичного трансплантата.
Обзор посвящен оценке эффективности предоперационной антибактериальной терапии и достижения прозрачного приживления сквозного роговичного трансплантата при БК. Проведен поиск и анализ научных публикаций 2020–2025 гг. в международных базах данных (PubMed, Web of Science, eLibrary и др.), посвященных БК и его лечению перед СКП. Отбирались данные об изменении микробиологического спектра возбудителей БК в указанный период, о современных группах топических антибиотиков в офтальмологии и их спектре антимикробной активности, а также сведения о роли бактериальных биопленок в патогенезе кератита. При анализе предпочтение отдавалось результатам крупных клинических исследований, обзорам и метаанализам.
Содержание статьи
- 1 Изменения микробного пейзажа БК (2020–2025 гг.)
- 2 Топические антибактериальные средства, применяемые в офтальмологии, и их спектр активности
- 3 Бактериальные биопленки при кератитах: влияние на терапию и клинические аспекты
- 4 Влияние биопленки на эффективность лечения
- 5 Актуальность проблемы формирования биопленок в лечении БК
- 6 Клиническое наблюдение
- 7 Обсуждение клинического наблюдения
- 8 Заключение
Изменения микробного пейзажа БК (2020–2025 гг.)
Анализ современных данных показал существенные сдвиги в спектре возбудителей БК за последние годы. В крупном ретроспективном исследовании в офтальмологическом центре Пекина [3] сравнили этиологию БК до пандемии (2014–2019), в период пандемии COVID-19 (2020–2022) и после нее (2023–2024). Выявлено значимое снижение доли грамположительных кокков — с ~70% всех изолятов до пандемии до ~50% после 2020 г. (p<0,001). Особенно резко уменьшилась частота выделения коагулазонегативных стафилококков, прежде всего Staphylococcus epidermidis (составлявшего около трети возбудителей до 2020 г.). Одновременно возросла доля грамположительных палочек: в частности, доля представителей рода Corynebacterium увеличились с ~4% до пандемии до >16% в постпандемический период. Доля грамотрицательных патогенов (в первую очередь Pseudomonas aeruginosa) в указанном центре осталась относительно стабильной (около 8–9% случаев), однако отдельные исследования в других регионах сообщают о противоречивых тенденциях. Так, в Португалии на период пандемии отмечен рост частоты выявления P. aeruginosa на фоне общего увеличения положительных посевов при кератитах [4], тогда как в Мексике, напротив, доля P. aeruginosa снизилась [5]. Эти географические различия указывают на неоднородность влияния внешних факторов на возбудителей БК.
Научное сообщество связывает выявленные изменения микробного пейзажа с рядом причин. Во время пандемии широкое распространение масочного режима и гигиены рук привело к снижению передачи условно-патогенной микрофлоры, что коррелирует с падением частоты внебольничных стафилококковых инфекций. Улучшение гигиены снизило обсемененность глазной поверхности кожной флорой (S. epidermidis и др.), обычно являющейся источником многих случаев БК. С другой стороны, изоляция и изменения в системе здравоохранения привели к тому, что тяжелые случаи кератита с оппортунистическими возбудителями стали занимать большую долю: например, нарушенное равновесие нормальной микробиоты и длительное местное применение антибиотиков способствовали расширению «ниши» для Corynebacterium spp. [6] – бактерий, склонных к образованию биопленок. Временный всплеск микобактериальных кератитов во время локдаунов также связывают с задержкой обращаемости пациентов и длительной нераспознанной инфекцией роговицы [7]. Помимо сдвигов в видовой структуре, тревожной тенденцией стало ускоренное развитие антибиотикорезистентности у возбудителей БК за 2020–2022 гг. Так, по данным того же исследования, устойчивость стафилококков к фторхинолонам (на примере гатифлоксацина) выросла с ~15% в допандемийные годы до ~30% в период COVID-19 и оставалась повышенной (~29–30%) после пандемии [3]. Аналогичный рост резистентности к фторхинолонам отмечен у стрептококков (с 12% до ~40% во время пандемии) и коринебактерий (с 22% до ~42%) [8]. Предполагается, что это связано с более частым и нерациональным применением системных фторхинолонов в период пандемии (например, при лечении респираторных инфекций) и отбором устойчивых штаммов на глазной поверхности [9]. Стафилококки приобретают резистентность к фторхинолонам, главным образом, через мутации генов топо-изомераз (gyrA, parC) и активацию эффлюксных насосов, а также благодаря способности образовывать биопленки, что дополнительно снижает проникновение антибиотика [10–12]. Все это подчеркивает необходимость регулярного микробиологического мониторинга при кератитах и обновления эмпирических схем терапии с учетом новых данных.
Топические антибактериальные средства, применяемые в офтальмологии, и их спектр активности
В офтальмологии применяется несколько основных классов местных (топических) антибактериальных средств [13]. Каждый класс характеризуется определенным спектром антимикробной активности (см. таблицу).
![Таблица. Группы топических антибактериальных лекарственных средств в офтальмологии и их основной спектр дей- ствия [14–20] Table. Groups of topical ophthalmological antibacterial drugs and their main spectrum of action [14–20] Таблица. Группы топических антибактериальных лекарственных средств в офтальмологии и их основной спектр дей- ствия [14–20] Table. Groups of topical ophthalmological antibacterial drugs and their main spectrum of action [14–20]](https://medblog.su/wp-content/uploads/2025/09/Sovremennyj-podhod-k-ratsionalnoj-terapii-bakterialnogo-keratita-pered-skvoznoj-keratoplastikoj.png)
Фторхинолоны — основа современной терапии БК. Обладают широким спектром активности [14]. Фторхинолоны эффективны при большинстве внегоспитальных инфекций роговицы и часто применяются в режиме монотерапии. Однако следует учитывать снижение их эффективности против метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA): по данным мониторинга, лишь ~20% штаммов чувствительны к ципрофлоксацину и левофлоксацину, тогда как чувствительность метициллин-чувствительного золотистого стафилококка (meticillin-sensitive S. aureus, MSSA) превышает 80%. Зато против S. pneumoniae и Haemophilus influenzae фторхинолоны сохраняют практически 100% активность. В целом фторхинолоновые капли (особенно поколения III–IV) обеспечивают мощное бактерицидное действие и высокие концентрации в роговице, поэтому остаются препаратами первой линии при БК.
Аминогликозиды — бактерицидные антибиотики, преимущественно эффективные против грамотрицательной флоры. Отличаются сильным действием на P. aeruginosa и другие грамотрицательные палочки: более 90% грамотрицательных возбудителей глазных инфекций чувствительны к тобрамицину, нетилмицину и амикацину. Активны также против стафилококков: например, S. aureus (MSSA) подавляется нетилмицином в ~95% случаев. В России зарегистрированы две офтальмологические формы нетилмицина — капли Неттацин 0,3% и мазь Неттависк 0,3% (Bausch Health, Италия). Показано достижение бактерицидных концентраций в строме через 30 мин после инстилляции, а в клинических исследованиях зарегистрирована эрадикация возбудителя в 92% случаев [15, 16]. Режим дозирования — 3 р/сут (Неттацин) или 3–4 р/сут (Неттависк), что повышает приверженность терапии. Аминогликозиды не действуют на анаэробную флору. В терапии язв роговицы эти препараты часто используются в комбинации: например, нетилмицин (0,3%) назначают вместе с ципрофлоксацином или моксифлоксацином, чтобы обеспечить перекрытие всех вероятных возбудителей [17].
Бета-лактамы (цефалоспорины) – группа антибиотиков широкого спектра, из которых в лечении кератитов применяются главным образом цефалоспорины I поколения (цефазолин) и III поколения (цефтазидим). Цефазолин активен преимущественно против грамположительных бактерий: стафилококков (включая многие MRSA) и стрептококков. Цефтазидим же обладает мощным действием на грам-отрицательные микроорганизмы, включая P. aeruginosa, и используется в виде фортифицированного раствора (50 мг/мл) при тяжелых грамотрицательных кератитах.
Гликопептиды — класс антибиотиков, представленный ванкомицином (и, реже, тейкопланином) для офтальмологического применения. Ванкомицин — бактерицидный препарат запаса, активный исключительно против грамположительных бактерий, включая штаммы, резистентные к другим классам (MRSA, MRSE, энтерококки). В лечении кератитов ванкомициновый раствор (50 мг/мл) незаменим при подозрении на MRSA или S. epidermidis с множественной устойчивостью, а также при кориформных (дифтероидных) инфекциях роговицы. Несмотря на редкое применение, устойчивость к ванкомицину среди возбудителей БК остается казуистикой [18].
Полимиксины — полипептидные антибиотики, препараты второго ряда для лечения глазных инфекций. Полимиксин B и колистин обладают узким спектром, действуя на грамотрицательные бактерии (в т. ч. Pseudomonas) за счет нарушения мембран. Грамположительные микробы к полимиксинам нечувствительны. В офтальмологии полимиксин B входит в состав комбинированных капель (например, с триметопримом), а колистин применяют как резерв при резистентных синегнойных кератитах.
Фениколы — хлорамфеникол (левомицетин) – бактериостатический антибиотик широкого спектра. Он ингибирует синтез белка и активен против многих грамположительных и грамотрицательных бактерий, включая Neisseria spp., Haemophilus spp., Shigella, Chlamydia, но не воздействует на P. aeruginosa. В виде 0,25% глазных капель хлорамфеникол широко применялся при конъюнктивитах и поверхностных кератитах благодаря хорошей переносимости. Однако из-за многолетнего применения во многих регионах возросла устойчивость стафилококков к левомицетину [19]. Тем не менее он остается ценным альтернативным средством при аллергии к основным группам или, например, для терапии стрептококковых язв (стрептококки обычно чувствительны к хлорамфениколу).
Сульфаниламиды — старейшие антимикробные средства (бактериостатические), сейчас применяются ограниченно из-за высокого уровня резистентности микрофлоры. В России известен 20% сульфацетамид (альбуцид), ранее часто назначавшийся при бактериальных конъюнктивитах. Спектр сульфаниламидов охватывает многие грамположительные и грамотрицательные бактерии (стрептококки, гонококк, кишечную палочку и др.), но Pseudomonas и некоторые стафилококки к нему устойчивы. В терапии кератитов сульфацетамид уступает по эффективности современным препаратам, однако иногда используется при поверхностных инфекциях легкой степени или в комплексе профилактики.
Диаминопиримидины вызывают блокаду синтеза фолатов (бактериостатики). В монотерапии в офтальмологии почти не применяются, но комбинация триметоприм + полимиксин B образует эффективный тандем широкого спектра. Триметоприм активен против грамположительных кокков, включая многие штаммы MRSA и эпидермального стафилококка, а также против ряда грамотрицательных (H. influenzae, Moraxella, E. coli и др.), тогда как полимиксин B дополняет его против Pseudomonas. Таким образом, комбинация покрывает большую часть патогенов переднего отрезка глаза. Исследование Ocular TRUST [20] показало, что топический триметоприм был эффективен против ~95% офтальмологических изолятов MRSA, тогда как фторхинолоны — лишь против 20%.
Макролиды — антибиотики, подавляющие синтез белка; в офтальмологии представлены эритромицином (0,5% глазная мазь) и азитромицином (1,5% глазные капли). Воздействуют преимущественно на грамположительные бактерии, а также на внутриклеточные патогены (хламидии, микоплазмы). Большинство грамотрицательных возбудителей (включая Pseudomonas, Enterobacteriaceae) резистентны к макролидам, поэтому при язвах роговицы эти лекарственные средства ограниченно полезны. Эритромициновая мазь чаще используется профилактически (например, у новорожденных) или при блефароконъюнктивитах. Азитромицин обладает несколько более широким спектром (например, против Haemophilus spp.) и выраженным противовоспалительным эффектом; его иногда применяют при мейбомите, розацеа-кератите и т. д.
Бактериальные биопленки при кератитах: влияние на терапию и клинические аспекты
Многие бактерии способны существовать в двух формах — свободноплавающей (планктонной) и прикрепленной. Биопленка представляет собой сообщество микроорганизмов, прочно прикрепленных к поверхности (биотической или абиотической) и окруженных самими же продуцируемым внеклеточным матриксом из полисахаридов, ДНК и белков [21]. В таком состоянии бактерии ведут себя как единый организм: у них меняется метаболизм и экспрессия генов, снижается скорость роста, формируется градиент питательных веществ и кислорода внутри матрикса. Биопленки широко распространены в природе и медицине — считается, что более 80% всех хронических инфекций у человека связаны с образованием биопленок [22]. В офтальмологии биопленки тоже играют значительную роль: они могут образовываться на поверхности контактных линз и контейнеров для них, способствуя развитию микробного кератита [23, 24]. Непосредственно на роговице бактериальная биопленка также может формироваться, особенно если нарушен эпителиальный барьер и присутствует инородная поверхность (швы, импланты) или длительно применяются препараты, подавляющие местный иммунитет (глюкокортикоиды). В экспериментах биопленочные колонии S. aureus и P. aeruginosa визуализировались на инфицированной роговице уже через 12–24 ч после заражения [25]. Таким образом, возникновение биопленки — это нередкий сценарий при БК, особенно хроническом или недостаточно отвечающем на терапию.
Влияние биопленки на эффективность лечения
Образование биопленки значительно затрудняет эрадикацию возбудителя. Бактерии в биопленке проявляют резко повышенную устойчивость к антибактериальным препаратам и антисептикам. Продемонстрировано, что для уничтожения бактерий в зрелой биопленке требуются концентрации антибиотика, в 10–1000 раз превышающие минимальную подавляющую концентрацию (МПК) для тех же бактерий в свободном состоянии [26]. Причины многофакторны: во-первых, полисахаридный матрикс физически затрудняет проникновение препарата к глубоколежащим микробным клеткам. Кроме того, матрикс способен адсорбировать и инактивировать молекулы некоторых антибиотиков, создавая локальный барьер. Но даже когда антибиотик достигает бактерий, последние могут переживать его воздействие за счет измененного физиологического состояния. В биопленке значительная часть клеток находится в замедленном метаболическом состоянии или в состоянии покоя (так называемые «персисторы») [28]. Поскольку большинство антибиотиков нацелены на процессы деления и синтеза, медленнорастущие бактерии менее уязвимы — фактически они переживают лечебную дозу и могут вновь дать рост после ее снижения. Наконец, внутри биопленки могут активироваться гены специфической устойчивости (например, усиленная экспрессия насосов эффлюкса, ферментов инактивации антибиотиков), дополнительно снижая чувствительность. Все эти механизмы делают биопленочные инфекции упорными: даже высокие дозы и комбинированная антибиотикотерапия далеко не всегда успешны, пока биопленка не будет разрушена или удалена механически [29].
Актуальность проблемы формирования биопленок в лечении БК
При БК образование биопленок ассоциировано с хроническим течением и худшими исходами. Классическим примером является так называемый инфекционный кристаллический кератит — форма медленного поверхностного кератита, чаще после кератопластики на фоне стероидной терапии, вызываемого Streptococcus viridans или коринебактериями. В роговице при этом образуются ветвящиеся белые кристаллоподобные отложения при минимальной воспалительной реакции — типичная картина биопленочной инфекции. Другой пример — хронические язвы, ассоциированные с S. epidermidis, которые могут длительно персистировать, несмотря на адекватную терапию, пока инфицированные ткани не будут хирургически удалены. Исследования показывают, что штаммы P. aeruginosa, обладающие повышенной способностью к формированию биопленки, вызывают более тяжелое поражение роговицы и худшие зрительные результаты. В частности, в рамках международного стероидного исследования SCUT было обнаружено, что степень in vitro образования биопленки клиническими изолятами P. aeruginosa коррелирует со снижением остроты зрения у пациентов как на момент поступления, так и через 3 мес. лечения [30]. Это подчеркивает клиническую значимость проблемы: наличие биопленки может служить причиной терапевтических неудач и плохого визуального прогноза.
Таким образом, бактериальные биопленки представляют актуальную проблему при кератитах, поскольку существенно снижают эффективность антибактериальной терапии и могут приводить к хроническому течению инфекции. В контексте подготовки к СКП распознавание и элиминация биопленки особенно важны: если остатки персистирующей инфекции сохранятся к моменту трансплантации, велика вероятность инфицирования трансплантата и неблагоприятного исхода.
Представляем собственное клиническое наблюдение пациентки с язвой роговицы. Согласие на публикацию клинического наблюдения от пациентки получено.
Клиническое наблюдение
Пациентка, 83 года, поступила в стационар с диагнозом «язва роговицы OS» после возможной травмы растительным материалом. При биомикроскопии определялся парацентральный язвенный дефект 3×4 мм с глубоким стромальным отеком и перифокальной сосудистой реакцией (рис. 1). Максимальная корригированная острота зрения (МКОЗ) — 0,16.

Посев из центра язвы выявил Pseudomonas stutzeri, позднее — Klebsiella pneumoniae, резистентную к фторхинолонам и карбапенему. На фоне форсированных инстилляций аминогликозидов, цефтазидима и системного имипенема/циластатина течение было малорезультативным, формировался плотный налет, подозрительный на биопленку, и 2‑мм гипопион.
Несмотря на эскалацию топической терапии (нетилмицин 0,3% + моксифлоксацин) и многократный механический дебридмент, к 39‑му дню наблюдался тотальный стромальный дефект с эндотелиальным экссудатом и ухудшением зрения до светоощущения (рис. 2). Принято решение об экстренной СКП.

Интраоперационно выполнена тотальная эксцизия инфицированной стромы; перед имплантацией донорского диска раневое ложе обработано ванкомицином 25 мг/мл.
Уже на 4-е сутки после трансплантации трансплантат оставался полностью прозрачен, складки десцеметовой мембраны разгладились, воспалительная реакция купирована (рис. 3).
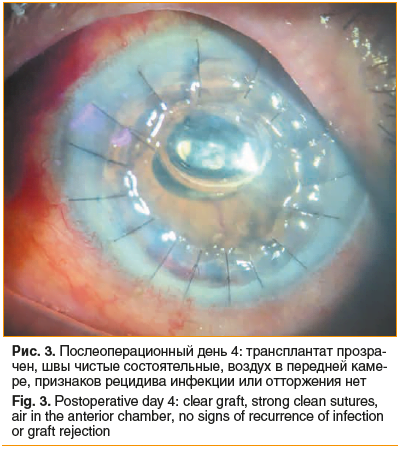
Через 1 мес. МКОЗ повысилась до 0,16; эндотелиальная плотность составила 2250 кл/мм2, признаков рецидива инфекции или отторжения донорской ткани не выявлено.
Обсуждение клинического наблюдения
Представленное клиническое наблюдение подчеркивает необходимость ранней диагностики биопленочного компонента и агрессивной комбинированной антибактериальной подготовки, включая нетилмицин и цефтазидим, с переходом к хирургическому вмешательству при первых признаках терапевтической резистентности. В результате проведенного обзора установлено, что успех СКП при БК напрямую зависит от эффективно проведенной предварительной антибактериальной терапии. Новые данные показали значимые изменения этиологии БК в последние годы, что требует пересмотра эмпирических подходов: возросла роль таких оппортунистов, как Corynebacterium, и наблюдается рост устойчивости к широко применяемым фторхинолонам. Эти факты указывают на необходимость обоснованного выбора антибиотиков и использования комбинаций, способных перекрыть весь спектр вероятных патогенов.
В обсуждаемом периоде (2020–2025 гг.) особое влияние на профиль возбудителей оказала пандемия COVID-19 [3–5]. Сокращение доли стафилококков и других комменсалов можно расценивать как положительный эффект строгих гигиенических мер. Однако одновременно мы столкнулись с негативной стороной — усилением антибиотикорезистентности вследствие избыточного использования антимикробных средств [10–12]. Кроме того, ограничение плановых визитов и лечения в разгар пандемии привело к тому, что некоторые пациенты поступали с запущенными, хроническими кератитами, возбудители успели сформировать биопленки и стать менее чувствительными к терапии.
Новые важные аспекты, выделенные в данном обзоре, включают признание проблемы биопленок при БК и их влияния на исход кератопластики. Ранее вопросам биопленкообразования при инфекциях роговицы уделялось недостаточно внимания, однако теперь очевидно, что формирование биопленки способно нивелировать преимущества самых мощных антибиотиков [27, 28], если не принять специальных мер. Для практикующего хирурга это означает, что перед проведением СКП нужно убедиться в полном купировании инфекции: прозрачное приживление трансплантата возможно только при отсутствии активных микробов (в любой форме) в резидуальной строме реципиента.
Заключение
Микробный пейзаж БК заметно изменился в период 2020–2025 гг. В литературе отмечено снижение доли привычных возбудителей на фоне увеличения роли оппортунистических бактерий. Пандемия COVID-19 повлияла на эти процессы как напрямую, так и опосредованно (через рост антибиотикорезистентности). Эти изменения объясняются улучшением гигиены населения, изменением обращаемости пациентов и отбором устойчивых штаммов при избыточной антибиотикотерапии. Для клинициста это означает, что актуальный спектр возбудителей кератита изменился, и при выборе терапии нужно учитывать возможность менее типичных патогенов и мультирезистентных штаммов.
Антибактериальная терапия БК опирается на несколько топических групп: фторхинолоны, аминогликозиды, цефалоспорины, гликопептиды, полимиксины, хлорамфеникол, сульфаниламиды, триметоприм и макролиды. Фторхинолоны обладают самым широким спектром, но недостаточно эффективны против MRSA. Аминогликозиды особенно активны в отношении грамотрицательных палочек, включая P. aeruginosa, тогда как цефазолин преимущественно воздействует на грамположительные микроорганизмы, а цефтазидим — P. aeruginosa; их сочетание обеспечивает полноспектровую эмпирическую защиту. Ванкомицин остается препаратом выбора против MRSA, а полимиксин B, обычно в комбинации с триметопримом, закрывает «окна» против синегнойной палочки. Клинически оптимальной считается комбинация двух средств, нацеленных на разные бактериальные группы, до получения результатов посева.
Биопленки — организованные микроколонии бактерий, окруженные полисахаридным матриксом — значимо осложняют лечение: для их эрадикации требуются концентрации антибиотиков, превышающие МПК в 10–1000 раз. Матрикс затрудняет диффузию препаратов, а «спящие» клетки-персисторы переживают лекарственное воздействие. Клиническими маркерами биопленки служат вялое течение язвы, отсутствие динамики на адекватной терапии и плотный налет на роговице. Эффективная тактика включает регулярный механический дебридмент, применение муколитиков или антисептиков и, при необходимости, терапевтическую кератопластику. Поскольку биопленки ассоциированы с худшими зрительными исходами, их своевременное распознавание и разрушение критически важны перед СКП.
Сведения об авторах:
Шемякин Матвей Юрьевич — врач-офтальмолог офтальмологического отделения № 63 Московского городского офтальмологического центра, младший научный сотрудник научно-клинического отдела ГБУЗ ММНКЦ им. С.П. Боткина ДЗМ; 125284, Россия, г. Москва, 2-й Боткинский пр-д, д. 5; ORCID iD 0000-0003-1537-1405
Чернаков Александр Сергеевич — врач‑офтальмолог офтальмологического отделения № 64 Московского городского офтальмологического центра ГБУЗ ММНКЦ им. С.П. Боткина ДЗМ; 125284, Россия, г. Москва, 2-й Боткинский пр-д, д. 5; ORCID iD 0009‑0008‑8536‑0553
Контактная информация: Шемякин Матвей Юрьевич, e-mail: matvei.shemyakin@gmail.com
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.06.2025.
Поступила после рецензирования 27.06.2025.
Принята в печать 22.07.2025.
About the authors:
Matvey Yu. Shemyakin — Ophthalmologist at the Ophthalmological Department No. 63, Moscow City Ophthalmological Center, Junior Scientific Officer, Scientific and Clinical Department, Botkin Hospital; 5, 2nd Botkinskiy pass., Moscow, 125284, Russian Federation; ORCID iD 0000-0003-1537-1405
Alexander S. Chernakov — Ophthalmologist, Ophthalmological Department No. 64, Moscow City Ophthalmological Center, Botkin Hospital; 5, 2nd Botkinskiy pass., Moscow, 125284, Russian Federation; ORCID iD 0009 0008 8536 0553
Contact information: Matvey Yu. Shemyakin, e-mail: matvei.shemyakin@gmail.com
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 02.06.2025.
Revised 27.06.2025.
Accepted 22.07.2025.
материал rmj.ru
