В статье представлен результаты исследования, посвященного оценке биомаркеров костного ремоделирования у детей с печеночными формами гликогеновой болезни
Содержание статьи
Введение
Гликогеновая болезнь (ГБ) — тяжелое наследственное заболевание, характеризующееся гепатомегалией, метаболическими кризами, задержкой физического развития, остеопатией. С возрастом у детей, страдающих этой болезнью, увеличивается частота остеопении и остеопороза. Согласно литературным данным, снижение минеральной плотности костной ткани (МПКТ) наблюдается у детей с Ia, Ib, II, III, V, IX типами ГБ [1–5]. В связи с этим требуется своевременная оценка маркеров костного ремоделирования и персонализированная коррекция снижения МПКТ.
Термин «ремоделирование» вошел в медицинскую практику в начале 1980-х гг. Вначале он был отнесен к сердечно-сосудистой системе — «ремоделирование сердца», «ремоделирование сосудов», а затем и к другим структурно-функциональным образованиям. Ремоделирование костной ткани является сложным процессом, контролируемым разнообразными факторами, действие которых направлено на достижение баланса между сцепленными процессами остеокластной резорбции кости и остеобластного формирования. Вопросы о костном метаболизме у пациентов с ГБ неоднократно поднимались в зарубежной литературе; несмотря на патогенетические предпосылки к развитию остеопороза у пациентов с ГБ, вопрос о выраженности изменений минерального обмена изучен недостаточно. Стандартным методом оценки МПКТ является двухэнергетическая рентгеновская абсорбциометрия (ДЭРА) на рентгеновском остеоденситометре. В последние годы появилась возможность исследования различных биомаркеров, позволяющих оценить интенсивность костеобразования и резорбции у пациентов различного возраста с различными заболеваниями.
Отсутствие единых подходов к диагностике и лечению ГБ обусловлено тяжелым характером течения патологического процесса, полиморфизмом проявлений, высоким уровнем осложнений, низким качеством жизни пациентов, что указывает на необходимость проведения сравнительных исследований для определения оптимальной тактики ведения больных с данным заболеванием.
Целью данной работы являлась оценка биомаркеров костного ремоделирования у детей с печеночными формами гликогеновой болезни.
Материал и методы
В исследование включено 72 ребенка с установленным диагнозом ГБ (48 мальчиков и 24 девочки) в возрасте от 7 мес. до 16 лет, медиана возраста — 5 [0,7; 16] лет. В зависимости от типа и ферментного дефекта основных процессов гликогеногенеза и гликогенолиза пациенты с ГБ были разделены на 3 группы. В 1-ю группу вошло 16 детей с I типом ГБ (6 человек — c Ia, 10 — с Ib типом ГБ), медиана возраста детей на момент наблюдения — 5 [0,7; 16] лет; 2-ю группу составили 14 детей с III типом ГБ в возрасте 4 [2; 13] лет; 3-ю группу — 42 ребенка с VI и IX типами ГБ в возрасте 6 [1; 16] лет. Пациенты с VI и IX типами ГБ были объединены в одну группу в связи со схожестью клинико-лабораторных проявлений заболевания. Среди детей было 48 (67%) мальчиков и 24 (33%) девочки. Достоверных различий по возрасту между группами не выявлено.
Всем детям при росте не ниже 100 см (n=45) оценивали МПКТ поясничного отдела позвоночника (L1-L4) методом ДЭРА на рентгеновских остеоденситометрах Stratos производства компании DMS (Франция). Определение концентрации минеральных веществ (кальция, фосфора), активности щелочной фосфатазы в сыворотке крови выполняли на анализаторе KONELAB Prime 60i (Thermo Scientific, Финляндия). О состоянии формирования костной ткани судили по активности общей щелочной фосфатазы, содержанию N-терминального пропептида проколлагена I типа (procollagen type 1 N-terminal propeptide, P1NP) и остеокальцина в сыворотке крови. Об уровне резорбции костной ткани судили по содержанию в сыворотке крови С-терминального телопептида коллагена I типа (b-СrossLaps). Исследование костных маркеров и уровня кальцитонина, инсулиноподобного фактора роста (ИФР-1) проводили методом электрохемилюминесцентного анализа (ЭХЛА) на анализаторе Соbas e411. Определение паратиреоидного гормона выполнялось методом ЭХЛА на анализаторе Immulite 2000 Siemens.
Статистическая обработка данных выполнена с помощью электронных таблиц Microsoft Excel и пакета прикладных программ Statistica for Windows v. 10.0, Stat Soft Inc. (США). Полученные данные имели распределение, отличное от нормального, в связи с чем они описывались в виде медианы, 25-го и 75 перцентилей — Me (Q1; Q2). Связь между изучаемыми показателями оценивали по результатам корреляционного анализа с вычислением коэффициента корреляции Пирсона (r) или Спирмена (R) и последующим установлением его значимости по критерию t.
Результаты исследования и их обсуждение
У 23 (51%) детей в возрасте от 3 до 16 лет с ГБ отмечается снижение МПКТ различной степени выраженности: у 17 (38%) пациентов выявлена остеопения (значения Z-критерия от -1,0 до 2,4), у 6 (12%) детей — остеопороз (значения Z-критерия <-2,5). Медиана показателей МПКТ в зависимости от типа ГБ достоверно не различалась (р=0,51).
Остеопения зарегистрирована при всех типах болезни, кроме Iа типа: у 60% детей с III типом ГБ, у 40% детей с VI типом ГБ, у 38% детей с IX типом ГБ и у 29% — с Ib типом ГБ. Наибольший процент случаев остеопороза выявлен среди пациентов с Ib типом ГБ (42%), тогда как у детей с IX типом ГБ остеопороз был выявлен в 12% случаев (рис. 1).
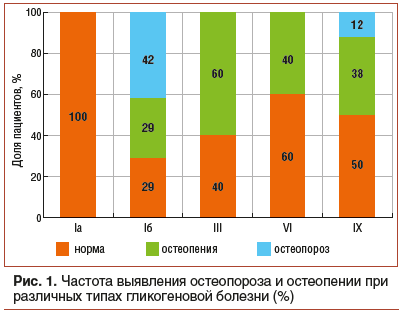
При исследовании минерального и электролитного состава сыворотки крови только у 5% детей наблюдалось снижение уровня ионизированного кальция при нормальной концентрации общего кальция. Содержание в сыворотке крови фосфора, общего и ионизированного кальция статистически не различалось у детей с разными типами ГБ (табл. 1).
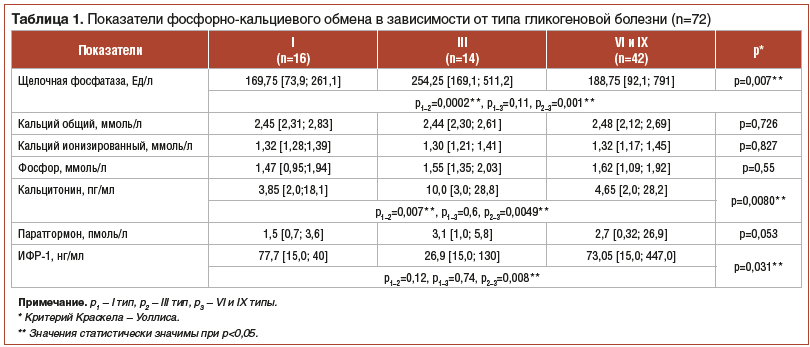
Средние значения уровня щелочной фосфатазы в группах не выходили за границы референсных значений. Следует отметить, что у детей с III типом ГБ уровень щелочной фосфатазы был выше, чем у детей с I и VI–IX типами ГБ (p<0,05). В этой группе наиболее часто определялось снижение МПКТ.
При анализе маркеров костного метаболизма концентрация остеокальцина была повышена у 42% детей в общей группе ГБ, из них у 38% детей с I типом ГБ, у 36% — с III типом ГБ и у 45% — с VI–IX типами заболевания. Концентрация b-СrossLaps была повышена у 79% детей в общей группе пациентов с ГБ, из них у 63% детей с I типом ГБ, у 79% — с III типом ГБ, у 85% — с VI–IX типами ГБ. Содержание P1NP было повышено у всех пациентов, кроме 2 (3%) с Ib типом ГБ.
Наименьшая медиана уровня b-СrossLaps отмечалась у детей c Ib и III типами ГБ по сравнению с данными показателями у пациентов с Ia, VI, IX типами ГБ (р<0,05) (табл. 2). Достоверно более низкий уровень остеокальцина в сыворотке крови выявлен у детей с Ib типом в сравнении с данными показателями у детей с Ia, VI, IX типами ГБ (р<0,05), а также у детей с III типом ГБ в сравнении с данным показателем у детей с VI и IX типами ГБ (р<0,05).
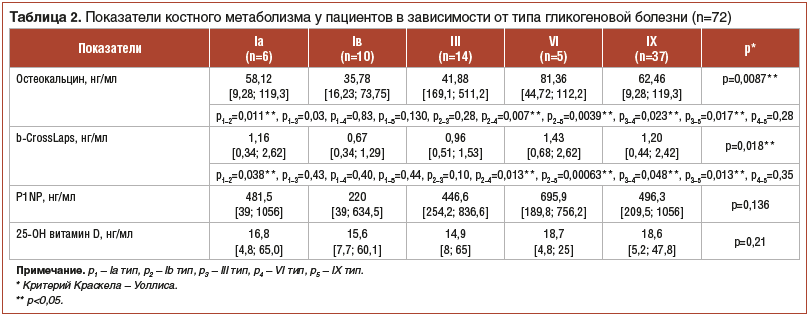
Показатель, характеризующий соотношение процессов костного ремоделирования P1NP/b-CrossLaps, оказался в 1,5 раза ниже у детей с Ib типом ГБ, чем у детей с другими формами заболевания, но достоверных различий не выявлено (p=0,22).
Концентрация остеокальцина прямо коррелировала с P1NP (r=0,60, p=0,0000), b-СrossLaps (r=0,79, p=0,0000), на основании чего можно судить о скорости костного ремоделирования. Таким образом, у детей с наиболее тяжелыми проявлениями заболевания, в т. ч. метаболическими, — с Ib и III типами ГБ определялась низкая интенсивность процессов костного ремоделирования.
Дефицит витамина D выявлен у 82% участников исследования, причем выраженность дефицита была примерно одинаковой во всех группах исследования. В ряде исследований показано, что даже при адекватном приеме витамина D сохраняется его дефицит. У пациентов с Ib типом ГБ недостаточность витамина D может быть связана не только с ограничительным характером диеты, но и с нарушением обмена веществ, мальабсорбцией в кишечнике на фоне воспалительных изменений [6, 7].
В общей группе пациентов с ГБ снижение уровня паратгормона было выявлено у 29,1% пациентов. Уровень паратгормона был снижен у 50% детей с Iа типом ГБ, у 60% детей с Ib типом ГБ, у 7% детей с III ГБ и у 37% детей с IX типом ГБ, в то же время данный показатель у пациентов с VI типом ГБ соответствовал референсным значениям. Сниженный уровень паратгормона встречался у детей с I типом ГБ чаще (56,2%), чем у детей с III, VI, IX типами заболевания. Медиана уровня паратгормона у детей с разными типами ГБ была сопоставима во всех группах (р>0,05).
Концентрация кальцитонина у 29% детей с ГБ была выше нормы, наиболее часто повышенный уровень определялся у 90% детей с III типом ГБ, у 27% детей с IX типом ГБ, у 20% детей с VI типом ГБ, у 17% детей с Iа типом ГБ. Уровень кальцитонина у детей с III типом ГБ был достоверно выше, чем у пациентов с I и VI–IX типами ГБ (р<0,05).
Ряд клинических исследований показывает важную роль ИФР-1 в процессах костного ремоделирования. Так, например, D. Melis et al. (2016) в исследовании выявили у пациентов с III типом ГБ сниженную концентрацию ИФР-1 [8]. В нашем исследовании сниженный уровень ИФР-1 отмечался у 16,6% детей с Iа типом ГБ, у 70% детей с Ib типом ГБ, у 71% детей с III типом ГБ, у 37% детей с VI–IX типами болезни. Уровень ИФР-1 у детей с III типом ГБ был значимо ниже по сравнению с данным показателем у детей с I, VI–IX типами ГБ (р<0,05) (см. табл. 1).
В ходе проведения остеоденситометрии пациенты были разделены на 2 подгруппы: с нормальной и сниженной МПКТ (при Z-критерии менее -1). Показатели остеокальцина, b-CrossLaps, P1NP, 25-ОН витамина D, кальцитонина, паратгормона между группами значимо не различались (р<0,05). Однако обращает на себя внимание тот факт, что уровень ИФР-1 у детей со сниженной МПКТ был достоверно ниже (72,0 [15,0; 264,0] нг/мл), чем у детей с нормальной МПКТ (133,0 [30,2; 447,0] нг/мл, р=0,01), в связи с чем данный показатель может быть использован как ранний маркер остеопении и остеопороза.
Повышение содержания остеокальцина было отмечено у 42% детей в общей группе ГБ. Достоверно более низкий уровень остеокальцина в сыворотке крови выявлен у детей с Ib и с III типами в сравнении с пациентами с VI и IX типами (р<0,05). Проведенный анализ показал наличие прямой корреляционной связи остеокальцина с глюкозой (r=0,33, р=0,0047) и обратной корреляционной связи с рН сыворотки крови (r=-0,37, р=0,0034). В ряде исследований демонстрируется обратно пропорциональная связь показателей глюкозы с уровнями циркулирующего остеокальцина. В исследовании 425 человек в возрасте от 19 до 82 лет при проведении перорального глюкозотолерантного теста показано, что плазменный уровень остеокальцина обратно пропорционален уровню глюкозы натощак и через 120 мин после нагрузки [9]. По данным A.G. Pittas et al. (2009), у пациентов общий сывороточный остеокальцин также оказался обратно пропорционален уровню глюкозы и инсулина натощак [10]. В настоящее время выявлена взаимосвязь между остеокальцином и другими звеньями эндокринной системы. Все большее количество исследователей рассматривают остеокальцин как возможного участника поддержания гомеостаза глюкозы через регуляторную ось «кость — поджелудочная железа». Функционирование оси «остеокальцин — инсулин» раскрывает некоторые аспекты метаболизма кальция и энергии. Остеокальцин синтезируется и секретируется остеобластами в поздней стадии их созревания. Инсулин взаимодействует с остеобластами через рецепторы инсулина [8, 11], при этом вырабатывается остеокальцин — некарбоксилированная форма остеокальцина. Витамин К является важным кофактором для получения активной формы остеокальцина, которая обладает наибольшим сродством к костной ткани, практически не выходит за ее пределы и способствует ее минерализации. При выраженным дефиците витамина К часть остеокальцина остается некарбоксилированной полностью. Эти формы легко проникают в системный кровоток, оказывая влияние на поджелудочную железу и жировую ткань. Также немаловажную роль играет снижение рH в резорбционной полости, которое стимулирует выработку остеокальцина путем заполнения полости зрелыми остеобластами. Таким образом, остеокласты регулируют выработку остеокальцина. Далее остеокальцин взаимодействует с бета-клетками поджелудочной железы, влияя на энергетический обмен в ней, а также на продукцию и секрецию инсулина [12].
Революционным в отношении связи остеокальцина с метаболизмом глюкозы оказалось исследование, проведенное N.K. Lee et al. 2007г. [13], а также исследование M. Ferron et al. (2010), которые показали, что у мышей, лишенных гена остеокальцина или рецептора к инсулину на остеобластах, наблюдался фенотип с нарушением толерантности к глюкозе, инсулинорезистентностью, снижением уровня остеокальцина [14]. Таким образом, инсулин является ключевым не только в регуляции уровня глюкозы, но и в костном обмене. В исследованиях D. Melis et al. (2016) показано, что пониженные уровни инсулина у пациентов с III типом ГБ вызывают снижение секреции остеокальцина, что в дальнейшем может привести к снижению МПКТ [8].
Сниженный уровень паратгормона встречался у детей с I типом ГБ достоверно чаще (56,2%), чем у детей с III, VI, IX типами. Как показано в нашем исследовании, уровень кальцитонина у 29% детей с ГБ был выше нормы в общей группе, преимущественно у 90% детей с III типом. Исследование кислотно-щелочного равновесия выявило наличие ацидоза натощак у 32% пациентов с I типом ГБ (рН (7,26; 7,31), ВЕ (-10; -3)), у 50% — с III типом ГБ (рН (7,24; 7,30), ВЕ (-7; -3)), у 14% — с VI–IX типами ГБ (рН (7,26; 7,30), ВЕ (-6; -3)). Нарушение минерализации костной ткани у пациентов с ГБ также непосредственно связано с особенностями метаболизма. Концентрация ионов Са2+ в плазме крови на нормальном уровне поддерживается за счет постоянной мобилизации ионов Са2+ из неорганических компонентов костей, поэтому мы не выявили снижения этого показателя. Разрушение костной ткани происходит остеокластами, чему могут способствовать уменьшение рН, увеличение концентрации лактатов, цитратов, белков, комплексно связывающих ионы кальция, а также снижение содержания витамина D в рационе. На фоне гипогликемии у детей с ГБ развивается метаболический лактатацидоз [15], в результате чего активируется бикарбонатная буферная система. При прогрессировании метаболических нарушений она истощается и происходит переключение на кальциево-бикарбонатный буфер, что ведет к выходу кальция из депо. J. Green et al. (1991) продемонстрировали, что в результате именно хронического ацидоза активируются остеокласты и ингибируется активность остеобластов, что приводит к увеличению оттока кальция из костной ткани [16]. Выход кальция из депо может объяснить пониженный уровень паратгормона и повышенный уровень кальцитонина у детей [17]. Таким образом, одним из факторов снижения МПКТ является недостаточный метаболический контроль у детей с ГБ [ 3, 5, 7].
В исследованиях D. Melis et al. (2016) показано наличие корреляций между МПКТ и уровнем ИФР-1, что может способствовать снижению МПКТ у детей с III типом ГБ [8]. В нашем исследовании снижение концентрации ИФР-1 зарегистрировано в 70% случаев у детей с Ib типом и в 71% случаев у детей с III типом. При проведении корреляционного анализа установлена связь ИФР-1 с маркерами костного ремоделирования: ИФР-1 с фосфором (r=-0,26 р=0,04), щелочной фосфатазой (r=-0,25 р=0,038), остеокальцином (r=0,42, р=0,0007), С-концевым телопептидом (r=0,45, р=0,0002). Кроме того, обнаружена положительная корреляция между ИФР-1 и глюкозой (r=0,39, р=0,00013), инсулином (r=0,44, р=0,0003), С-пептидом (r=0,34, р=0,0062). Известно, что действие на кость соматотропного гормона, играющего важную роль в достижении пика костной массы, осуществляется через стимуляцию продукции ИФР-1 не только печенью. В ходе резорбции костей происходит высвобождение из костного матрикса ИФР-1, который стимулирует пролиферацию и дифференцировку остеобластов. Интересным является тот факт, что уровень ИФР-1 сыворотки крови обратно коррелирует с АСТ (r=-0,38, р=0,001) и АЛТ (r=-0,35, р=0,003). ИФР-1 вырабатывается в большинстве тканей и действует паракринным или аутокринным путем; с учетом того, что основная доля этого фактора в крови имеет печеночное происхождение, при заболеваниях печени концентрация ИФР-1 в сыворотке крови может снижаться пропорционально степени деструкции этого органа [18]. Полученная зависимость ИФР-1 и маркеров костного ремоделирования подтверждает влияние заболевания на интенсификацию процессов костного обмена.
Заключение
Нарушение минерализации костной ткани у детей с ГБ возникает в результате взаимодействия целого ряда факторов. Прогрессирование метаболических нарушений у детей с ГБ ингибирует активность остеобластов и провоцирует остеокластную резорбцию костной ткани, тем самым увеличивая отток кальция и потерю минерального компонента костной ткани. Наиболее выраженные изменения характерны для детей с ГБ Ib и III типов. Снижение у них уровня остеокальцина и наличие корреляционных связей с уровнем глюкозы и рН сыворотки влияет на процессы костного ремоделирования и энергетический обмен. С учетом сниженной секреции инсулина у детей с ГБ по принципу функционирования оси «остеокальцин — инсулин» снижается секреция остеокальцина, что в дальнейшем может привести к снижению МПКТ.
Дети со сниженным ИФР-1 чаще имеют сниженную МПКТ (p<0,05). Выявленная корреляция ИФР-1 с остеокальцином и С-концевым телопептидом коллагена подтверждает влияние ИФР-1 на интенсификацию процессов костного обмена, в связи с чем данный показатель может быть использован как ранний маркер остеопении и остеопороза.
Исследование маркеров костного метаболизма у детей с ГБ выявило, что при Ib и III типах ГБ зафиксировано снижение сывороточных маркеров как формирования, так и резорбции костной ткани, о чем свидетельствует снижение уровня остеокальцина и С-концевого телопептида, при отсутствии существенных различий по содержанию в сыворотке крови P1NP.
Диагностика маркеров костного обмена в практике ведения пациентов с ГБ позволяет определить выраженность процесса резорбции костной ткани, скорость ремоделирования без проведения инструментального исследования, а также использовать их в дальнейшем в качестве контроля эффективности терапии и для проведения лечебно-профилактических мероприятий, направленных на своевременную коррекцию выявленных изменений, что позволит снизить частоту остеопатии и риск переломов в дальнейшем.
Информация с rmj.ru

