Введение
Липоидная пневмония (ЛП) является результатом инфильтрации паренхимы дистальных отделов легких и альвеол, вызванной аспирацией веществ, содержащих липиды. Данный процесс инициирует хроническое интерстициальное воспаление, за которым следует фиброз, создающий препятствие для нормального газообмена и, как результат, ведущий к хронической дыхательной недостаточности [1].
Пневмония, обусловленная аспирацией липидосодержащих соединений, относится к редкому варианту пневмоний.
Первое описание экзогенной ЛП относится к 1925 г., когда патологоанатом G.F. Laughlen привел результаты аутопсии 4 пациентов (3 детей и взрослого), которые на протяжении длительного времени использовали лекарственные средства на масляной основе интраназально или перорально [2, 3].
Через несколько лет исследователи Л.Х. Квин и О.О. Майер предположили, что аспирация масляных веществ приводит к ослаблению защитных механизмов верхних дыхательных путей, а именно к нарушению закрытия надгортанника и рефлекторного кашля. Одновременно с этим липиды нарушают адекватную работу аппарата мукоцилиарного клиренса, препятствуя движению ресничек трахеи. Это становится причиной сбоя в естественной эвакуации инородных агентов из дыхательных путей и способствует отложению липидосодержащих компонентов в паренхиме легких [4, 5].
Содержание статьи
Распространенность
В первое время считалось, что ЛП в большинстве случаев развивается у детей, имеющих врожденные аномалии строения лицевого скелета, такие как расщелина губы/неба, челюстно-лицевые дизостозы и синдром краниофасциальной микросомии [6]. К середине 1990-х в мировой статистике было зафиксировано уже 400 тыс. случаев ЛП, выявленных как у детей, так и у взрослых. Значительный рост заболеваемости соотносили преимущественно с широким применением масляных назальных капель при ринитах разнообразной этиологии, многочисленными последователями аюрведы в ряде стран, практикующими орошение слизистой носа растительными маслами, а также с иными факторами риска, а не с врожденными пороками развития у пациентов с этой патологией [7].
В настоящее время точные данные о распространенности ЛП отсутствуют. Число зарегистрированных случаев ЛП не отражает реального количества больных с этим заболеванием по причине длительного бессимптомного течения, слабой выраженности клинических проявлений и сложностей диагностики. Клинические признаки ЛП могут быть ошибочно интерпретированы как бактериальная пневмония, туберкулез, муковисцидоз или опухолевые процессы [8].
Согласно ретроспективным исследованиям часто-та встречаемости ЛП составляет менее 1 случая на 10 млн человек [9]. На сегодняшний день ЛП классифицируется как редкое заболевание и встречается в популяции с частотой порядка 1–3% от всех случаев [10].
Факторы риска
Различают эндогенную и экзогенную ЛП [11].
Эндогенная (холестериновая) ЛП связана с некрозом липидосодержащих клеток. В паренхиме легких происходит накопление экссудата, содержащего гигантские клетки и макрофаги с пенистой цитоплазмой с последующим нарушением проходимости дыхательных путей. Дистальнее зоны окклюзии появляются скопления макрофагов с включениями холестерина или его сложных эфиров [12]. Эндогенная ЛП чаще встречается при опухолях, обтурирующих бронх, облитерирующих бронхиолитах, но может наблюдаться и при хронических легочных инфекциях [1, 11, 13]. Другой причиной заболевания может быть нарушение обмена липидов при болезнях накопления [14].
Экзогенная ЛП возникает при аспирации (ингаляции) липидосодержащих веществ и может протекать в острой или хронической форме. Острое течение наблюдается редко, в основном при массивной аспирации нефтепродуктов, например бензина или керосина [1]. Кашель, лихорадка и одышка появляются уже через несколько часов после эпизода аспирации [5]. В зарубежной литературе описаны случаи экзогенной ЛП (бензиновая пневмония) у факиров в результате аспирации летучих углеводородов во время представления огненных шоу. Пневмония факиров представляет собой острый углеводородный пневмонит. Эти углеводороды относятся к парафиновым, нафтеновым и ароматическим классам, которые характеризуются низкой вязкостью и поверхностным натяжением. Данные вещества обладают способностью быстро диффундировать по бронхиальному дереву и разрушать сурфактантный барьер, вызывать активацию макрофагов, что приводит к повышенному выбросу цитокинов и длительной воспалительной реакции [15]. Острые формы ЛП обычно имеют благоприятный исход и регрессируют в течение нескольких дней при консервативных методах лечения.
Хроническое течение экзогенной ЛП подразумевает повторную длительную (от 1 мес.) аспирацию небольших количеств жиросодержащих веществ.
Существует ряд факторов, предрасполагающих к аспирации. Так, дети с врожденными аномалиями развития лицевого скелета намного чаще подвержены дисфагии [5, 6]. У детей с перинатальным поражением центральной нервной системы или тяжелой формой эпилепсии подавляется кашлевой и глотательный рефлексы ввиду особенностей патогенеза заболеваний, что приводит к увеличению риска аспирации во время кормления [16, 17]. К группе лиц с повышенным риском возникновения экзогенной ЛП относят новорожденных, которых кормят исключительно в горизонтальном положении, что повышает риск аспирации грудного молока или смесей с высоким содержанием липидов. Ранний и пожилой возраст, применение кетогенной диеты, дисфункция глотания (при ахалазии, дивертикуле пищевода, грыже пищеводного отверстия диафрагмы, гастроэзофагеальном рефлюксе и нервно-мышечных расстройствах глотки и пищевода) также предрасполагают к развитию ЛП [3, 16].
В настоящее время все чаще приводятся описания клинических наблюдений ЛП, вызванной ежедневным использованием электронных сигарет (вейпов), которые содержат растительный глицерин, состоящий из триглицеридов пальмового, кокосового или соевого масла [18].
В то же время у многих пациентов не обнаруживалось никаких предрасполагающих состояний, и заболевание было связано с чрезмерным употреблением маслянистых веществ [19–21]. Отмечено, что в настоящее время наиболее частым фактором риска развития ЛП, особенно у детей, являются масляные назальные капли или спреи. В научной литературе приводится множество клинических примеров длительного применения назальных спреев, содержащих эфирные масла, ментол и жидкий парафин у пациентов с хроническим течением ЛП. Жидкий парафин, который используется в качестве слабительного, также является частой причиной заболевания (до 75% клинических случаев в Японии) [5, 22].
Клинические симптомы
Патогномоничные клинические признаки экзогенной ЛП отсутствуют. Аспирационная, в том числе липоидная, пневмония характеризуется постепенным началом заболевания. К наиболее частым клиническим проявлениям можно отнести длительный кашель и одышку, реже пациентов беспокоят лихорадка, потливость и слабость. В некоторых случаях отмечается снижение массы тела и боль при экскурсии грудной клетки, чаще в горизонтальном положении [2, 11, 23, 24].
Выделяют 3 клинические формы экзогенной ЛП с учетом изменений, выявленных при лучевой диагностике:
бессимптомное течение (за исключением изменений, выявленных при диагностических исследованиях — компьютерной томографии (КТ), рентгенографии);
течение с лихорадкой и продуктивным кашлем (инфильтрация корней легких на рентгенограмме органов грудной клетки (ОГК));
течение с длительным кашлем и постоянной одышкой (ретикулярные изменения на рентгенограмме/КТ грудной клетки) [25].
Наиболее частыми признаками являются одышка, ослабление дыхания. Иногда выслушивается крепитация, но у значительной части детей (в 46% случаев) патологические шумы при аускультации отсутствуют [22]. С течением времени может отмечаться снижение сатурации до 90–94%. В лабораторных исследованиях изменения отсутствуют либо отмечается лейкоцитоз, увеличение уровня С-реактивного белка (СРБ), скорости оседания эритроцито (СОЭ) [11, 17].
Современные подходы к диагностике
Основным методом диагностики ЛП является КТ ОГК [26, 27]. Ретроспективный анализ результатов КТ 17 детей в возрасте от 2 мес. до 9 лет с подтвержденным диагнозом ЛП в период с 1995 по 2006 г., проведенный бразильскими учеными, обнаружил характерные изменения в виде двусторонних участков консолидации с симптомом «воздушной бронхограммы» (17/100%) и участков повышенной плотности по типу «матового стекла» (10/58,8%). Зоны «матового стекла», окруженные консолидацией (n=7), были очаговыми (фокальными) (n=4) или связанными с утолщением междольковых перегородок (симптом «булыжной мостовой», n=3). У пациентов не было плеврального выпота, увеличения лимфатических узлов. Изменения отмечались преимущественно в задненижних отделах легких [21]. На основании полученных данных авторы работы предположили, что диагноз экзогенной ЛП может быть установлен по характерным изменениям по данным КТ ОГК и анамнестическим данным, свидетельствующим об эпизодах употреблении минеральных масел.
Другим эффективным методом диагностики является бронхоскопия с анализом бронхоальвеолярной жидкости (БАЛЖ). При ЛП в бронхоальвеолярном лаваже выявляются макрофаги, содержащие вакуоли липидов [26]. При микроскопическом исследовании материала из БАЛЖ окраска суданом III позволяет подтвердить накопление в цитоплазме макрофагов жира, окрашенного в оранжевый цвет. Подобные отложения обнаруживаются и в межклеточном пространстве [16]. Анализ липидов, выявленных в БАЛЖ, в некоторых случаях позволяет уточнить причину возникновения ЛП. Так, например, T. Shimizu et al. [5] приводят описание рецидивирующей ЛП. С помощью липидного анализа БАЛЖ было установлено высокое содержание олеиновой, линолевой и α-линоленовай кислот, которые являются типичными компонентами растительного масла. После повторного опроса пациентки о ее пищевых привычках обнаружилось, что она выпивала стакан (!) неразбавленного растительного масла «залпом» с каждым приемом пищи [5].
Подходы к терапии
К настоящему моменту не сформировано единого стандартизированного подхода к терапии ЛП. Тем не менее ключевым принципом лечения выступает полное прекращение контакта с жиросодержащими агентами, что обусловливает необходимость тщательного анализа анамнеза для установления этиологического фактора.
В современной клинической практике одним из наиболее результативных методов терапии ЛП считается назначение ингаляционных глюкокортикостероидов (иГКС) [5, 13, 16, 19]. В ситуациях с затяжным рецидивирующим характером патологии допустимо применение пероральных форм глюкокортикостероидов с последующим постепенным снижением их дозировки вплоть до отмены [5]. При развитии вторичной бактериальной инфекции абсолютно показано назначение антибактериальных препаратов.
На протяжении последних лет в отечественной и зарубежной научной литературе особый акцент делается на применении макролидов у пациентов с интерстициальными заболеваниями легких (ИЗЛ). В данном случае учитывается не их антибактериальная активность, а противовоспалительные и иммуномодулирующие свойства, которые присущи исключительно 14-членным (эритромицин, кларитромицин, рокситромицин) и 15-членным (азитромицин) представителям этого класса антибиотиков и детерминированы особенностями их молекулярной структуры.
В зарубежных научных отчетах описаны отдельные клинические наблюдения, в которых терапия панбронхиолита с применением азитромицина позволила добиться положительной динамики. Согласно существующей точке зрения, азитромицин и кларитромицин потенцируют эффект иГКС, а также способствуют восстановлению функции мукоцилиарного клиренса, что в комплексе обеспечивает благоприятный терапевтический ответ при ИЗЛ [28, 29]. Ряд экспериментальных и клинических данных продемонстрировал противовоспалительную активность макролидов, выражающуюся в подавлении синтеза провоспалительных цитокинов (интерлейкинов 6 и 8), при различных патологических состояниях, включая дефицит сурфактанта. Также отмечается свойство азитромицина угнетать нейтрофильное воспаление и блокировать гиперсекрецию бокаловидных клеток [30]. Проведенное in vitro исследование на культуре клеток бронхиального эпителия человека выявило влияние макролидов на клеточные процессы, связанные с функционированием легочного эпителия и регенерацией альвеолярной паренхимы [31]. Благодаря способности модулировать фосфолипидоз азитромицин может оптимизировать метаболизм альвеолярных липидов и активность сурфактантной системы, тем самым стимулируя механизмы защиты при тканевом стрессе [32]. Существенным условием является длительный характер лечения (минимум 3 мес.) с применением низких доз препарата 2–3 раза в неделю. Необходимо подчеркнуть, что эта схема может быть использована во всех случаях, где в основе патогенеза лежит нейтрофильное воспаление. Отдельные исследования зафиксировали положительный эффект от применения макролидов при бронхиолитах, стероидозависимой бронхиальной астме (за исключением Th2-фенотипа) и хроническом риносинусите, резистентном к топической терапии глюкокортикостероидами[1] [30, 33].
Клиническое наблюдение
Пациент Д., мальчик 2,6 года. На амбулаторном приеме у пульмонолога в УДКБ им. И.М. Сеченова г. Москвы в феврале 2021 г. мама ребенка предъявляла жалобы на длительный субфебрилитет, а также постоянный кашель смешанного характера, чаще утром.
Анамнез жизни отягощен прогрессирующим течением неврологической патологии: детский церебральный паралич (ДЦП), диплегия, синдром Веста. Дисфагия: было несколько случаев аспирации пищей. Длительная терапия препаратами вальпроевой кислоты (200 мг/сут). Наследственность не отягощена. Аллергоанамнез не отягощен. Вакцинация: медотвод.
Перенесенные заболевания: ОРИ, тонзиллит, повторные пневмонии в течение последних 6 мес.
Из анамнеза заболевания известно, что в сентябре 2020 г. ребенок был консультирован гастроэнтерологом по поводу хронических запоров. Рекомендован длительный прием per os вазелинового масла, которое мальчик получал ежедневно. С октября 2020 г. отмечались эпизоды повышения температуры тела до 39 °С, редкий кашель. Ребенок был осмотрен участковым педиатром, диагноз: острая респираторная инфекция. Рентгенография ОГК не проводилась. Аускультативно в легких выслушивалось пуэрильное дыхание, без хрипов. Проведен курс антибактериальной терапии цефуроксимом, на фоне которой температура нормализовалась. Через несколько дней после завершения курса лечения вновь отмечен подъем температуры до 38 °С, редкий влажный кашель. Ребенок был госпитализирован в пульмонологическое отделение Морозовской ДГКБ г. Москвы. При осмотре: субфебрилитет, физикальных изменений в легких не выявлено. Лабораторной активности не отмечалось: общий анализ крови (ОАК), биохимический анализ крови — все показатели в пределах возрастных референтных значений. Была проведена рентгенография ОГК в двух проекциях: в прикорневых отделах средней и нижней долей правого легкого определялся участок неоднородного затемнения легочной ткани с нечеткими, неровными контурами. Установлен диагноз: внебольничная правосторонняя полисегментарная пневмония средней степени тяжести. Была проведена системная антибактериальная терапия амоксициллином. Лихорадка купировалась, на контрольной рентгенограмме ОГК выявлена тенденция к положительной динамике рентгенологической картины: интенсивность инфильтративных изменений справа уменьшилась. Спустя 1,5 мес. мальчик был повторно госпитализирован с возобновившимися жалобами на лихорадку до 38 °С и кашель. При поступлении признаков одышки не было, в легких выслушивалось жесткое дыхание, сатурация 97%. В ОАК: увеличение СОЭ до 59 мм/ч, лейкоцитоз до 13,5×109/л. Отмечалось увеличение уровня СРБ до 28,6 мг/л. С помощью расширенной ПЦР-диагностики были исключены вирусные инфекции (Parainfluenza 1, 2, 3, 4, Bocavirus, Adenovirus, Rhinovirus, Metapneumovirus, Respiratory Syncytial virus); IgA, IgM, IgG к атипичным микроорганизмам (Mycoplasma pneumoniaе, Klebsiella pneumoniae) не обнаружены. Рентгенография ОГК выявила двусторонние полисегментарные инфильтративные изменения в легких. Проведена КТ ОГК: КТ-картина двусторонних массивных зон консолидации легочной ткани. На основании обследования диагностирована аспирационная пневмония. Дыхательная недостаточность (ДН) 0-й степени. В составе комплексной терапии ребенок получал: амоксициллин + клавулановая кислота 60 мг/кг/сут в течение 14 дней, ингаляционно ацетилцистеин + тиамфеникол 250 мг/сут в течение 10 дней. Самочувствие ребенка улучшилось, лихорадка купировалась, однако рентгенологическая картина существенно не изменилась. В течение следующего месяца появились активные жалобы на респираторные симптомы, повторная рентгенография ОГК показала отсутствие положительной динамики в легких, в связи с чем ребенок был направлен на консультацию к пульмонологу в данной клинике.
При осмотре: состояние средней тяжести по основному заболеванию. Самочувствие удовлетворительное. Температура тела 37,1 °С. Катаральных явлений нет. Кожные покровы бледно-розовые, чистые. Отмечалось умеренное тахипное, одышка при беспокойстве и плаче. Над легкими перкуторный звук не изменен. Аускультативно в легких дыхание справа ослаблено, слева пуэрильное, хрипов нет. Сатурация 98%. Частота сердечных сокращений 108 в 1 мин. Тоны сердца ясные, ритмичные. При беседе с матерью установлено, что ребенок на протяжении 6 мес. продолжает получать перорально вазелиновое масло, при этом периодически отмечались эпизоды поперхивания, которые сопровождались редким кашлем и купировались при смене ребенком положения тела (из горизонтального в сидячее). На КТ ОГК в феврале 2021 г. выявленные изменения с учетом анамнеза трактовались как признаки двусторонней ЛП (рис. 1).
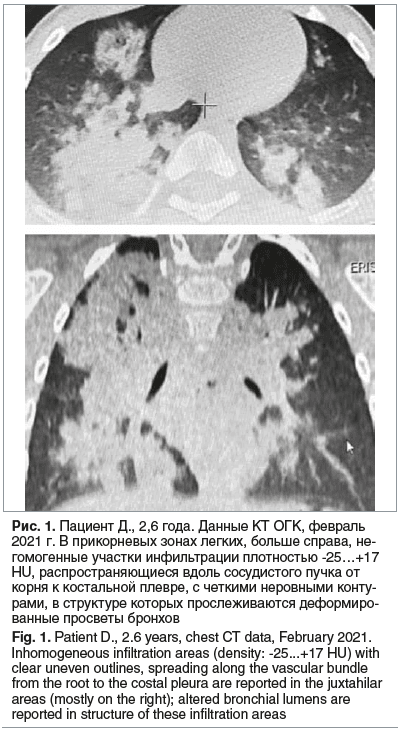
Таким образом, у ребенка с отягощенным преморбидным фоном (ДЦП, синдром Веста) на основании жалоб, данных анамнеза заболевания, физикального осмотра, а также проведенного инструментального обследования был установлен диагноз: ЛП двусторонняя, тяжелое течение, ДН 1–2-й степени. Была назначена ингаляционная противовоспалительная терапия глюкокортикостероидами: будесонид суспензия 500 мкг 2 р/сут, в течение 4 недель.
Через 1 мес. ребенок в плановом порядке был госпитализирован в пульмонологическое отделение Морозовской ДКБ с целью оценки эффективности терапии и ее дальнейшей коррекции. При аускультации в легких отмечалось ослабление дыхания в верхних и медиальных отделах. На КТ ОГК: отрицательная динамика за счет уплотнения участков консолидации. В ОАК: лейкоцитоз до 17,8×109/л, увеличение СОЭ до 23 мм/ч, при этом нормализовался уровень СРБ — 4,3 мг/л. В связи с отсутствием значимой положительной динамики по данным лучевой диагностики было принято решение об усилении терапии с применением интрапульмональной перкуссионной вентиляции легких (ИПВ) (характеристика метода представлена в разделе «Обсуждение»). В течение следующего месяца мальчик получал иГКС 1000 мкг/сут, а также проходил терапию ИПВ на дому, затем был вновь госпитализирован для оценки эффективности базисной терапии. В ОАК отмечалось снижение уровня лейкоцитов до 12,3×109/л, однако уровень СОЭ оставался повышенным (до 38 мм/ч). СРБ в пределах нормы. Ребенку была проведена диагностическая бронхоскопия, выявившая гнойный эндобронхит, единичные папилломовидные разрастания в подскладочном пространстве с 2 сторон до 0,2 см; при посеве БАЛЖ роста патологической флоры не выявлено, клеточный состав соответствовал норме. В связи с сохраняющейся лабораторной активностью и недостаточной положительной динамикой по данным лучевой диагностики на фоне приема иГКС, а также учитывая данные эндоскопического исследования, было рекомендовано усилить базисную терапию низкими дозами макролидов (азитромицин) по схеме: 100 мг 1 р/сут, 3 раза в неделю. Терапия иГКС и ИПВ продолжалась. Со слов мамы, самочувствие ребенка улучшилось, отмечалось облегчение отхождения мокроты.
Спустя 3 нед. от последней госпитализации ребенок перенес острый бронхит, вызванный вирусом парагриппа человека 3-го типа (подтвержден лабораторно). Заболевание протекало с фебрильной лихорадкой, одышкой смешанного характера, сильным кашлем. В связи с ухудшением самочувствия пациента, снижением сатурации до 94%, увеличением лабораторной активности (СРБ 25 мг/л), было принято решение об усилении терапии основного заболевания: назначен азитромицин 330 мг/сут в течение 7 дней, а также цефтриаксон 2 г/сут в течение 3 дней. После разрешения бронхита ребенок был выписан домой с рекомендациями продолжить комплексную терапию: иГКС 1000 мкг/сут, ИПВ и азитромицин по схеме (100 мг/сут, 3 раза в неделю) в течение 1 мес. На фоне терапии кашель купировался, подъемов температуры тела больше не отмечалось, самочувствие мальчика улучшилось, одышки не было. На контрольной КТ ОГК через 6 мес. отмечена положительная динамика в виде частичного рассасывания инфильтративных изменений в легких (рис. 2).
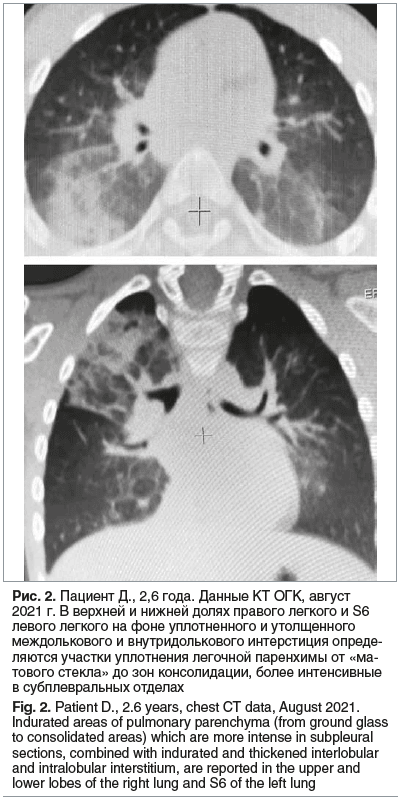
На фоне терапии в течение 13 мес. (июль 2021 г. — сентябрь 2022 г.) одышка и кашель купировались, подъемов температуры тела не отмечалось. ОАК, общий анализ мочи, биохимический анализ крови от сентября 2022 г. — без патологических изменений. На КТ ОГК от сентября 2022 г: положительная динамика в виде значительного уменьшения зон консолидации, сохраняется неравномерная воздушность легких, уплотнение легочной ткани по типу «матового стекла».
Далее представлена динамика на КТ ОГК за 13 мес. (рис. 3).

Обсуждение
Отличительной чертой представленного клинического наблюдения служит запоздалая диагностика и позднее начало целенаправленного лечения ЛП у пациента с отягощенным преморбидным фоном (тяжелая форма эпилепсии, ДЦП) и дисфагией. Несмотря на низкую общую распространенность, ЛП не является редкостью среди детей, страдающих перинатальными поражениями центральной нервной системы и тяжелыми формами эпилепсии, что связано с угнетением кашлевого и глотательного рефлексов. Продолжительный прием минеральных масел (в данном случае — вазелинового масла) значительно увеличивает вероятность развития ЛП.
Компьютерная томография ОГК является «золотым стандартом» в диагностике этого заболевания. При интерпретации результатов исследования следует учитывать патогномоничные признаки: участки снижения пневматизации по типу «матового стекла», окруженные зонами консолидации, а также неоднородные участки уплотнения легочной ткани с показателями плотности в диапазоне от -30 до -150 HU, что характерно для интерстициального накопления жира [26, 27, 34].
Наиболее важным компонентом этиотропной терапии при данной патологии признается полное устранение поступления липидосодержащих веществ в дыхательные пути. Без выполнения этого условия достичь положительного эффекта от лечения не представляется возможным.
В настоящее время единый стандартизированный терапевтический протокол ведения таких пациентов отсутствует. Тем не менее, согласно данным зарубежных публикаций, а также на основании анализа нашего клинического наблюдения, терапия иГКС в комбинации с интрапульмональной перкуссионной вентиляцией легких уже доказала свою эффективность в качестве базисного подхода. При начале лечения на ранних стадиях заболевания достичь благоприятного клинического ответа удается в более сжатые сроки.
Интрапульмональная перкуссионная вентиляция (ИПВ) — это современный безопасный метод, обеспечивающий эффективный дренаж дыхательных путей и улучшение газообмена в легочной ткани. ИПВ сертифицирована и одобрена для применения на территории Российской Федерации с 2003 г. Аппаратура для проведения ИПВ входит в стандартный перечь оснащения пульмонологических отделений[2]. Данная методика основана на высокочастотной регулируемой подаче малых объемов воздуха (перкуссий) с частотой от 200 до 300 циклов в 1 мин через специализированное пневматическое устройство открытого контура — фазитрон. Пульсирующий воздушный поток способствует мобилизации и эвакуации мокроты, рекрутирует спавшиеся альвеолы, а также улучшает показатели микроциркуляции и гемодинамики у пациентов [35]. Фазитрон функционирует по принципу обратной связи с сопротивлением легочной ткани и предохраняет ее от баротравмы. Аппарат совместим с небулайзерной камерой для ингаляционного введения лекарственных препаратов. Применение ИПВ в рамках профилактического респираторного режима позволяет сократить продолжительность антибактериальной терапии и количество госпитализаций по поводу респираторных эпизодов среди детей с нервно-мышечной патологией и ателектазами [36, 37]. Существенными преимуществами этого метода вентиляции являются автономность, портативность, мобильность и возможность использования в домашних условиях. Применение ИПВ в комплексном лечении ЛП в описанном случае подтвердило его высокую эффективность и профиль безопасности.
Включение в терапевтическую схему макролидного антибиотика (в нашем наблюдении — азитромицина) в низких дозах на протяжении длительного периода времени позволило улучшить общее состояние пациента, купировать лихорадочный синдром, а также потенцировать эффект терапии иГКС. К потенциальным механизмам действия азитромицина относятся подавление бронхиальной секреции, ингибирование аккумуляции нейтрофилов в очаге воспаления, а также модуляция бактериального воспаления. Анализ имеющихся научных данных позволяет рассматривать азитромицин в качестве эффективного средства противовоспалительной и иммуномодулирующей терапии ЛП, а также расценивать макролиды как препараты, потенцирующие действие иГКС, несмотря на недостаточную изученность молекулярных механизмов их действия и наличие потенциальных нежелательных явлений.
Заключение
Любой случай рецидивирующей пневмонии, резистентной к противомикробной терапии, в сочетании с длительным приемом липидосодержащих препаратов в анамнезе и характерными изменениями при лучевой диагностике требует обязательного исключения диагноза ЛП. Необходимо проявлять особую осторожность при назначении липидосодержащих средств пациентам с дисфагией и нервно-мышечными расстройствами с целью минимизации рисков аспирации.
СВЕДЕНИЯ ОБ АВТОРАХ:
Малахов Александр Борисович — д.м.н., профессор кафедры детских болезней клинического детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; врач-пульмонолог ГБУЗ «Морозовская ДГКБ ДЗМ»; 119049, Россия, г. Москва, 4-й Добрынинский пер., д. 1/9; главный внештатный детский специалист-пульмонолог Департамента здравоохранения г. Москвы и Минздрава Московской области; руководитель отдела педиатрии ГБУЗ Московской области «НИКИ детства Минздрава Московской области»; 115093, Россия, г. Москва,
ул. Большая Серпуховская, д. 62; ORCID iD 0000-0002-2686-8284
Геппе Наталья Анатольевна — д.м.н., профессор, заслуженный врач РФ, заведующая кафедрой детских болезней Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0003-0547-3686
Шахназарова Марина Далгатовна — к.м.н., доцент кафедры детских болезней Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0003-3512-5455
Бережанский Павел Вячеславович — д.м.н., профессор кафедры детских болезней Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; врач-педиатр пульмонологического отделения ГБУЗ «Морозовская ДГКБ ДЗМ»; 119049, Россия, г. Москва, 4-й Добрынинский пер., д. 1/9; ведущий научный сотрудник отдела педиатрии ГБУЗ Московской области «НИКИ детства Минздрава Московской области»; 115093, Россия, г. Москва, ул. Большая Серпуховская, д. 62; ORCID iD 0000-0001-5235-5303
Гутырчик Татьяна Александровна — к.м.н., врач-педиатр, врач-пульмонолог ГБУЗ «Морозовская ДГКБ ДЗМ»; 119049, Россия, г. Москва, 4-й Добрынинский пер., д. 1/9; ORCID iD 0000-0002-8421-1694
Седова Алена Юрьевна — к.м.н., врач-пульмонолог, ассистент кафедры детских болезней Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2.
Гитинов Шамиль Абдулвахидович — врач-педиатр пульмонологического отделения ГБУЗ «Морозовская ДГКБ ДЗМ»; 119049, Россия, г. Москва, 4-й Добрынинский пер., д. 1/9; ORCID iD 0000-0001-6975-1337
Николишин Александр Николаевич — заместитель главного врача по анестезиологии-реаниматологии ГБУЗ «Морозовская ДГКБ ДЗМ»; 119049, Россия, г. Москва, 4-й Добрынинский пер., д. 1/9; ORCID iD 0000-0001-7226-0707
Горев Валерий Викторович — к.м.н., главный врач ГБУЗ «Морозовская ДГКБ ДЗМ»; 119049, Россия, г. Москва, 4-й Добрынинский пер., д. 1/9; доцент кафедры неонатологии им. проф. В.В. Гаврюшова ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0001-8272-3648
Шишова Анастасия Владимировна — д.м.н., доцент, профессор кафедры поликлинической педиатрии, декан педиатрического факультета ФГБОУ ВО ИвГМА Минздрава России; 153012, Россия, г. Иваново, Шереметевский пр-т, д. 8; ORCID iD 0000-0003-0471-0790
Далгатов Микаиль Гиматович — студент Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0009-0002-1342-3590
Контактная информация: Шахназарова Марина Далгатовна, е-mail: marinashakh@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.10.2025.
Поступила после рецензирования 27.10.2025.
Принята в печать 21.11.2025.
ABOUT THE AUTHORS:
Alexander B. Malakhov — Dr. Sc. (Med.), Professor of the Department of Children’s Diseases, N.F. Filatov Clinical Institute of Children’s Health, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; Chief Consultant Children Pulmonologist, pulmonologist, Morozov Children’s City Clinical Hospital; 1/9, 4th Dobryninskiy pass., Moscow, 119049, Russian Federation; Head of the Department of Pediatrics, Research Clinical Institute of Childhood of the Moscow Region; 62, Bolshaya Serpukhovskaya str., Moscow, 115093, Russian Federation; ORCID iD 0000-0002-2686-8284
Natalia A. Geppe — Dr. Sc. (Med.), Professor, Honored Doctor of the Russian Federation, Head of the Department of Children’s Diseases, N.F. Filatov Clinical Institute of Children’s Health, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0003-0547-3686
Marina D. Shakhnazarova — C. Sc. (Med.), Assistant Professor at the Department of Pediatric Diseases, N.F. Filatov Clinical Institute of Pediatric Health, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0003-3512-5455
Pavel V. Berezhansky — Dr. Sc. (Med.), Professor of the Department of Children’s Diseases, N.F. Filatov Clinical Institute of Children’s Health, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; pediatrician, pulmonology department, Morozov Children’s City Clinical Hospital; 1/9, 4th Dobryninskiy pass., Moscow, 119049, Russian Federation; Senior Researcher of the Department of Pediatrics, Research Clinical Institute of Childhood of the Moscow Region; 62, Bolshaya
Serpukhovskaya str., Moscow, 115093, Russian Federation; ORCID iD 0000-0001-5235-5303
Tatiana A. Gutyrchik — C. Sc. (Med.), Pediatrician, Pulmonologist, Morozov Children’s City Clinical Hospital; 1/9, 4th Dobryninskiy pass., Moscow, 119049, Russian Federation; ORCID iD 0000-0002-8421-1694
Alyona Yu. Sedova — C. Sc. (Med.), Pulmonologist, Teaching Assistant at the Department of Pediatric Diseases, N.F. Filatov Clinical Institute of Pediatric Health, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation.
Shamil A. Gitinov — Pediatrician, Pulmonological Department of Morozov Children’s City Clinical Hospital; 1/9, 4th Dobryninskiy pass., Moscow, 119049, Russian Federation; ORCID iD 0000-0001-6975-1337
Alexander N. Nikolishin — Deputy Chief Physician for Anesthesiology and Intensive Care at Morozov Children’s City Clinical Hospital; 1/9, 4th Dobryninskiy pass., Moscow, 119049, Russian Federation; ORCID iD 0000-0001-7226-0707
Valeryi V. Gorev — C. Sc. (Med.), Chief Physician of Morozov Children’s City Clinical Hospital; 1/9, 4th Dobryninskiy pass., Moscow, 119049, Russian Federation; Russian Medical Academy of Continuous Professional Education; 2/1, Build. 1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0001-8272-3648
Anastasia V. Shishova — Dr. Sc. (Med.), Assistant Professor, Professor of the Department of Polyclinic Pediatrics, Dean of the Faculty of Pediatrics, Ivanovo State Medical Academy; 8, Sheremetevskiy pass., Ivanovo, 153012, Russian Federation; ORCID iD 0000-0003-0471-0790
Mikail’ G. Dalgatov — Student, N.V. Sklifosovskiy Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0009-0002-1342-3590
Contact information: Marina D. Shakhnazarova, e-mail: marinashakh@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 02.10.2025.
Revised 27.10.2025.
Accepted 21.11.2025.
[1] Global Initiative for Asthma (GINA). 2021. (Electronicc resourse.) URL: https://ginasthma.org/wp-content/uploads/2021/04/GINA-2021-Main-Report_FINAL_21_04_28-WMS.pdf (access datа: 14/09/2025).
[2] Приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. № 916н «Об утверждении Порядка оказания медицинской помощи населению по профилю «пульмонология». Приложение № 9, п. 26. 2012. (Электронный ресурс.). URL: https://minzdrav.gov.ru/documents/9136-prikaz-ministerstva-zdravoohraneniya-rossiyskoy-federatsii-ot… (дата обращения: 30.08.2025).
Информация с rmj.ru
