Введение
Фиброз миокарда (ФМ) — неотъемлемая часть прогрессирования сердечно-сосудистого континуума к хронической сердечной недостаточности (ХСН). Фактически любая значимая сердечно-сосудистая патология приводит к развитию фиброза, что в свою очередь ведет к развитию систолической дисфункции, аритмии и неблагоприятным исходам [1].
В процессе развития ФМ изменяется качественный состав интерстициальной ткани миокарда, что приводит к развитию функциональной недостаточности сердца. Фибробласты, ключевые клетки фиброгенеза в миокарде, синтезируют коллаген на рибосомах своей гранулярной эндоплазматической сети [1]. Процесс его накопления приводит к повышению жесткости миокарда [1]. Зона ФМ не проводит электрический импульс и не сокращается, что приводит к дисфункции миокарда, прежде всего левого желудочка, развитию аритмии и увеличивает вероятность внезапной сердечной смерти [2].
На сегодняшний день имеются определенные достижения в создании антифибротических препаратов, однако, учитывая, что процесс фиброза «захватывает» множество различных сигнальных путей и клеточных механизмов, высокоэффективные терапевтические подходы к снижению активности фиброза все еще отсутствуют [3]. Для увеличения эффективности поиска новых подходов к терапии ФМ необходима разработка новых методов его оценки [2–5]. Своевременная диагностика ФМ — актуальная задача, решение которой даст возможность как можно более раннего начала лечения и улучшения качества жизни пациента.
До недавнего времени биопсию миокарда считали «золотым стандартом» диагностики ФМ. Однако биопсия представляет собой инвазивную процедуру и требует определенной технической подготовки. Среди неинвазивных методов диагностики изучается роль циркулирующих биомаркеров в оценке полей фиброза, но данные опубликованных исследований противоречивы, и, вероятно, биохимическая оценка ФМ будет включать одновременно несколько маркеров [5–10].
В настоящее время развитие визуализирующих методов исследования привело к существенному прогрессу в неинвазивной оценке фибротических полей [11]. Так, эхокардиография (ЭхоКГ) позволяет оценить множество параметров, характеризующих фиброз: сократительную способность миокарда, глобальную продольную деформацию левого желудочка, гемодинамику и т. д. Немаловажное значение имеет и стресс-ЭхоКГ, которая вошла в ряд клинических рекомендаций как предпочтительная методика для оценки сократительной способности миокарда. Однако следует отметить, что при ЭхоКГ можно констатировать последствия ФМ, но нельзя напрямую определить и количественно оценить его степень и активность [1, 12–14].
Наиболее перспективными методами, обеспечивающими визуализацию полей ФМ, являются лучевые методы диагностики [3, 6, 15], с помощью которых можно диагностировать не только наличие ФМ, но и его распространенность, точную локализацию, предположить его генез, а также оценить сократительную функцию сердца. Специалисты, работающие с этими методами, активно ищут специфические маркеры, указывающие на наличие ФМ, с целью минимизации применения инвазивных процедур [16–18].
Одновременное применение различных методов диагностики позволяет получить более полную картину заболевания сердца и способствует закреплению выявленных признаков в виде устойчивых диагностических критериев, что в свою очередь ведет к стандартизации подхода к диагностике [15].
Целью настоящей статьи стала систематизация знаний в области возможностей использования лучевых методов диагностики для оценки ФМ.
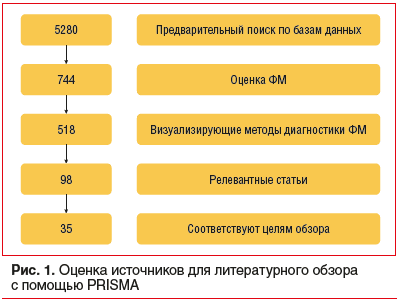
При подготовке настоящей статьи проанализированы все релевантные публикации с 2019 по 2024 г. в базах данных PubMed / MEDLINE, РИНЦ, GoogleScholar, ScienceDirect. При поиске статей использованы следующие ключевые слова: биологические маркеры, сердечно-сосудистые заболевания, cекретонеурин, biological markers, cardiovascular diseases, secretoneurin. В обзор включены актуальные экспериментальные, лабораторные, клинические исследования и обзоры. Источники литературы оценивали с помощью рекомендуемых элементов отчетности для систематических обзоров и метаанализов (Preferred Reporting Items for Systematic Reviews and Meta-Analyses, PRISMA) (рис. 1).
Методы диагностики фиброза миокарда
Магнитно-резонансная томография
Применение нативных изображений, полученных с помощью магнитно-резонансной томографии (МРТ), для диагностики и характеристики ФМ ненадежно. Именно поэтому на практике применяется МРТ с контрастным усилением с помощью препаратов на основе гадолиния в режиме LGE — позднего усиления гадолинием [15]. Программы, предназначенные для выявления ФМ, выполняются на 10–15-й минуте после контрастирования (отсроченное контрастирование). Контрастные препараты на основе гадолиния свободно распространяются во внеклеточном объеме, не проникая через неповрежденную мембрану миоцитов. При повреждении кардиомиоцитов происходит нарушение целостности клеточных мембран, и парамагнетик проникает в клетки миокарда. В случае рубцов или фиброза препарат поступает в увеличенное межклеточное пространство и долго в нем задерживается. Следует отметить, что клетки здорового миокарда плотно прилежат друг к другу, а в случае замещения здоровой ткани соединительной тканью внеклеточный объем увеличивается [19]. Гадолиний укорачивает время релаксации Т1, что выглядит как гиперинтенсивный сигнал на МР-изображениях [18–20]. В зависимости от локализации фиксирования контрастного препарата можно косвенно судить о генезе фиброза (рис. 2, 3) [15].
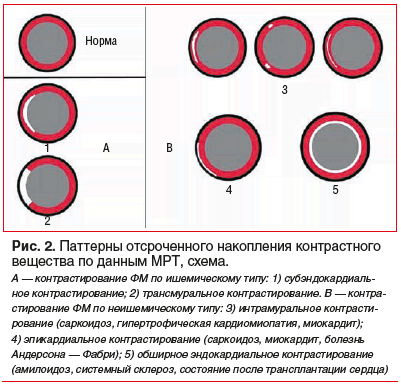
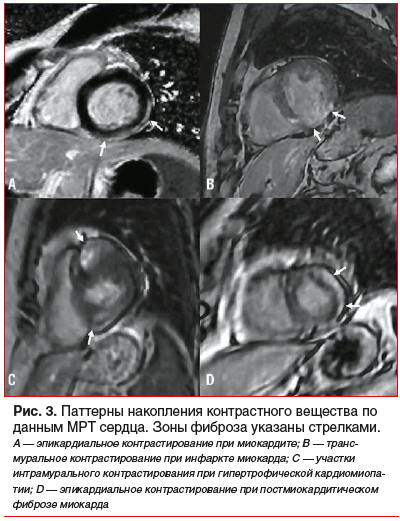
В настоящее время LGE при проведении МРТ считают «золотым стандартом» неинвазивной диагностики ФМ. Основной недостаток этой методики — субъективность и высокая вариабельность результатов измерения. В отличие от фиброза вследствие ишемического повреждения миокарда, при неишемических кардиомиопатиях ФМ обычно имеет неоднородную структуру, а в ряде случаев отмечаются множественные очаги фиброза, что создает существенную проблему для его количественной оценки. Учитывая данные недостатки, растет интерес к созданию четких критериев для количественной оценки ФМ [21–23].
В настоящее время для оценки ФМ с помощью МРТ разработана количественная оценка фиброза путем определения времени релаксации миокарда с помощью построения карт (картирование Т1, Т2) и анализа фракции внеклеточного объема (extracellular volume, ECV). Построение Т1- и Т2-карт помогает достоверно обнаружить ФМ. Карты Т1 и Т2 представляют собой двухмерное изображение, где каждый воксель кодируется отображением времени релаксации, соответственно Т1 и Т2. Результат выводится в виде цветовой схемы для облегчения визуализации. Картирование включено в критерии Lake Louise для выявления отека и реактивного фиброза на ранних стадиях воспаления при миокардите [15, 23].
Таким образом, в настоящее время МРТ сердца с контрастным усилением — наиболее эффективный неинвазивный и перспективный метод обнаружения ФМ, позволяющий снизить частоту применения инвазивных методов и риск развития осложнений после них [23–26].
Мультиспиральная компьютерная томография
Двухэнергетическая мультиспиральная компьютерная томография (ДЭКТ) представляет собой инновационный метод оценки ECV. Несмотря на то, что ДЭКТ более доступна, экономична и оперативна по сравнению с МРТ, ее прогностическая ценность при ФМ различной природы требует дальнейшего изучения [27]
В то время как МРТ предлагает более высокое разрешение для мягких тканей, а именно для диагностики ФМ, и не связана с ионизирующим излучением или применением потенциально нефротоксичных веществ для контрастного усиления, ДЭКТ может быть предпочтительнее в случаях противопоказаний к МРТ или наличия имплантированных устройств, искажающих изображение [28–30].
Позитронно-эмиссионная томография
Позитронно-эмиссионная томография (ПЭТ) — современный метод диагностики, позволяющий оценить метаболическую активность сердечной ткани. Данный метод применим для определения степени ФМ. Его суть заключается во введении пациенту радиофармпрепарата (РФП) с радиоактивным изотопом с коротким периодом распада. При взаимодействии изотопа с электронами происходит аннигиляция с образованием двух гамма-квантов, распространяющихся в противоположных направлениях. С помощью гамма-камер регистрируется траектория этих квантов, что позволяет визуализировать распределение радионуклида в организме. В качестве РФП могут использоваться 11С-бутират натрия и 18F-фтордезоксиглюкоза. ПЭТ — относительно новый метод диагностики, пока не получивший широкого распространения, несмотря на свои преимущества [31–33]. Это обусловлено необходимостью наличия дорогостоящего оборудования и высококвалифицированного персонала, что повышает стоимость процедуры. Тем не менее ПЭТ представляет собой перспективный инструмент для диагностики ФМ и, возможно, станет более доступным в будущем [31].
Перфузионная сцинтиграфия
Метод основан на использовании РФП, степень аккумуляции которых в миокарде левого желудочка напрямую зависит от интенсивности кровотока в нем. К таким РФП относят 201Tl-хлорид, 99mTc-метилизобутилизонитрил (99mTc-MIBI) и 99mTc-тетрофосмин. В клинической практике предпочтение отдают РФП, помеченным 99mTc, поскольку высокая скорость регистрации фотонных импульсов при распаде этого изотопа обеспечивает получение высококачественных изображений [34]. В отличие от ПЭТ, при перфузионной сцинтиграфии (ПС) получают двухмерные изображения. При наличии ФМ накопление РФП снижается. Несмотря на свою полезность, метод не лишен недостатков. Так, возможны ложноположительные результаты из-за смещения пациента во время исследования, а также из-за препятствий в виде анатомических структур, расположенных между миокардом и детектором гамма-камеры. К недостаткам также относят высокую стоимость процедуры, длительность ее проведения, трудности в интерпретации полученных данных, особенно при наличии изменений в межжелудочковой перегородке, а также низкую чувствительность метода при множественных поражениях коронарных артерий [33].
Коронароангиография
При проведении коронароангиографии (КАГ) возможно выявление патологии коронарных артерий, главным образом сужений с оценкой их степени, которая косвенно приводит к развитию ФМ. Трансрадиальный доступ (через лучевую артерию) является предпочтительным, поскольку нарушение кровотока в лучевой артерии, как правило, протекает бессимптомно и не приводит к нарушению функции верхней конечности. Восстановление проходимости артерии может произойти спонтанно. Доступ к коронарным артериям также возможен через плечевую или бедренную артерии, однако при этих вариантах риск осложнений выше. Кроме того, применение лучевого доступа не требует строгого постельного режима [35]. Пациент может передвигаться уже через 30–60 мин после завершения процедуры, что позволяет проводить КАГ амбулаторно. Несмотря на преимущества, манипуляция требует определенной квалификации специалиста. Существует риск развития осложнений, таких как инфаркт миокарда, перфорация сосудов, кровотечение, присоединение инфекции, повреждение артерии доступа, ее полная блокада, а также нежелательные реакции на анестезию. Важно отметить, что КАГ не применяется для диагностики ФМ и не позволяет определить его причину [35].
Инфракрасная спектроскопия
Инфракрасная спектроскопия (ИК-спектроскопия) — инновационный метод исследования ФМ, основанный на анализе метаболической активности тканей посредством регистрации молекулярных изменений. Используя поглощение инфракрасного излучения, метод позволяет не только количественно определить концентрацию коллагена в миокарде, но и локализовать участки «сшивок» коллагеновых волокон, а также установить их направление. Обработка данных осуществляется с помощью математических моделей и специализированного программного обеспечения, что позволяет построить графики пиковой интенсивности в зависимости от концентрации химических веществ в различных зонах миокарда, рассчитать площадь под кривой и провести последующий анализ [15, 36]. В настоящее время данный метод не применяется в рутинной клинической практике, однако, согласно данным англоязычной литературы, он рассматривается как перспективный инструмент, дополняющий существующие гистопатологические методы. Исследования, направленные на выявление корреляции между данными электронной микроскопии и ИК-спектроскопии, демонстрируют высокую эффективность последней. ИК-спектроскопия имеет потенциал стать новым этапом в диагностике ФМ. В долгосрочной перспективе она может сравниться с традиционной микроскопией при условии накопления достаточного объема данных и проведения дополнительных исследований. В конечном итоге данный метод позволит отказаться от инвазивных процедур забора биологического материала [15, 24, 36].
Преимущества и недостатки перечисленных методов неинвазивной визуализации ФМ представлены в таблице [3].
![Таблица. Преимущества и недостатки неинвазивной визуализации ФМ [3] (адаптировано с изменениями) Таблица. Преимущества и недостатки неинвазивной визуализации ФМ [3] (адаптировано с изменениями)](https://medblog.su/wp-content/uploads/2026/01/1768555410_426_Vozmozhnosti-i-perspektivy-sovremennoj-luchevoj-diagnostiki-fibroza-miokarda-Kalinin.png)
Заключение
Исходя из вышеизложенного, можно сделать вывод о наличии широкого спектра методов диагностики ФМ, каждый из которых обладает своими достоинствами и недостатками. Это позволяет врачам выбирать наиболее адекватный метод в зависимости от конкретной клинической ситуации. Важно подчеркнуть, что МРТ с контрастным усилением становится «золотым стандартом» диагностики ФМ благодаря своей высокой точности. По мере продолжения исследований и внедрения различных методов в практику специалисты в области диагностики и лечения будут стандартизировать параметры, наиболее достоверно указывающие на наличие ФМ. В перспективе это позволит разработать алгоритм диагностики этого состояния, что даст возможность выявлять его на ранних стадиях и, следовательно, своевременно назначать лечение для замедления прогрессирования заболевания и предотвращения осложнений.
Информация с rmj.ru

