Введение
Ведение пациентов с хронической сердечной недостаточностью (ХСН) остается одним из важных вопросов для практикующих врачей, что обусловлено ежегодно растущими эпидемиологическими показателями заболеваемости и высокой медико-социальной значимостью этой патологии [1].
Оптимизация подходов к управлению рисками развития и прогрессирования ХСН представляется особенно ценной для пациентов с перенесенными острыми формами ишемической болезни сердца (ИБС), в частности после инфаркта миокарда (ИМ) [2]. Это связано с тем, что ИМ остается одним из ведущих факторов развития ХСН, обусловленной ишемическим повреждением миокарда и сопровождающейся в ряде случаев снижением сократительной функции левого желудочка (ЛЖ) [3]. Наиболее тяжелыми после острой коронарной катастрофы являются пациенты, имеющие ХСН с низкой (обычно <40%) и умеренно сниженной (41–49%) фракцией выброса (ФВ) ЛЖ, адекватное медикаментозное лечение которых должно быть сосредоточено не только на улучшении выживаемости и предотвращении острой декомпенсации, но и на объективно ощутимом улучшении качества жизни [4, 5]. Несмотря на существующую высокую потребность в приеме пациентами оптимальной медикаментозной терапии при ХСН, приверженность врачей к ее назначению продолжает оставаться недостаточной, что ассоциируется с худшим прогнозом [6–9].
Отрицательные клинические эффекты при ХСН реализуются через нарушение регуляции работы симпатоадреналовой системы, а также ренин-ангиотензин-альдостероновой системы (РААС) с гиперпродукцией альдостерона [10]. В итоге происходит задержка натрия и воды, развиваются признаки ремоделирования миокарда и его фиброзирования. Даже среди пациентов с ХСН, регулярно принимающих препараты, влияющие на уровень альдостерона, регистрируется его повышенная выработка по типу «эффекта ускользания», что может инициировать быстрое развитие полиорганной дисфункции [11].
Согласно современным клиническим рекомендациям по ведению пациентов с ХСН Европейского и Российского обществ кардиологов, Министерства здравоохранения РФ центральное место в комплексном лечении ХСН с низкой ФВ ЛЖ (ХСНнФВ) и умеренно сниженной ФВ ЛЖ (ХСНунФВ) независимо от генеза продолжает занимать квадротерапия, включающая назначение: антагониста минералокортикоидных рецепторов (АМКР), β-адреноблокатора, ингибитора ангиотензин-превращающего фермента (иАПФ) или ингибитора рецепторов ангиотензина и неприлизина, ингибитора натрий-глюкозного котранспортера 2 типа, а при появлении признаков задержки жидкости целесообразным остается индивидуальное присоединение диуретической терапии [3]. Такое сочетание препаратов необходимо для уменьшения симптоматики, снижения смертности и частоты госпитализаций по причине декомпенсации ХСН. В этом контексте АМКР (эплеренон) и петлевой диуретик (торасемид) имеют огромный потенциал использования у таких пациентов.
Содержание статьи
Позиции эплеренона
Эплеренон занимает одно из ключевых мест в терапии ХСНнФВ и ХСНунФВ после ИМ: препарат блокирует патологические эффекты альдостерона, снижает ремоделирование миокарда, задержку натрия и воды, предотвращая развитие аритмий и прогрессирование ХСН. Выбор в пользу эплеренона обоснован высокой селективностью действия данного представителя АМКР на минералокортикоидные рецепторы и отсутствием влияния на глюкокортикоидные, прогестероновые и андрогенные рецепторы, что снижает частоту нежелательных эндокринных побочных эффектов (среди мужчин — гинекомастии и эректильной дисфункции, среди женщин — болей в области молочных желез, нарушений менструального цикла, гирсутизма), предотвращая число последующих отказов от терапии [12, 13]. Кроме того, в метаанализе 32 рандомизированных клинических исследований показано, что эплеренон превосходит спиронолактон по влиянию на общую смертность (отношение риска 0,78, 95% доверительный интервал 0,66–0,91) [14, 15].
Клиническая эффективность эплеренона оценивалась в нескольких крупных исследованиях. Так, в протоколе EPHESUS у 6632 пациентов, перенесших острый ИМ, со сниженной ФВ ЛЖ (≤40%) и симптомами/признаками ХСН, развившимися в течение 3–14 дней, эплеренон в дополнение к стандартной терапии показал снижение общей и сердечно-сосудистой смертности, внезапной сердечной смертности, а также частоты госпитализаций по причине сердечной недостаточности. Начало эффекта эплеренона было зафиксировано в первый месяц при приемлемой безопасности лечения, а эффективность применения в субанализах была сопоставима при различных типах острого коронарного синдрома вне зависимости от факта реваскуляризации мио-карда [16, 17]. Отдаленные результаты приема эплеренона продемонстрировали сокращение числа дней, проведенных в больнице по поводу ХСН, и уменьшение средних сроков госпитализации [18]. Исследование эплеренона в протоколе REMINDER показало его эффективность в первые 24 ч развития ИМ с подъемом ST в предотвращении сердечно-сосудистой смертности, повторной госпитализации, продленного пребывания в стационаре по причине ХСН, устойчивой желудочковой тахикардии или фибрилляции предсердий, ФВ ЛЖ ≤40%, повышенного уровня мозгового натрийуретического пептида (NT-proBNP) через 1 мес. или более после рандомизации [19]. В исследовании EMPHASIS-HF у 2737 пациентов с легкими симптомами ХСН при сниженной ФВ ЛЖ (≤35%) лечение эплереноном на протяжении 21 мес. также позволило значимо снизить риск смерти, частоту госпитализаций, в том числе по причине ХСН, а проведенные субанализы показали преимущества препарата в снижении частоты новых случаев фибрилляции или трепетания предсердий [20–22].
Эплеренон является обязательным и неотъемлемым компонентом квадротерапии, который благодаря его антифибротическому эффекту замедляет прогрессирование ХСН. Длительное применение АМКР в комбинации с ингибиторами РААС демонстрирует высокую эффективность в отношении влияния на альдостерон, сдерживания ремоделирования миокарда ЛЖ и связанных с ним неблагоприятных исходов [23]. Результаты исследований EPHESUS и REMINDER показали, что эплеренон улучшает прогноз пациентов с ХСН. Это может быть связано с угнетением синтеза коллагена в миокарде и замедлением прогрессирования фиброза миокарда; кроме того, эплеренон достоверно уменьшает тяжесть гипертрофии миокарда ЛЖ за счет обратного ремоделирования [16, 19, 24]. В экспериментальных исследованиях на животных эплеренон показал не только значимое ингибирование фиброза, предотвращение дилатации полостей сердца и сдерживание перехода от пароксизмальной фибрилляции предсердий в постоянную, но и снижение проявлений окислительного стресса [25, 26].
Имеются работы, указывающие на увеличение ФВ ЛЖ на фоне терапии эплереноном (p<0,001), а также на положительное влияние на глобальную продольную деформацию ЛЖ (p=0,044) [27–30]. Также прием эплеренона связан с улучшением качества жизни пациентов, а именно с увеличением социальной активности, энергичности, способности к физическому функционированию, более быстрому исчезновению отечного синдрома и разрешению застойных явлений в малом круге кровообращения, что сопровождается снижением потребности в петлевых диуретиках [31–33].
Последующие исследования подтвердили, что эплеренон может быть использован при любой ФВ ЛЖ, улучшая выживаемость и снижая риск прогрессирования ХСН [10]. Дозирование эплеренона при ХСН следует начинать с 25 мг 1 раз в день с последующим титрованием до 50 мг. Терапия эплереноном может быть связана с риском гиперкалиемии, в особенности у пациентов с нарушениями функции почек либо принимающих иАПФ или сартаны, однако при осуществлении должного мониторинга электролитов (калий, натрий) и функции почек (скорость клубочковой фильтрации, СКФ) через 3–7 дней после начала терапии и затем регулярно каждые 1–3 мес. препарат безопасен и хорошо переносится. M. Yamaji et al. [34] также представлено отсутствие негативного влияния эплеренона на уровень кортизола (p=0,003) и гликированного гемоглобина (p=0,0001). Таким образом, эплеренон может быть рекомендован к назначению всем пациентам с постинфарктным снижением ФВ ЛЖ, особенно при наличии признаков/симптомов ХСН и отсутствии противопоказаний. Так, например, первый дженерический препарат эплеренона (торговое название — Эспиро) позволяет сделать квадротерапию более доступной для пациентов.
Позиции торасемида
Крупные рандомизированные исследования торасемида у пациентов с ХСН после ИМ ограниченны, между тем его фармакологические преимущества позволяют рассматривать препарат как предпочтительный петлевой диуретик при необходимости дополнительной диуретической поддержки. В целом использование петлевых диуретиков при ХСН является симптоматическим лечением, которое способствует устранению симптомов, связанных с задержкой жидкости, кроме того, их назначение может быть обоснованным при таких сопутствующих заболеваниях, как артериальная гипертензия, почечная недостаточность и цирроз печени с отечным синдромом [35]. Согласно современным клиническим рекомендациям применение торасемида у пациентов с ХСНнФВ и ХСНунФВ после ИМ при наличии объемной перегрузки является целесообразным [3].
Торасемид позволяет снижать преднагрузку на сердце, быстро уменьшает застойные явления, облегчая симптомы ХСН за счет выведения излишков жидкости путем блокирования реабсорбции натрия и хлора в толстом сегменте восходящего колена петли Генле. Его преимущества связаны с фармакологическими свойствами (высокой биодоступностью и продолжительным действием), которые приводят к более предсказуемому стабильному эффекту и лучшей клинической эффективности по сравнению с фуросемидом и тиазидными диуретиками [36]. В отличие от других петлевых диуретиков, торасемид обладает антиальдостероновым эффектом (снижает выработку и препятствует связыванию альдостерона с соответствующими рецепторами), что позволяет длительно применять его даже в комбинации с тиазидными диуретиками без влияния на концентрации калия, магния и кальция в плазме крови, а также улучшает чувствительность к нейрогуморальным блокаторам, облегчая титрацию β-адреноблокаторов и эплеренона [37].
В клиническом исследовании TORIC Study (Torsemide In Congestive Heart Failure) с участием 1377 пациентов с ХСН функционального класса (ФК) II–III продемонстрировано, что торасемид превосходит фуросемид по стабильности диуретического эффекта и улучшению гемодинамики, что важно для контроля волемического статуса после ИМ [38]. Пациенты, получавшие торасемид, показывали значимое улучшение симптоматики ХСН по ФК (p=0,00017), более низкую частоту аномальных уровней калия в сыворотке (p=0,013), снижение риска общей смертности (p<0,05) по сравнению с фуросемидом. В другом протоколе, ДУЭЛЬ-ХСН, у 470 пациентов с ХСН ФК II–IV также выявлено, что торасемид в сравнении с фуросемидом лучше выводил ионы натрия, реже вызывая гипокалиемию и другие нежелательные явления [39].
По данным профессора Ф.Т. Агеева и соавт. [40], терапия торасемидом, в отличие от фуросемида, способствует снижению среднего ФК и тяжести клинического состояния, повышая качество жизни пациентов с ХСН (во всех случаях p<0,05). Прием торасемида сопровождается значимым увеличением дистанции теста 6-минутной ходьбы, ростом сократимости ЛЖ и улучшением допплеровских показателей в сочетании со значительным снижением уровней NT-proBNP и альдостерона (во всех случаях p<0,05). Среди петлевых диуретиков способность прямо улучшать механические свойства миокарда описана только для торасемида.
Одной из важных особенностей торасемида является его потенциальное антифибротическое действие, что дополнительно снижает риск дезадаптивного ремоделирования и способствует улучшению сердечной функции за счет антагонизма к альдостерону. В одной из работ среди пациентов с ХСН ФК II–III на фоне 6-месячного лечения торасемидом отмечалось достоверное уменьшение конечного диастолического размера и индекса массы мио-карда ЛЖ, улучшение допплерографических показателей диастолической функции ЛЖ, снижение плазменных концентраций NT-proBNP и альдостерона [41]. При применении метода эндомиокардиальной биопсии показана способность торасемида уменьшать объемную фракцию миокардиального коллагена и уровня С-концевого пептида проколлагена I типа, активируемого в том числе избытком альдостерона [41].
Дополнительными преимуществами торасемида, принимемого после ИМ, являются его способность к длительному и равномерному снижению артериального давления (АД) в течение суток с замедлением прогрессирования поражений органов-мишеней, эффективность препарата как при сохранной, так и при сниженной СКФ, метаболическая нейтральность в отношении гликемии, мочевой кислоты и липидного обмена [42].
Начальная доза торасемида варьирует от 5 до 10 мг/сут с возможностью коррекции. При назначении терапии и повышении дозы требуется мониторинг показателей гидратации, электролитов (калия, натрия), АД и почечной функции (СКФ), с корректировкой лечения при возникновении гиповолемии или электролитных нарушений. Наличие двух путей клиренса снижает риск кумуляции торасемида в случае нарушения функции печени или почек [43]. Таким образом, назначение торасемида в дополнение к квадротерапии при ХСНнФВ и ХСНунФВ после ИМ, сопровождающихся застойными явлениями, является клинически обоснованным, безопасным, а также потенциально фармакоэкономически эффективным с точки зрения предотвращения затрат на повторные госпитализации. Одним из препаратов торасемида является Тригрим, его применение удобно для пациентов ввиду возможности деления таблеток, широкого спектра представленных доз, в том числе 20 мг, и может быть особенно актуальным при большом количестве прочих назначенных лекарств для повышения приверженности лечению.
Клинические наблюдения
Ниже на примере клинических наблюдений из реальной практики нами представлен опыт назначения эплеренона и торасемида при постинфарктных ХСНнФВ и ХСНунФВ. Оба пациента подписали формы информированного добровольного согласия, одобренного локальным этическим комитетом НИИ КПССЗ, на обезличенную публикацию клинических наблюдений.
Клиническое наблюдение 1
Анамнез жизни, заболевания, результаты обследования пациентки представлены в таблице 1.


Пациентке были даны следующие рекомендации:
Наблюдение кардиолога и специалистов по сопутствующей патологии.
Участие в амбулаторной кардиореабилитации по ХСН, обучение в школе для пациентов с ХСН.
Соблюдение водно-солевого режима (вода 1,5–2 л в сутки, соль до 5 г в сутки).
Вакцинация от пневмококковой инфекции, вирусов гриппа и коронавируса.
Строгое соблюдение гипохолестериновой диеты (низкое содержание животных жиров в рационе, предпочтение цельнозерновым продуктам, свежим овощам, рыбе). Ограничение калорийности рациона при сопутствующем ожирении, количества углеводов — при сахарном диабете.
Ограничение употребления алкоголя. Продолжить воздерживаться от курения.
Регулярная аэробная физическая активность.
Контроль АД, частоты сердечных сокращений (ЧСС), окружности талии и массы тела (ИМТ) (при ожирении), гликемии (при сахарном диабете), гидробаланса (соотношения потребляемой жидкости и выделяемой с мочей).
Контроль калия и креатинина крови через 1, 3, 6, 9, 12 мес. лечения.
Лабораторно: общий (клинический) анализ крови и биохимический анализ крови (включая липидограмму и коагулограмму) (не реже 1 раза в год при ХСНунФВ, не реже 2 раз в год при ХСНнФВ), NT-proBNP (не реже 1 раза в 2 года), ферритина и насыщения трансферрина железом (при анемии).
Инструментально: ЭКГ (не реже 1 раза в год), рентгенография органов грудной клетки (не реже 1 раза в год), эхокардиография (не реже 2 раз в год), холтеровское мониторирование ЭКГ и дуплексное сканирование брахиоцефальных артерий и артерий нижних конечностей (не реже 1 раза в год).
Назначено лечение:
-
ацетилсалициловая кислота 75 мг утром;
-
бисопролол 7,5 мг утром;
-
сакубитрил + валсартан 200 мг днем;
-
аторвастатин 40 мг вечером;
-
торасемид 10 мг утром;
-
эплеренон 25 мг утром с последующим увеличением дозы до 50 мг через 1 мес.
Через 3 мес. пациентка была приглашена на повторный прием к амбулаторному кардиологу. За оцениваемый период наблюдения (3 мес.) госпитализаций по причине ХСН или иной сердечно-сосудистой причине не было. На фоне регулярного приема квадротерапии в адекватных дозах, а также добавления к терапии петлевого диуретика отмечается снижение одышки до уровня умеренной физической нагрузки, исчезновение приступов удушья по ночам и отеков, снижение массы тела. При физикальном осмотре в динамике регистрируется уменьшение признаков застоя по обоим кругам кровообращения (исчезновение набухания шейных вен, нивелирование отеков нижних конечностей и асцита, снижение тахипноэ, нормализация дыхания до везикулярного без сопутствующих хрипов, улучшение объема мочеиспускания). Улучшились и витальные показатели: сатурация 96%, ЧСС 70 в 1 мин, АД 110/70 мм рт. ст. Переносимость терапии хорошая. Не отмечалось негативного влияния терапии на СКФ (67 мл/мин/м2) и уровень калия (4,9 ммоль/л). Назначенную дозу петлевого диуретика, оттитрованную в отношении поддержания оптимального гидробаланса после декомпенсации ХСН, следует сохранить, избегая форсированного диуреза и гипокалиемии. Лечение рекомендовано продолжить в прежнем объеме.
Клиническое наблюдение 2
В таблице 2 приведены анамнез жизни, заболевания, результаты обследования пациента.
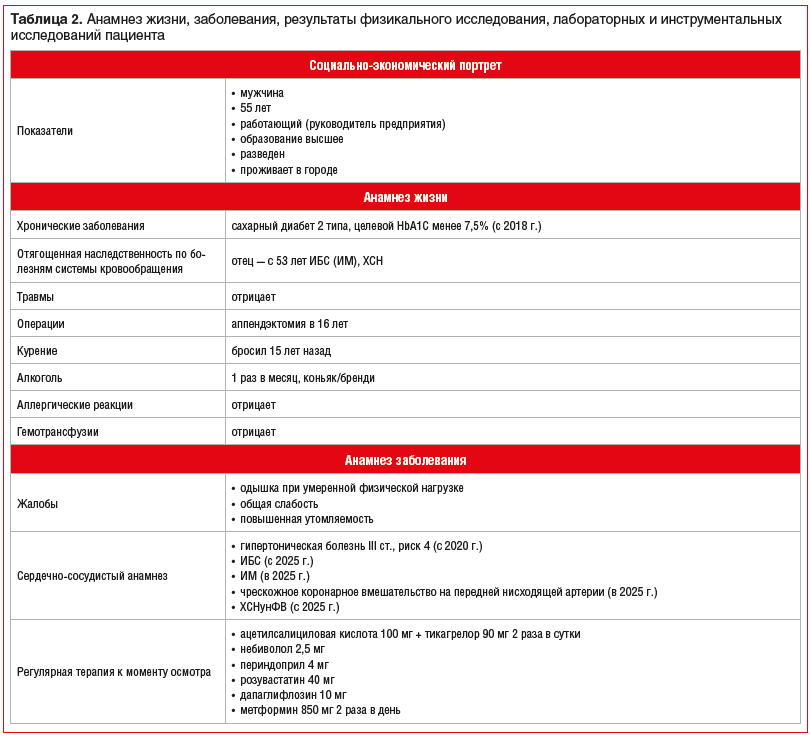
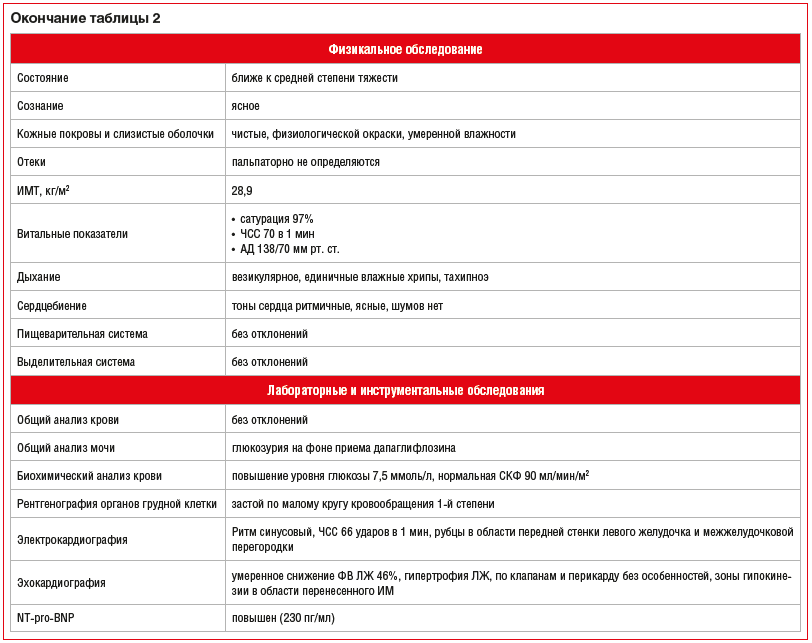
Пациенту были даны следующие общие рекомендации:
Наблюдение кардиолога и специалистов по сопутствующей патологии.
Участие в амбулаторной кардиореабилитации по ХСН, обучение в школе для пациентов с ХСН.
Соблюдение водно-солевого режима (вода 1,5–2 л в сутки, соль до 5 г в сутки).
Вакцинация от пневмококковой инфекции, вирусов гриппа и коронавируса.
Строгое соблюдение гипохолестериновой диеты (низкое содержание животных жиров в рационе, предпочтение цельнозерновым продуктам, свежим овощам, рыбе). Ограничение калорийности рациона при сопутствующем ожирении, количества углеводов — при сахарном диабете.
Ограничение употребления алкоголя. Продолжить воздерживаться от курения.
Регулярная аэробная физическая активность.
Контроль АД, ЧСС, окружности талии и массы тела (ИМТ) (при ожирении), гликемии (при сахарном диабете), гидробаланса (соотношения потребляемой жидкости и выделяемой с мочой).
Контроль калия и креатинина крови через 1, 3, 6, 9, 12 мес. лечения.
Лабораторно: общий (клинический) анализ крови и биохимический анализ крови (включая липидограмму и коагулограмму) (не реже 1 раза в год при ХСНунФВ, не реже 2 раз в год при ХСНнФВ), NT-proBNP (не реже 1 раза в 2 года), ферритина и насыщения трансферрина железом (при анемии).
Инструментально: ЭКГ (не реже 1 раз в год), рентгенография органов грудной клетки (не реже 1 раза в год), эхокардиография (не реже 2 раз в год), холтеровское мониторирование ЭКГ и дуплексное сканирование брахиоцефальных артерий и артерий нижних конечностей (не реже 1 раза в год).
Назначено лечение:
ацетилсалициловая кислота 100 мг + тикагрелор 90 мг 2 раза в сутки в течение 1 года после ИМ с дальнейшим переходом на ацетилсалициловую кислоту 100 мг + тикагрелор 60 мг 2 раза в сутки;
-
небиволол 5 мг;
-
периндоприл 4 мг;
-
розувастатин 40 мг;
-
дапаглифлозин 10 мг;
-
метформин 850 мг 2 раза в день;
-
торасемид 10 мг утром;
-
эплеренон 25 мг утром, с последующим увеличением дозы до 50 мг через 1 мес.
Спустя 3 мес. состоялся повторный прием у амбулаторного кардиолога. За анализируемый период наблюдения (3 мес.) госпитализаций по причине ХСН или иной сердечно-сосудистой причине не было. При опросе врача пациент указывал на нивелирование общей слабости, утомляемости, появление одышки исключительно при выраженной физической активности. Физикальный осмотр демонстрирует исчезновение застойных явлений по малому кругу кровообращения (снижение тахипноэ, нормализация дыхания до везикулярного без хрипов). Улучшились витальные показатели: сатурация 98%, ЧСС 62 в 1 мин, АД 118/70 мм рт. ст. Не выявлено негативного влияния на СКФ (80 мл/мин/м2) и содержание калия (5,0 ммоль/л). Лечение продолжено без дополнительной коррекции. Дозу петлевого диуретика не рекомендуется уменьшать во избежание повторной декомпенсации ХСН, терапию проводить под контролем гидробаланса и калия.
Показанные клинические наблюдения продемонстрировали необходимость, эффективность и безопасность добавления эплеренона и торасемида к комплексному лечению пациентов с постинфарктной ХСН с низкой и умеренно сниженной ФВ ЛЖ. Комплексная оптимизированная терапия ХСН после ИМ должна включать раннее назначение эплеренона в составе квадротерапии и торасемида при наличии застойных симптомов для поддержки нейрогуморального блока. В настоящее время с точки зрения ежемесячной стоимости использование данных препаратов является доступным. В арсенале кардиолога имеются хорошо зарекомендовавшие себя дженерические препараты Тригрим и Эспиро с доказанной биоэквивалентностью оригинальным препаратам.
Заключение
Торасемид и эплеренон — это лекарственные средства с многочисленными преимуществами для использования в реальной клинической практике, позволяющие в комплексе с другим базисным лечением и немедикаментозной профилактикой достигнуть эффективных результатов в компенсации постинфарктной ХСН с умеренно сниженной и низкой ФВ ЛЖ без развития нежелательных побочных явлений.
Публикация клинических наблюдений осуществлена с согласия пациентов в рамках темы ФНИ № 0419-2022-0002.
The clinical case reports were presented with the consent of the patients as a part of a topic of the Basic Research No. 0419-2022-0002.
Информация с rmj.ru

