Введение
Железодефицитные и фолатдефицитные состояния являются одними из самых распространенных в мире как среди гинекологических пациенток репродуктивного возраста, так и у женщин во время беременности[1], [2]. Дефицит таких жизненно важных микронутриентов, как железо и фолиевая кислота, может способствовать развитию ряда заболеваний, в том числе гинекологических, со снижением репродуктивного потенциала, осложнять течение физиологических процессов в организме, течение соматических заболеваний [1, 2]. Дефицит железа и фолатов в период гестации может приводить к развитию различных осложнений беременности, фетоплацентарной недостаточности и патологическому течению родов [3, 4]. Репродуктивная значимость вышеуказанных дефицитов основана также на возможном формировании пороков развития плода и развития когнитивных нарушений у новорожденного [5, 6].
В настоящее время клинические рекомендации международных врачебных сообществ включают назначение железа и фолиевой кислоты женщинам на прегравидарном этапе, во время беременности, в послеродовом периоде[3], [4]
[7].
Однако рекомендуемое пероральное применение препаратов железа имеет ряд ограничений. Низкая биодоступность и плохая приверженность пациенток терапии вследствие неблагоприятного профиля безопасности, а также риски передозировки из-за возможного возникновения ферроптоза и связанных с ним заболеваний привели к поиску новых решений [8]. Одним из них стала разработка технологии микронизации железа с его последующей микроинкапсуляцией в лецитиновую оболочку. Уменьшение размера частиц пирофосфата железа увеличивает соотношение площади поверхности молекулы и скорости растворения, что влияет на биодоступность. Микроинкапсуляция частиц фосфолипидным слоем обеспечивает защиту железа от воздействия ферментов слюны и желудочного сока, взаимодействия со щелочными соками, солями желчных кислот, кишечной флорой и свободными радикалами, следовательно, обеспечивает высокий профиль безопасности, а особый механизм эндоцитоза микроэлемента М-клетками тонкого кишечника позволяет увеличить площадь всасывания железа и обеспечивает его таргетную доставку макрофагами по лимфе в депо-органы, что значительно увеличивает биодоступность [9].
Применение фолиевой кислоты также сопровождается некоторыми ограничениями: полиморфизм ряда ферментов не позволяет метаболизировать фолиевую кислоту до активных фолатов; обогащение продуктов питания фолиевой кислотой в ряде случаев приводит к передозировке фолатов с формированием большого количества неметаболизированной фолиевой кислоты с ее потенциальными токсическими эффектами; применение высоких доз фолиевой кислоты способствует маскировке В12-дефицитной анемии в обход реакции метилирования [10]. Для решения данных проблем разработан активный метаболит фолиевой кислоты Quatrefolic®. Глюкозаминовая соль 5-метилтетрагидрофолата обладает повышенной растворимостью в сравнении с ее предшественниками, всасывается в тонком кишечнике с помощью ненасыщенного переносчика и может сразу вступать в реакции фолатного цикла, без прохождения реакций с участием дефектных ферментов вследствие полиморфизма гена. Это обеспечивает лучший ответ в виде достижения необходимого уровня фолатов крови, что особенно важно на этапе планирования беременности и во время гестации для профилактики ряда осложнений: внутриутробных пороков развития плода, эндотелиальных дисфункций и депрессивных расстройств у матери [11].
Сочетание двух высокотехнологичных молекул — активного фолата Quatrefolic® (глюкозаминовая соль 5-метилтетрагидрофолата) и микронизированного микроинкапсулированного пирофосфата железа в России представлено в итальянском комплексе Вожея® (производитель BMG Pharma). Доказательная база ранее проведенных исследований подтверждает, что компоненты комплекса позволяют решать ряд фармакокинетических и фармакодинамических проблем в восполнении дефицита основных микронутриентов (железа и фолиевой кислоты) у женщин репродуктивного возраста [12–14]. Для расширения доказательной базы эффективности комплекса инициировано и проведено многоцентровое проспективное клиническое исследование.
Цель исследования: оценить клиническую эффективность, безопасность, переносимость комплекса Вожея® для профилактики железодефицитной анемии и дефицита фолиевой кислоты у женщин на прегравидарном этапе и в ранние сроки беременности, а также комплаентность пациенток относительно его применения.
Содержание статьи
Материал и методы
Проведено многоцентровое проспективное клиническое наблюдательное исследование в четырех клинических центрах г. Екатеринбурга в период с мая по октябрь 2022 г. Протокол исследования одобрен локальным этическим комитетом РНИМУ им. Н.И. Пирогова Минздрава России 27.06.2022, выписка из протокола заседания локального этического комитета РНИМУ им. Н.И. Пирогова № 220. Все пациентки подписывали информированное согласие на участие в исследовании.
Критериями включения являлись: 1) датированная и подписанная форма информированного согласия; 2) возраст от 18 до 45 лет; 3) состояние прегравидарной подготовки или беременность до 12 нед. 4) уровень ферритина менее 15,0 нг/мл по данным лабораторного исследования; 5) решение врача о назначении исследуемого продукта амбулаторно.
Критериями невключения были: 1) наличие клинических или лабораторных признаков железодефицитной анемии (уровень Hb менее 110 г/л у беременных и 120 г/л у небеременных); 2) прием других препаратов/добавок, содержащих железо или фолиевую кислоту / фолаты, метотрексат и противосудорожные препараты; 3) противопоказания к применению исследуемого продукта.
Все включенные в исследование пациентки в рамках протокола осуществляли 5 визитов к врачу: визит скрининга (визит 1), визит включения в исследование с назначением комплекса через 1–7 дней после визита скрининга (визит 2) и 3 визита наблюдения через 30±7 дней (визит 3), 60±7 дней (визит 4) и 90±7 дней (визит 5) от назначения исследуемого комплекса.
На этапе скрининга проводился сбор социодемографической информации (возраст, рост, масса тела) и данных акушерско-гинекологического анамнеза (число беременностей и родов, наличие в анамнезе детей с пороками развития нервной трубки, бесплодия, невынашивания беременности, срок беременности (для беременных), факт приема ранее препаратов железа и развития побочных эффектов с их описанием, факт приема ранее фолиевой кислоты с указанием дозировки). Проводилась оценка наличия субъективных признаков анемии — жалоб на слабость, головокружение, усталость, снижение работоспособности, а также оценка клинических симптомов анемии с помощью физикального осмотра, в частности, оценивалось наличие бледности кожных покровов и слизистых. Лабораторная диагностика осуществлялась централизованно в лаборатории «СИТИЛАБ» (г. Екатеринбург) и включала: гематологические и феррокинетические показатели (с референсными значениями): гемоглобин (110–160 г/л у беременных и 121,3–148,70 г/л у небеременных), гематокрит (34,79–44,27%), эритроциты (3,83–4,86×1012/л) средний объем эритроцитов (81,30–100,12 (фл); показатели обмена железа (с референсными значениями): сывороточный ферритин (>15,0 нг/мл), сывороточное железо (5,8–34,5 мкмоль/л, насыщение трансферрина (15,0–50,0%); показатели обмена фолиевой кислоты: концентрация фолиевой кислоты в сыворотке крови (3,1–19,9 нг/мл).
В скрининге участвовала 121 женщина, но всем критериям включения соответствовали только 87 пациенток, которых и включили в исследование. Согласно дизайну все женщины были разделены на 2 группы: в 1-ю группу вошли 37 пациенток, планирующих беременность; 2-ю группу составили 50 беременных пациенток (срок до 12 нед.). Данным пациенткам на 2-м визите включения амбулаторно был назначен комплекс Вожея® внутрь по 1 таблетке 1 раз в день в соответствии с информацией из листка-вкладыша. Врачом была рекомендована продолжительность приема 3 мес.
На каждом визите наблюдения — через 30±7 дней (визит 3), 60±7 дней (визит 4) и 90±7 дней (визит 5) от назначения исследуемого комплекса — проводился опрос пациенток аналогично визиту скрининга на предмет наличия жалоб (субъективные признаки анемии), физикальный осмотр (клинические признаки анемии) с одновременным назначением контрольного лабораторного обследования (оценивались в динамике те же показатели крови, что и во время скрининга). Дополнительно оценивалась переносимость применения продукта путем опроса пациенток по 5-балльной визуально-аналоговой шкале: 1 балл означал плохую переносимость, 2 балла — хорошую ближе к плохой, 3 балла — хорошую переносимость, 4 балла — хорошую ближе к отличной, 5 баллов — отличную.
Для оценки профиля безопасности во время опроса фиксировались все нежелательные явления (НЯ) на фоне применения исследуемого комплекса, с их описанием в случае развития.
Для статистической обработки данных использовались стандартные пакеты программ (SPSS 23.0, MedCalc 12.5.0). Количественные и качественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро — Уилка (при числе исследуемых менее 50) или критерия Колмогорова — Смирнова (при числе исследуемых более 50). Для количественных данных, имеющих нормальное распределение, применялись: n, M±SD, где n — число наблюдений, M — среднее арифметическое, SD — стандартное отклонение. В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и квартилей (Q1; Q3). Достоверность различий проверялась с помощью параметрических и непараметрических методов статистики. При сравнении количественных показателей, распределение которых отличалось от нормального, в двух связанных группах использовался критерий Уилкоксона, при сохранении нормального распределения показателей — t-тест парных образцов. При сравнении качественных показателей в двух связанных группах использовался тест χ2 по методу МакНемара, если распределение было нормальным, и точный тест МакНемара в случае неправильного распределения. За критический уровень значимости при проверке статистических гипотез в данном исследовании принималась величина p<0,05.
Результаты исследования
Данные демографических показателей и акушерско-гинекологического анамнеза по группам представлены в таблице 1. Ни у одной из пациенток в анамнезе не отмечено детей/беременностей с пороками развития нервной трубки.
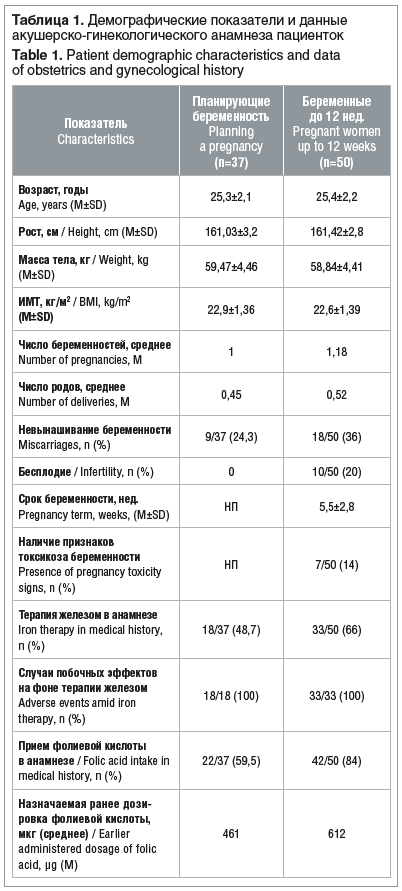
Первый и второй месяцы приема исследуемого комплекса завершили все 87 пациенток, третий — 85, т. е. полностью завершили курс приема более 97,7% пациенток. Только 2 (4%) пациентки из группы беременных не завершили курс по причине несоблюдения требований протокола.
При анализе жалоб у пациенток в 1-й и 2-й группах выявлено наличие субъективных признаков анемии в 8/37 (22%) и 12/50 (24%) случаях соответственно. На фоне приема исследуемого комплекса произошло полное разрешение субъективных признаков в обеих группах уже на 1-м месяце приема с сохранением результата в течение оставшегося срока наблюдения. Возникновения клинических признаков анемии также не отмечалось в ходе всех визитов наблюдения.
Анализ лабораторных показателей продемонстрировал положительную динамику по всем изученным лабораторным параметрам уже после 30 дней приема исследуемого продукта в обеих группах, эта динамика сохранялась на протяжении всего периода наблюдения (табл. 2 и 3).
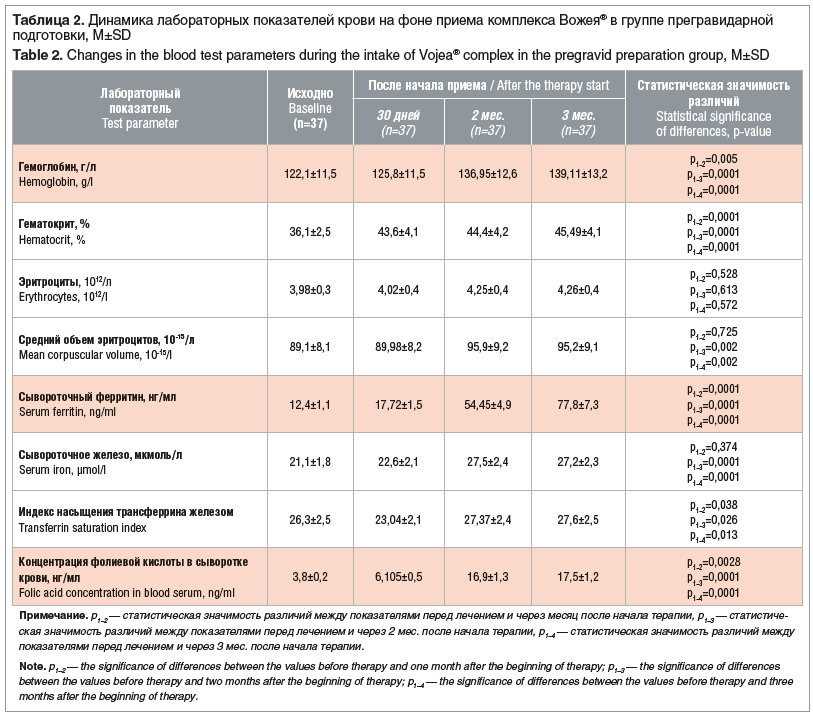
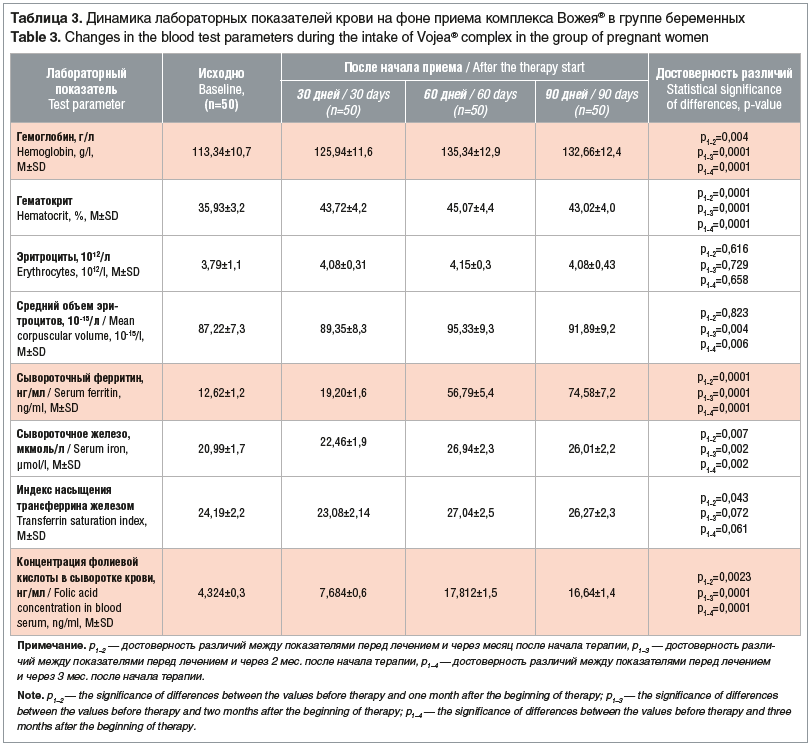
Прирост уровня гемоглобина через 3 мес. терапии в группе прегравидарной подготовки составил 17 (13,9%) единиц, уровень ферритина увеличился в 6,3 раза (клинически значимый — через 2 мес. приема), уровень фолатов плазмы крови — в 4,6 раза.
Количество женщин с нормальным уровнем гемоглобина (≥120 г/л у небеременных женщин) и нормальным уровнем ферритина (15–150 нг/мл), а также нормальным уровнем фолиевой кислоты в плазме (≥3 нг/мл) в группе планирующих беременность на 1, 2 и 3-м месяцах наблюдения составило 35/37 (94,6%), 37/37 (100%) и 37/37 (100%) соответственно. Отметим, что число пациенток с отсутствием предлатентного железодефицита (сывороточный ферритин ≥40 нг/мл) на 2-м и 3-м месяцах приема исследуемого комплекса составило 31/37 (83,8%) и 37/37 (100%) соответственно.
Во 2-й группе прирост уровня гемоглобина, учитывая прогрессирующую беременность, за 3 мес. приема исследуемого продукта составил 19 единиц (17%), уровень ферритина увеличился в 5,9 раза (клинически значимый — на 2-м месяце приема), уровень фолатов плазмы крови — в 3,9 раза.
Доля женщин в этой группе с нормальным уровнем гемоглобина (≥110 г/л) и нормальным уровнем ферритина (15–150 нг/мл), а также нормальным содержанием фолиевой кислоты в плазме (≥3 нг/мл) в группе беременных на 1, 2 и 3-м месяцах наблюдения составила 98, 100 и 100% соответственно. На 2-м и 3-м месяцах наблюдения уровень ферритина превышал 40 нг/мл у 98% (49/50) и 100% (48/48) пациенток, что говорило об отсутствии предлатентного железодефицита по завершении курса приема исследуемого комплекса.
В течение всего периода наблюдения доля пациенток с отличной и хорошей переносимостью исследуемого комплекса (4 и 5 баллов) составляла 100% в каждой из групп.
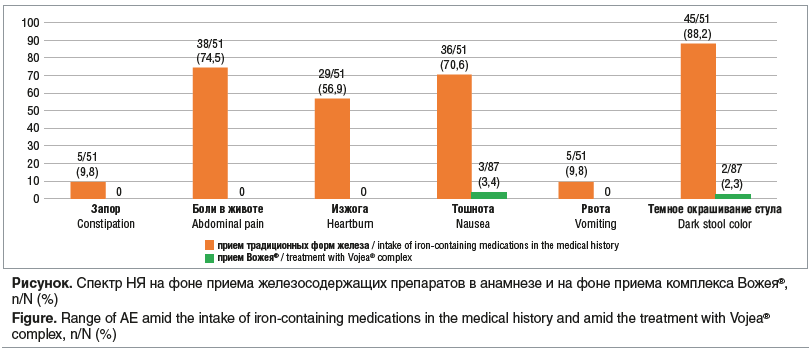
В 1-й группе НЯ отмечались только у 2/37 (5,4%) пациенток — наблюдалось темное окрашивание стула на 2-м месяце наблюдения. Во 2-й группе в течение 1-го месяца приема продукта отмечалось развитие НЯ в виде тошноты в 3/50 (6%) случаях с разрешением события в ходе оценки на последующих визитах, что, по всей видимости, могло быть также связано с симптомами токсикоза беременности.
Из 87 пациенток общей выборки, включенных в исследование, 51 женщина ранее принимала препараты железа. Сравнение спектра НЯ в этой выборке на фоне приема железосодержащих препаратов в анамнезе и на фоне приема Вожея® в течение трех месяцев показало лучший профиль безопасности в случае применения последнего (см. рисунок).
Обсуждение
Пименение комплекса Вожея® у женщин, находящихся на этапе прегравидарной подготовки, и беременных в I триместре показало высокую эффективность в профилактике клинических и лабораторных признаков железодефицитной анемии и дефицита фолиевой кислоты. У всех пациенток наблюдалось не только поддержание в норме показателей уровня гемоглобина крови и фолиевой кислоты в плазме крови, но и достижение нормального уровня ферритина (в рамках референcных значений) к 3-му месяцу приема данного комплекса. Ни у одной из пациенток не наблюдалось развитие клинических признаков анемии во время контрольных осмотров. При этом разрешение субъективных признаков анемии произошло у большинства пациенток уже через 1 мес. после начала приема исследуемого комплекса с сохранением результата на протяжении всего периода наблюдения. Положительная динамика наиболее информативных лабораторных показателей крови (гемоглобин, сывороточный ферритин, концентрация фолиевой кислоты в плазме крови) была отмечена после 1-го месяца приема с клинически значимым приростом в последующие 2 мес. Так, в обеих группах к 3-му месяцу приема исследуемого комплекса прирост уровня гемоглобина в среднем составил 18 единиц, уровень ферритина увеличился в 6 раз с клинически значимыми результатами (уровень более 40 нг/мл) через 60 дней приема комплекса, уровень фолатов плазмы крови увеличился в среднем в 4 раза. Важно, что и перенасыщения организма железом и фолатами по данным проведенных исследований не обнаружено.
Показатели, зарегистрированные после применения изученного нами комплекса, оказались сопоставимы с результатами применения других железосодержащих препаратов и фолиевой кислоты. Так, в нескольких отечественных работах применение препарата, содержащего 50 мг элементного железа (152 мг фумарата железа) и 500 мкг фолиевой кислоты, у пациенток с латентным железодефицитом на этапе планирования беременности привело к повышению содержания ферритина до 30 мкг/мл и более после трех месяцев приема [15, 16]. В настоящем исследовании повышение уровня ферритина до аналогичных значений отмечалось уже через 2 мес. приема, что могло свидетельствовать о высокой биодоступности.
Отметим, что применение продукта с сукросомальным железом в суточной дозе 30 мг в течение двух месяцев для коррекции выраженного железодефицита у беременных II триместра показало не столь выраженный прирост показателей ферритина, что, по всей видимости, было обусловлено степенью дефицита железа и большими сроками прогрессирующей беременности [17].
Действительно, основным, наиболее значимым параметром оценки эффективности применения железосодержащих препаратов для профилактики анемии является повышение показателя сывороточного ферритина — в нашем исследовании в 6 раз, со значительным ростом уже через 30 дней, но клинически значимым через 60 дней после приема комплекса. Отметим, что нормализация уровня ферритина, выполняющего роль основного внутриклеточного депо железа, т. е. его клинически значимый уровень, оценивается величиной более 30–40 нг/мл [18]. Как показывают исследования, более ранняя дотация железа (в том числе профилактическая, на стадии предлатентного дефицита железа и латентного дефицита железа, на ранних сроках беременности) позволяет получить быстрый и выраженный положительный эффект [19]. Прогностическая роль сывороточного ферритина как предиктора анемии, его значимое повышение на фоне приема исследуемого комплекса в сочетании с подъемом уровня гемоглобина свидетельствовали о рекомендательном значении комплекса в рамках стратегии менеджмента профилактики железодефицитных состояний.
В настоящем исследовании доля женщин с гематологическими, феррокинетическими показателями и показателем фолиевой кислоты, соответствующими референсным значениям лаборатории, через 30, 60 и 90 дней наблюдения составила в среднем 97, 100 и 100% соответственно, что свидетельствовало о хорошем эффекте комбинации микроинкапсулированного железа и активного метаболита фолиевой кислоты.
Анализ акушерского анамнеза выявил во всех группах пациенток доминирование репродуктивных потерь, что свидетельствовало о нахождении данных пациенток в группе риска по невынашиванию беременности. Пациенток с наличием детей с поражением нервной трубки плода в анамнезе среди включенных в исследование не оказалось. Возможно, это связано с тем, что при пороках нервной трубки плода происходило в большинстве случаев самопроизвольное прерывание беременности в ранние сроки, даже до посещения врача и проведения диагностических мероприятий (УЗИ), при этом генетический паспорт абортного материала в рутинном режиме в России не используется. Подход к подготовке и ведению таких пациенток должен учитывать в том числе достаточное снабжение организма фолатами. В последние годы клинические исследования по профилактике осложнений беременности, связанных с дефицитом в организме фолиевой кислоты, обращают внимание врача на дополнительный прием активных фолатов. Как показали исследования, активные фолаты — 5-метилтетрагидрофолат — обеспечивают лучшее насыщение фолатами эритроцитов крови, что особенно важно при подготовке к беременности [20]. Стоит отметить, что метаболит фолиевой кислоты Quatrefolic® является основным фолатом пуповинной крови плода [21]. Актуальность дополнительной дотации активных метаболитов фолиевой кислоты также обусловлена распространенностью полиморфизма генов ферментов фолатного цикла. В гомозиготном варианте полиморфизма отмечается более низкая усвояемость фолиевой кислоты — примерно 20–25% [22], что может иметь неблагоприятные последствия для развития плода и исхода беременности [23]. Данные факты определяют значимость оригинального комплекса Вожея® для беременных и планирующих беременность.
Помимо клинико-лабораторной эффективности, применение комплекса Вожея® в рамках настоящей работы показало высокий профиль безопасности, включающий минимальное число побочных эффектов со стороны желудочно-кишечного тракта и отличную переносимость комплекса в подавляющем большинстве случаев. Сопоставление профиля безопасности изучаемого комплекса с возникавшими ранее НЯ на фоне приема других форм железа (в частности, со стороны ЖКТ) в виде диспепсических явлений у этих же пациенток свидетельствовало о преимуществе исследуемого продукта практически по всем параметрам (боль в животе, изжога, рвота, тошнота), что предопределило высокую приверженность пациенток применению данного комплекса. По профилю безопасности исследованный комплекс также сопоставим с сукросомальным железом [24] и превосходит другие современные железосодержащие препараты [16, 25].
Заключение
Полученные в исследовании данные подтверждают целесообразность применения женщинами комплекса Вожея® в течение не менее трех месяцев для профилактики развития железо- и фолатдефицитных состояний. Безусловно, наблюдательный характер клинического исследования без активной группы сравнения не позволяет экстраполировать результаты на всю популяцию беременных и женщин, находящихся на этапе планирования. Однако в настоящей работе представлен первый опыт применения оригинального комплекса Вожея® у данной категории пациенток в реальной клинической практике. Планируются дальнейшие клинические исследования в данном направлении для расширения доказательной базы и опыта применения продукта у гинекологических пациенток. Преодоление гепсидинового барьера благодаря уникальной технологии микронизации и микроинкапсуляции железа, а также барьера полиморфизма генов ферментов фолатного цикла благодаря активному фолату Quatrefolic® дает возможность проведения дальнейших клинических исследований применения комплекса Вожея® у пациенток группы риска по развитию железодефицитных и фолиеводефицитных состояний различного профиля, включая бесплодие и невынашивание, воспалительные и даже онкологические заболевания.
Пероральная поддержка в течение трех месяцев гомеостаза железа и фолиевой кислоты комплексом Вожея® на этапе прегравидарной подготовки и в ранние сроки беременности обоснована клинической эффективностью, минимальным риском побочных эффектов и высокой комплаентностью.
Сведения об авторах:
Кононова Ирина Николаевна — д.м.н., доцент кафедры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; заместитель директора ООО «МЦДПО»; 125424, Россия, г. Москва, Волоколамское ш., д. 73, оф. 252; ORCID iD 0000-0003-3483-9464.
Карева Елена Николаевна — д.м.н., профессор кафедры молекулярной фармакологии и радиобиологии им. П.В. Сергеева РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; профессор кафедры фармакологии лечебного факультета ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-9441-3468.
Стебеняева Екатерина Валерьевна — врач акушер-гинеколог ООО «СМАРТЛАБ»; 620016, Россия, г. Екатеринбург, ул. Краснолесья, д.28, кв. 63.
Шмакова Надежда Александровна — врач акушер-гинеколог первой категории ООО МЦ «АНГИО ЛАЙН ПЛЮС»; 620027, Россия, г. Екатеринбург, ул. Еремина, д. 3, этаж 1; ORCID iD 0000-0002-4797-3876.
Грабан Ирина Владимировна — врач акушер-гинеколог высшей категории ООО Медицинский центр «Эдельвейс»; 624000, Россия, г. Арамиль, ул. 1 Мая, д. 2а.
Огурцова Татьяна Александровна — акушер-гинеколог высшей категории ГБУЗ СО «ЕКПЦ»; 620137, Россия, г. Екатеринбург, ул. Комсомольская, д. 9; ORCID iD 0000-0001-6180-0288.
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заслуженный врач РФ, заведующая кафедрой акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-2786-6181.
Орлова Светлана Владимировна — д.м.н., профессор, заведующая кафедрой диетологии и клинической нутрициологии РУДН; 117198, Россия, г. Москва, ул. Миклухо-Маклая, д. 6; ORCID iD 0000-0002-4689-3591.
Контактная информация: Кононова Ирина Николаевна, e-mail: irkonmed@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.03.2023.
Поступила после рецензирования 24.03.2023.
Принята в печать 14.04.2023.
About the authors:
Irina N. Kononova — Dr. Sc. (Med.), associate professor of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; Deputy Director, LLC «Interregional Center for Continuing Professional Education»; office 252, 73, Volokolamskoe Hwy, Moscow, 125424, Russian Federation; ORCID iD 0000-0003-3483-9464.
Elena N. Kareva — Dr. Sc. (Med.), Professor of the P.V. Sergeev Department of Molecular Pharmacology and Radiobiology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; Professor of the Department of Pharmacology of the Medical Faculty, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0002-9441-3468.
Ekaterina V. Stebenyaeva — obstetrician-gynecologist, LLC «SMARTLAB»; apt. 63, 28, Krasnolesiya str., Yekaterinburg, 620016, Russian Federation.
Nadezhda A. Shmakova — obstetrician-gynecologist of the first category, LLC Medical Center «ANGIO LINE PLUS», 3, Eremin str., Yekaterinburg, 620027, Russian Federation; ORCID iD 0000-0002-4797-3876.
Irina V. Graban — obstetrician-gynecologist of the highest category, LLC Medical Center «Edelweiss»; 3a, 1st of May str., Aramil, 624000, Russian Federation.
Tatiana A. Ogurtsova — obstetrician-gynecologist of the highest category, Yekaterinburg Clinical Perinatal Center; 9, Komsomolskaya str., Yekaterinburg, 620137, Russian Federation; ORCID iD 0000-0001-6180-0288.
Yuliya E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-2786-6181.
Svetlana V. Orlova — Dr. Sc. (Med.), Professor, Head of the Department of Clinical Nutrition and Nutritional Science, Russian University of Peoples’ Friendship; 6, Miklukho-Maklaya str., Moscow, 117198, Russian Federation; ORCID iD 0000-0002-4689-3591.
Contact information: Irina N. Kononova, e-mail: irkonmed@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 02.03.2023.
Revised 24.03.2023.
Accepted 14.04.2023.
Информация с rmj.ru






