Введение
Довольно распространенной медико-социальной проблемой в настоящее время является травматизм, частота которого растет в связи с широким использованием режущих инструментов в производственных процессах и в быту. Наиболее сложными для хирургического лечения являются случаи травматического отчленения конечностей, но с помощью операционного микроскопа и микрохирургического инструментария удается восстановить их анатомическую целостность. В большинстве случаев пациенты отмечают полную субъективную удовлетворенность результатом операции, однако при обследовании в отдаленные сроки после реплантации выявляется неполное функциональное восстановление [1, 2]. Одним из факторов, снижающих эффективность хирургического лечения при травмах с повреждением мышц, сосудов и нервов конечностей, считается рубцово-спаечный процесс, развитие которого вынуждает хирургов проводить повторные вмешательства [3, 4] и удлиняет период реабилитации [5]. Естественно полагать, что при реплантации конечностей со сшиванием сосудов, нервов и мышц развивающийся в той или иной степени фиброз должен влиять на результат операции, особенно проявляющийся в отдаленные сроки. Отсюда вытекает задача выяснения характера фиброзных изменений после реплантации, а также разработки методов их предупреждения. Описано применение в эксперименте коллагеновой мембраны и аутовены для снижения фиброзных изменений при сшивании нерва, однако гистологический анализ не выявил существенного уменьшения экстраневральной или интраневральной рубцовой ткани [6]. Более эффективными для коррекции и предупреждения фиброза зарекомендовали себя аллогенные биоматериалы, которые применяются как стимуляторы регенерации при замещении различных дефектов [7, 8].
Цель исследования: в ходе экспериментальной работы выявить характер рубцовых изменений после реплантации конечности и изучить возможность предупреждения фиброза с помощью аллогенного биоматериала.
Содержание статьи
Материал и методы
Эксперимент проведен на 48 половозрелых крысах-самцах породы Вистар (по 24 животных в контрольной и опытной группах). Техника операции заключалась в круговом разрезе мягких тканей в средней трети бедра без повреждения бедренной кости с последующим микрохирургическим сшиванием сосудов, нервов, мышц и кожи. В опытной группе на раневые поверхности перед сшиванием наносили аллогенный диспергированный биоматериал (АДБ), представляющий собой стерильный порошок из измельченной соединительной ткани, предварительно прошедшей физико-химическую обработку с целью децеллюляризации (технология Аллоплант®1 [9], разработанная во Всероссийском центре глазной и пластической хирургии ФГБОУ ВО БГМУ Минздрава России.
Эксперимент проводили с соблюдением правил работы с лабораторными грызунами и кроликами2 согласно приказу Минздрава России3. Операции проводили под операционным микроскопом Takagi OM-10 (Takagi, Япония). Для исследования динамики морфологических изменений животных выводили из опыта через 7, 14, 30 и 90 сут после операции. Гистологические срезы окрашивали по Ван Гизону, а также гематоксилином и эозином. Исследование и микрофотосъемку препаратов осуществляли с помощью микроскопа Leica DM 2500 (Leica, Германия) с программным обеспечением захвата и анализа изображений. Для иммуногистохимического исследования применяли непрямую стрептавидин-биотиновую систему детекции Leica BOND (Novocastra™, Германия) с использованием иммуногистостейнера Leica Microsystems Bond™ (Германия). Применяли следующие антитела (АТ): АТ к трансформирующему фактору роста (TGF-β1) в разведении 1:300, АТ к фактору некроза опухоли (TNF-α) в разведении 1:300, АТ к антигену главного комплекса гистосовместимости (HLA-DR) в разведении 1:300, АТ к маркеру миосателлитоцитов (MyoD) в разведении 1:50 (Santa Cruz Biotechnology, США).
Специфичность реакции оценивали на срезах, окрашенных без первичных АТ. Подсчет клеток производили в 20 полях зрения каждого образца.
Для статистической обработки данных был использован пакет программ Statistica 10,0. Из-за особенностей исходных данных использовали непараметрические методы — ранговый дисперсионный анализ по Краскелу — Уоллису и критерий Манна — Уитни для сравнения результатов отдельных сроков наблюдения внутри одной серии опытов или между ними. Различия считались статистически значимыми при p<0,05.
Результаты исследования
В контрольной группе в начальные сроки эксперимента (через 7 сут) в зоне операции отмечалась типичная картина альтерационной фазы асептического воспаления в виде инфильтрации полиморфноядерными лейкоцитами, макрофагами и фибробластами. Определялись признаки отека и плазматического пропитывания тканей. Через 14 сут от момента операции у животных появлялись морфологические признаки пролиферативной фазы воспаления: образование грануляционной ткани с выраженной инфильтрацией фибробластами и признаками интенсивного коллагеногенеза. Новообразованные коллагеновые волокна формировали пучки вокруг сшитых сосудов и нервов, а также между фрагментами поврежденных мышечных волокон. В более поздние сроки (через 30 сут) обнаруживалась тенденция к утолщению пучков коллагеновых волокон вокруг сосудов и нервов. Также наблюдалось утолщение пучков коллагеновых волокон, образующих перимизий и эндомизий. В структуре перимизия можно было видеть кровеносные сосуды, но в эндомизии они не обнаруживались. В конечный срок эксперимента (через 90 сут) наблюдались своеобразные фиброзные муфты вокруг сосудов и нервов, а также очаги фиброза между сшитыми мышцами. Признаки регенерации поврежденных мышечных волокон не обнаруживались в течение всего эксперимента, о чем свидетельствует отрицательный результат иммуногистохимического исследования по выявлению MyoD+-клеток. Динамика морфологических изменений в зоне операции у животных контрольной группы представлена на рисунке 1.
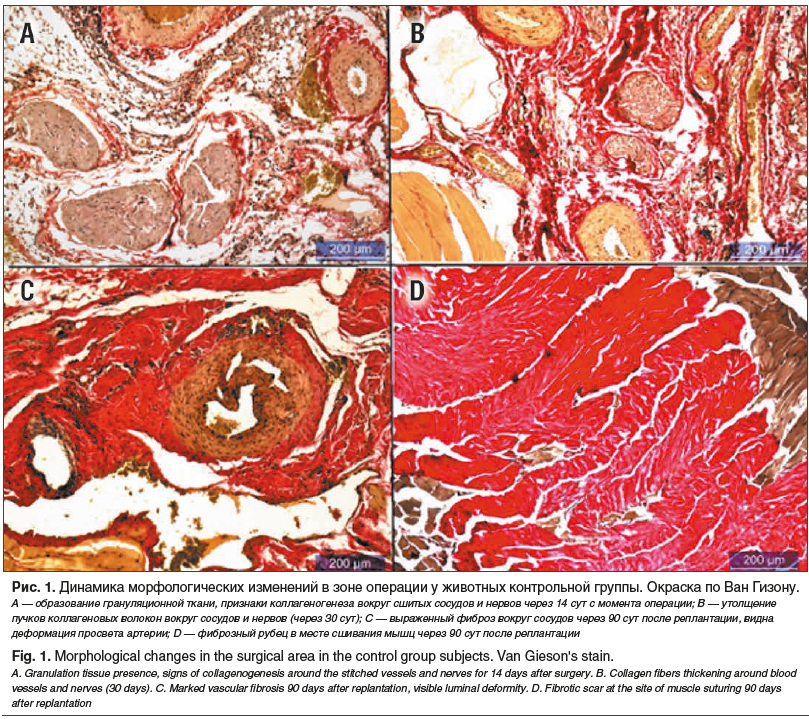
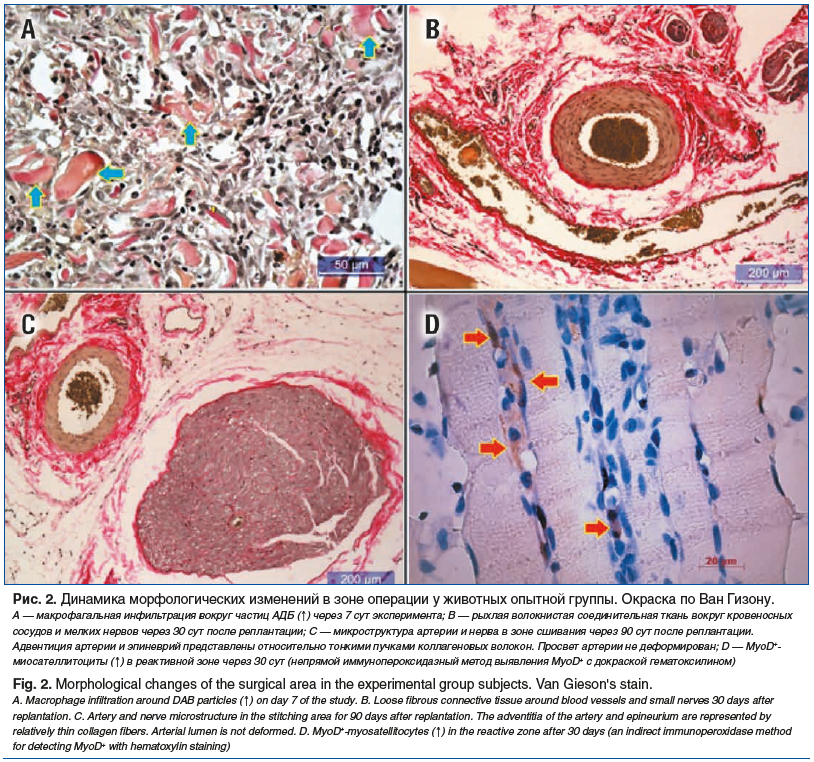
В опытной группе животных через 7 сут после операции наблюдались те же признаки начальной фазы асептического воспаления, что и в контрольной группе, но в клеточном инфильтрате можно было наблюдать относительное преобладание макрофагов, которые концентрировались вокруг частиц введенного биоматериала. Через 14 сут в зоне оперативного вмешательства частицы биоматериала уже не определялись, но макрофагальная инфильтрация сохранялась. Слабо выраженные фиброзные оболочки вокруг сшитых сосудов и нервов состояли из более тонких, чем в контрольной группе, пучков коллагеновых волокон. В местах сшивания мышц рубцовые изменения не определялись. Перимизий и эндомизий были хорошо васкуляризованы. В более поздние сроки (через 30 и 90 сут) васкуляризация сохранялась, а оболочки вокруг сосудов и нервов были представлены относительно тонкими, рыхло расположенными пучками коллагеновых волокон. Иммуногистохимическое окрашивание для выявления MyoD+-клеток (миосателлитоциты) показало, что у животных опытной группы MyoD+-клетки начинали выявляться через 14 сут эксперимента, а через 30 сут их количество увеличивалось. Миосателлитоциты формировали тяжи прогениторных мышечных клеток, выстраивающихся конец-в-конец с последующим формированием миотуб, что свидетельствовало о регенерации мышечных волокон в месте повреждения (рис. 2).
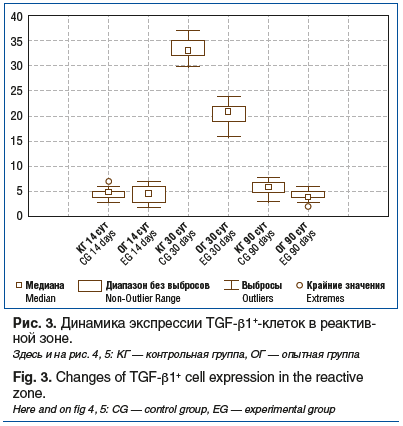
Иммуногистохимическое исследование динамики экспрессии TGF-β1 выявило, что наиболее значимые показатели (наличие/отсутствие) обнаруживались в период до 30 сут, который совпадает с фазой пролиферации. У животных контрольной группы количество клеток, экспрессирующих TGF-β1, достоверно преобладало по сравнению с опытной группой. В начальные и конечные сроки внутри- и межгрупповые данные значимо не отличались (рис. 3).
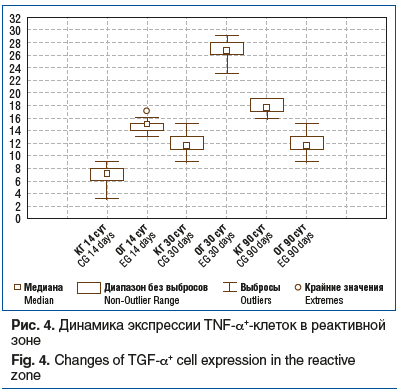
При определении TNF-α выявлено, что в начальные сроки наблюдения экспрессия данного цитокина у животных опытной группы значимо превосходила таковую в контрольной группе. По мере прогрессирования воспаления и перехода в пролиферативную фазу число TNF-α+-клеток в обеих группах увеличивалось и преобладало в опытной группе. Со временем (через 90 сут) происходило заживление дефекта и обнаруживалось снижение численности данных клеток в обеих группах (рис. 4).
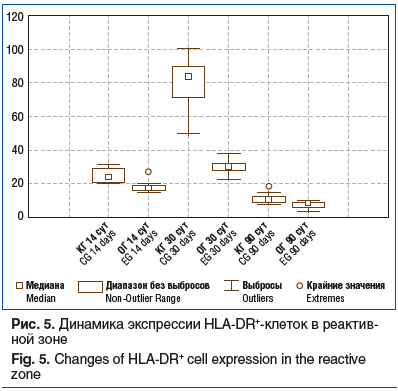
Исследование экспрессии HLA-DR показало, что в начальные сроки наблюдения (14 сут) внутригрупповые данные численности клеток значимо не различались, что может быть связано с развитием стадии альтерации после повреждения мышечной ткани. Через 30 сут в количественном отношении HLA-DR+-клетки кратно увеличивались в контрольной группе по сравнению с опытной группой (р≤0,05). В конечные сроки (через 90 сут) наблюдения численность данных клеток резко сокращалась в соответствии с затуханием репаративного ответа (рис. 5).
Обсуждение
Проведенное исследование показало, что динамика морфологических изменений у животных контрольной группы представляет собой стереотипный процесс асептического воспаления, развивающегося как реакция на операционную травму [10]. Как правило, пролиферативная фаза посттравматического воспаления заканчивается образованием фиброзного рубца [11]. Собственно, фиброзный рубец является следствием синтеза коллагена фибробластами [12]. Фактором, стимулирующим пролиферативную активность фибробластов и синтез коллагена, является цитокин TGF-β1, повышенная экспрессия которого отмечается в пролиферативной фазе воспаления [13]. Вышеизложенное описание подтверждают и результаты проведенного нами иммуногистохимического исследования: экспрессия TGF-β1 у животных контрольной группы была относительно высокой и достигала пиковых значений через 30 сут после реплантации. Особенностью выявленных нами фиброзных изменений при реплантации конечности является то, что у животных контрольной группы рубец локализовался не только в местах сшивания мышц, но и вокруг сшитых сосудов и нервов. Так как свойством рубцовой ткани является контракция, можно предположить, что фиброзные муфты, образующиеся вокруг сосудов и нервов, будут приводить к сужению просвета сосудов и сдавлению нервов и, следовательно, к ухудшению кровоснабжения и иннервации пришитого сегмента конечности. Клинически это может проявляться в виде жалоб оперированных пациентов на плохую переносимость холода [14, 15]. Между сшитыми фрагментами мышц нами также выявлены участки фиброза, причиной которого может быть высокая экспрессия TGF-β1. Установлено, что при повреждении скелетных мышц во взрослом организме TGF-β негативно влияет на их регенерацию, подавляя пролиферацию миосателлитоцитов, слияние миофибрилл и экспрессию некоторых специфичных для мышц генов [16]. Более того, TGF-β1 индуцирует трансформацию миогенных клеток в фиброзные [17]. Фактором, ингибирующим экспрессию TGF-β1, является TNF-α [18], который в основном высвобождается из стимулированных моноцитов и макрофагов [19]. В данном эксперименте такое подавление экспрессии TGF-β1 проявлялось через 14–30 сут после реплантации.
Определенный вклад в заживление раны с образованием фиброзного рубца, по-видимому, вносит и HLA-DR, сравнительно высокая экспрессия которого у животных контрольной группы наблюдалась на протяжении всего эксперимента. Отмечена тесная корреляция между экспрессией HLA-DR и фиброзом [20]. Выявленные различия в динамике экспрессии указанных цитокинов у животных контрольной и опытной групп, по-видимому, обусловлены наличием АДБ, частицы которого являются аттрактантами для макрофагов с провоспалительным фенотипом М1, экспрессирующим TNF-α [21]. Известно, что макрофаги — это гетерогенные клетки и они могут проявлять полярность. Макрофаги системы М1 — клетки с провоспалительной направленностью, секретируют TNF-α, интерлейкины 1 и 6 (IL-1 и 6), отвечают за антимикробную деятельность, хемотаксис фагоцитарных клеток, стимуляцию иммуногенеза, ангиогенез [22]. Макрофаги противовоспалительной системы активации М2 секретируют TGF-β, IL-10 и являются промотором фиброза и иммуносупрессором [23]. Провоспалительная реакция, вызванная введением аллогенного биоматериала, приводит к его деградации и высвобождению биоактивных компонентов, связанных с матриксом, которые действуют как сигналы для миграции, пролиферации и дифференцировки клеток, тем самым обеспечивая оптимальные условия для регенерации [24]. На поздних стадиях провоспалительные клетки исчезают и появляются противовоспалительные клетки, что включает поляризацию макрофагов до фенотипа М2 [25]. Результаты иммуногистохимического исследования показали, что при использовании аллогенного биоматериала удлиняется период активности М1 макрофагов и поддерживается более высокая экспрессия TNF-α, что замедляет процесс фиброза вокруг воссоединенных сосудов и нервов и способствует регенерации мышечных волокон, о чем свидетельствуют активация MyoD+-миосателлитоцитов [26] и их дифференциация в миосимпласты.
Заключение
Проведенное экспериментальное исследование показало, что при реплантации конечности возникает асептическое воспаление, в пролиферативной фазе которого формируются фиброзные муфты вокруг воссоединенных сосудов и нервов, а также очаговый фиброз между фрагментами сшитых мышц. Описанные морфологические изменения коррелируют с высокой экспрессией TGF-β1 и HLA-DR. Использование при данной операции диспергированного биоматериала позволяет изменить течение раневого процесса за счет активации макрофагов провоспалительного фенотипа, что проявляется значительно более высокой экспрессией TNF-α, коррелирующей с низкой экспрессией TGF-β1 и HLA-DR. В этих условиях не развивается фиброз вокруг сосудов и нервов и наблюдается регенерация поврежденных мышечных волокон, о чем свидетельствует обнаружение MyoD+-миосателлитоцитов.
Таким образом, применение при реплантации конечности АДБ способствует ингибированию фиброза и стимуляции прогениторных мышечных клеток.
1Регистрационное удостоверение на медицинское изделие ФСР 2011/12012 ТУ 9398-001-04537642-2011 от 03.02.2015.
2ГОСТ 33216-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами».
3Приказ Минздрава России от 01.04.2016 № 199н «Об утверждении правил надлежащей лабораторной практики».
СВЕДЕНИЯ ОБ АВТОРАХ:
Муслимов Сагит Астахович — д.м.н., ведущий научный сотрудник Института фундаментальной медицины ФГБОУ ВО БГМУ Минздрава России; 450075, Россия, г. Уфа, ул. Рихарда Зорге, д. 67/1; ORCID iD 0000-0002-9076-0251.
Ибрагимов Руслан Кабирович — к.м.н., доцент кафедры факультетской хирургии ФГБОУ ВО БГМУ Минздрава России; 450075, Россия, г. Уфа, ул. Рихарда Зорге, д. 67/1; врач-хирург, пластический хирург ООО «Мастерская красоты +»; 450075, Россия, г. Уфа, ул. Салавата, д. 17; ORCID iD 0009-0005-3518-0675.
Лебедева Анна Ивановна — д.б.н., заведующая научно-исследовательским отделом морфологии Всероссийского центра глазной и пластической хирургии ФГБОУ ВО БГМУ Минздрава России; 450075, Россия, г. Уфа, ул. Рихарда Зорге, д. 67/1; ORCID iD 0000-0002-9170-2600.
Контактная информация: Муслимов Сагит Асхатович, е-mail: msagit@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 27.02.2024.
Поступила после рецензирования 21.03.2024.
Принята в печать 15.04.2024.
ABOUT THE AUTHORS:
Sagit A. Muslimov — Dr. Sc. (Med.), Leading Researcher at the Institute of Fundamental Medicine, Bashkir State Medical University; 67/1, Richard Sorge str., Ufa, 450075, Russian Federation; ORCID iD 0000-0002-9076-0251.
Ruslan K. Ibragimov — C. Sc. (Med.), Associate Professor of the Department of Surgery, Bashkir State Medical University; 67/1, Richard Sorge str., Ufa, 450075, Russian Federation; surgeon, plastic surgeon, «Masterskaya Krasotу +» LLC; 17, Salavat str., Ufa, 450075, Russian Federation; ORCID iD 0009-0005-3518-0675.
Anna I. Lebedeva — Dr. Sc. (Bio.), Head of the Research Department of Morphology, All-Russian Center for Ocular and Plastic Surgery, Bashkir State Medical University; 67/1, Richard Sorge str., Ufa, 450075, Russian Federation; ORCID iD 0000-0002-9170-2600.
Contact information: Sagit A. Muslimov, e-mail: msagit@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 27.02.2024.
Revised 21.03.2024.
Accepted 15.04.2024.
Информация с rmj.ru
