Введение
В настоящее время распространенность фибрилляции предсердий (ФП) неуклонно растет, составляя 2% во всем мире, а среди лиц в возрасте 80 лет и старше достигает 10–12% [1, 2]. Несмотря на успехи в ведении пациентов с ФП, последняя остается значимой медико-социальной проблемой и является одной из основных причин смерти пациентов от сердечно-сосудистых заболеваний (ССЗ), приводя к летальному исходу в 1,5–2 раза чаще при отсутствии рациональной фармакотерапии [3]. Наличие ФП ассоциировано с двукратным увеличением риска развития инфаркта миокарда (ИМ) (отношение рисков (ОР) 1,96; 95% доверительный интервал (ДИ) 1,52–2,52) [4]. Общая распространенность острого коронарного синдрома (ОКС) в когорте пациентов с ФП превышает таковую в общей популяции и, согласно результатам метаанализа [5], варьирует от 28 до 61%. Сочетание ОКС и ФП сопровождается значимым ухудшением прогноза, требуя специфического подхода к терапии и оценке факторов, влияющих на эффективность и безопасность антитромботической терапии в данной когорте пациентов.
Согласно клиническим рекомендациям Минздрава России[1],[2]
[6] после перенесенного чрескожного коронарного вмешательства (ЧКВ) для снижения риска развития тромботических осложнений пациентам показана двойная антиагрегантная терапия. Наличие ФП, в свою очередь, служит показанием для назначения антикоагулянтов с целью предотвращения тромбоэмболических событий. В связи с этим рациональная тактика ведения таких пациентов подразумевает назначение тройной антитромботической терапии (ТАТ) с последующим переходом на двойную антитромботическую терапию (ДАТ) сроком до 12 мес. Применение ДАТ, в свою очередь, ассоциировано с высоким риском развития клинически значимых кровотечений: по данным метаанализа [7], включавшего 30 866 пациентов с недавно перенесенным ОКС, добавление к антиагрегантной терапии прямого орального антикоагулянта (ПОАК) увеличивало риск кровотечений в группе пациентов, применяющих ДАТ, на 79%, а среди пациентов, принимающих ТАТ, — на 134%.
Одним из основных факторов, увеличивающих риск развития кровотечений у пациентов с ФП, является анемия [8, 9]. Распространенность последней у пациентов с ФП, по данным метаанализа S. Tu et al. [8], составляет 16%. По результатам исследования A.N. Bonde et al. [9], анемия легкой степени определялась у 20% пациентов с ФП, а анемия средней/тяжелой степени — у 14%. Результаты анализа данных регистра пациентов с ФП, которым было выполнено стентирование коронарных артерий (как в плановом порядке, так и экстренно), свидетельствуют о том, что анемия является независимым предиктором смертности от всех причин, повышенного риска развития серьезных неблагоприятных ССЗ и цереброваскулярных событий [10].
Наиболее часто анемия у пациентов с ФП развивается вследствие кровотечений, риск возникновения которых возрастает при применении антикоагулянтов, в особенности ДАТ [6]. Кроме того, влияние сопутствующей патологии (хроническая сердечная недостаточность (ХСН), хроническая болезнь почек (ХБП) и др.), дефицит железа и витамина В12 вносят значимый вклад в генез анемии у пациентов изучаемой когорты, однако их роль зачастую недооценивается [6–12].
Работы, в которых оценивали частоту встречаемости дефицита микроэлементов, в том числе железа, у пациентов с ФП, на сегодняшний день единичны и в большинстве своем представлены исследованиями с ретроспективным дизайном и небольшим объемом выборки. Так, по результатам исследования M. Keskin et al. [11] (n=101), дефицит железа был выявлен у 47,6% пациентов. Исследования, в которых оценивали бы дефицитные состояния у пациентов с ФП, перенесших ОКС, в настоящее время не опубликованы [12].
Цель исследования: оценка распространенности анемии и дефицита железа у пациентов с ФП, получающих ДАТ.
Материал и методы
В проспективное открытое когортное исследование было включено 69 пациентов (медиана возраста 71 [64; 78] год, 46 (66,7%) мужчин).
Критерии включения в исследование: возраст ≥18 лет; неклапанная ФП; риск по шкале CHA2DS2-VASc ≥1 балла для мужчин и ≥2 баллов для женщин; перенесенный ОКС не менее 3 мес. назад; прием ДАТ: ривароксабан/апиксабан в сочетании с любым антиагрегантом.
Критерии невключения в исследование: обратимые причины ФП; сопутствующая системная патология, психические, гематологические и онкологические заболевания; выраженная печеночная и почечная недостаточность; беременность; клинически значимое кровотечение; прием ТАТ и другие состояния, сопровождающиеся существенным повышением риска кровотечений.
Критерии исключения из исследования: отказ от участия в исследовании, беременность; развитие ОКС в период наблюдения; отмена антиагреганта или антикоагулянта, в том числе замена на другую схему лечения (варфарин, дабигатрана этексилат); низкая приверженность пациента к антитромботической терапии, отмеченная в период наблюдения.
Лабораторное обследование пациентов включало клинический анализ крови для определения содержания гемоглобина, биохимический анализ крови с показателями обмена железа и определением содержания высокочувствительного С-реактивного белка (вч-СРБ).
Настоящее исследование одобрено этическим комитетом ФГБОУ ДПО РМАНПО Минздрава России (протокол № 12 от 10.10.2023).
Статистический анализ выполнен в программном пакете IBM SPSS Statistics 27 (IBM, США). Нормальность распределения количественных переменных оценивали с помощью критерия Шапиро — Уилка. Для описания параметров, представляющих собой ненормальное распределение количественных переменных, рассчитывали медиану (Ме) и интерквартильный размах в виде 1-го и 3-го квартилей [Q1; Q3]. Нормально распределенные количественные переменные представляли в виде среднего значения (M) и стандартного отклонения (Standard Deviation, SD). Для сравнения нескольких независимых выборок использован критерий Краскела — Уоллиса. При анализе различий количественных показателей использовали t-критерий Стьюдента либо критерий Манна — Уитни (в зависимости от характера распределения данных), а при сравнении качественных показателей — критерий χ2. Статистически значимыми считали различия при р<0,05.
Содержание статьи
Результаты исследования
Анемия была диагностирована у 20 (29%) пациентов (медиана возраста 75 [65; 84] лет), которые были распределены в группу «ФП + анемия». Латентный дефицит железа (ЛДЖ) без развития анемии был выявлен у 14 (20%) пациентов (медиана возраста 68 [62; 76] лет), включенных в группу «ФП + ЛДЖ». Оставшиеся 35 (51%) пациентов (медиана возраста 70 [62; 77] лет) с ФП без анемии и ЛДЖ, перенесшие ОКС и получающие ДАТ, составили группу «ФП». В целом дефицит железа (изолированно или одновременно с наличием анемии) выявлен у 32% пациентов с ФП, перенесших ОКС.
Общая характеристика включенных в исследование пациентов представлена в таблицах 1 и 2.
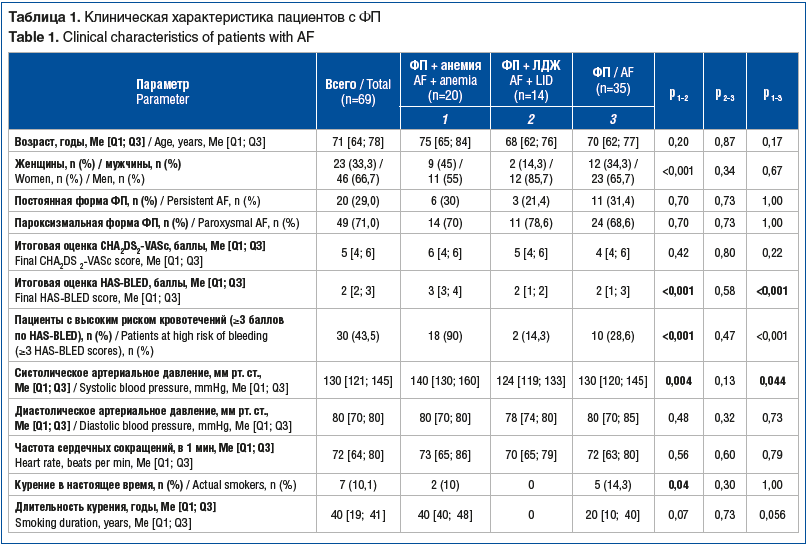

При сравнении сопутствующей патологии было показано, что у пациентов группы «ФП» статистически значимо чаще встречалась ХСН II функционального класса (ФК) по NYHA (New York Heart Association) по сравнению с группами «ФП + анемия» и «ФП + ЛДЖ» (88,6% против 50% и 35,7%, р<0,001 и р=0,03 соответственно). При этом ХСН III ФК преобладала в группе пациентов с ФП и сопутствующей анемией, чем в группе «ФП» (45% против 5,7%, р<0,001). В группе «ФП + анемия» эпизоды кровотечений в анамнезе встречались у 16 (80%), в группе «ФП + ЛДЖ» — у 9 (64,3%), а в группе «ФП» — у 24 (68,6%) пациентов, различия между группами статистически незначимы.
Анемия легкой степени (концентрация гемоглобина 110–119 г/л у женщин, 110–129 г/л у мужчин) [13, 14] была диагностирована у 16 (23,2%) пациентов, включенных в исследование, у 4 (5,8%) выявлена анемия средней степени тяжести (концентрация гемоглобина 80–109 г/л) [13, 14], при этом дефицит железа определялся только у 8 (40%) из 20 пациентов с анемией. У пациентов группы «ФП + ЛДЖ» уровень ферритина был статистически значимо ниже, чем в группе пациентов с анемией (22,1 [15,7; 33,0] мкг/л против 52,9 [16,1; 114,7] мкг/л, р=0,017). При сравнении показателей креатинина и рСКФ обнаруженные различия были статистически незначимы. При сравнительном анализе 3 групп выявлено статистически значимое различие концентрации вч-СРБ (p=0,023) (табл. 3).
![Таблица 3. Сравнительная характеристика данных лабораторного обследования, Ме [Q1; Q3] Table 3. Comparative characteristics of laboratory examination data, Me [Q1; Q3] Таблица 3. Сравнительная характеристика данных лабораторного обследования, Ме [Q1; Q3] Table 3. Comparative characteristics of laboratory examination data, Me [Q1; Q3]](https://medblog.su/wp-content/uploads/2025/04/1744499455_533_Otsenka-rasprostranennosti-anemii-i-defitsita-zheleza-u-patsientov-s-fibrillyatsiej.png)
В группах пациентов с ФП в сочетании с анемией/ЛДЖ все пациенты принимали клопидогрел 75 мг/сут, в то время как в группе «ФП» 5,7% пациентов получали в качестве антиагрегантной терапии ацетилсалициловую кислоту в суточной дозе 100 мг. Среди пациентов группы «ФП + анемия» чаще всего отмечалось необоснованное снижение дозы ПОАК (у 9 (45%) пациентов, 6 из которых принимали ривароксабан, 3 — апиксабан); в группе «ФП + ЛДЖ» доза ПОАК было снижена у 3 (21%) пациентов, 2 из которых принимали ривароксабан и 1 — апиксабан. Передозировка ПОАК (отсутствие снижения дозы, как того требует инструкция по применению препаратов) отмечена только у 1 пациента, принимавшего ривароксабан (табл. 4).
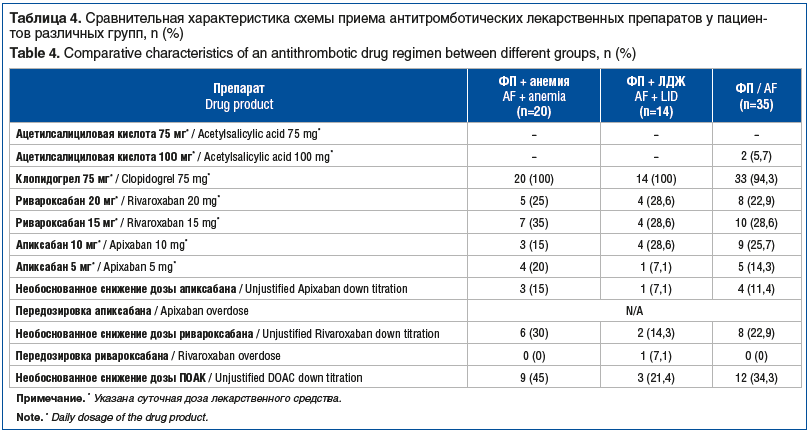
При сравнении 3 групп различия частоты необоснованного снижения дозы ПОАК, как ривароксабана, так и апиксабана, были статистически незначимы (p=0,65 и р=0,79 соответственно).
Обсуждение
Увеличение числа пациентов с ФП, перенесших ОКС, ставит перед практическим здравоохранением задачу выбора оптимальной антитромботической терапии с учетом рисков развития тромботических/тромбоэмболических, ишемических и геморрагических событий [13]. В связи с этим в данной когорте пациентов необходимо оценивать факторы риска кровотечений, как немодифицируемые, так и модифицируемые [14]. Одним из потенциально обратимых факторов риска развития кровотечений, оказывающих значимое влияние на прогноз у пациентов с ФП, является анемия, которая часто диагностируется в этой когорте пациентов [15–18].
В настоящем исследовании анемия была выявлена у 29% участников, при этом в 5,8% случаев диагностирована анемия средней степени тяжести. Согласно данным литературы распространенность анемии в когорте пациентов с ФП варьирует в широких пределах и зависит от размера выборки, исследуемой популяции пациентов, а также наличия определенных сопутствующих заболеваний, например ХБП [9, 10, 17, 18]. Так, анемия встречалась у 12,5% пациентов с ФП на момент их включения в исследование Apixaban for Reduction in Stroke and other Thromboembolic Events in Atrial Fibrillation (ARISTOTLE) (n=18 103) [17]. Сходные результаты были получены в исследовании Randomized Evaluation of Long Term Anticoagulant Therapy (RE-LY) [18]: среди включенных 17 796 пациентов с ФП анемия была диагностирована у 11,9% участников. По данным датского обсервационного когортного исследования [9], включавшего 18 734 пациента с ФП, у 20% была выявлена анемия легкой степени (содержание гемоглобина 6,83–7,45 ммоль/л для женщин и 6,83–8,03 ммоль/л для мужчин), а у 14% — анемия умеренной/тяжелой степени (концентрация гемоглобина <6,83 ммоль/л). В другом исследовании (n=7558 пациентов) [19] установлено, что частота встречаемости анемии в японской популяции пациентов с ФП составила 28%, анемия легкой степени (уровень гемоглобина 11,0–12,9 г/дл для мужчин и 11,0–11,9 г/дл для женщин) определялась у 18%, анемия умеренной/тяжелой степени (содержание гемоглобина <11,0 г/дл как у мужчин, так и у женщин) — у 10% участников. В когорте пациентов с ФП, перенесших ЧКВ, по данным регистра Atrial Fibrillation undergoing Coronary Artery Stenting (AFCAS) [10] (n=861), анемия (концентрация гемоглобина <12 г/дл у женщин и <13 г/дл у мужчин) определялась у 30% пациентов, при этом анемия тяжелой степени (уровень гемоглобина <10 г/дл) диагностирована у 2,8%.
По данным многочисленных исследований, анемия является независимым модифицируемым фактором, увеличивающим риск кровотечений, серьезных сердечно-сосудистых событий и смертности от всех причин у пациентов с ФП [8, 9, 17, 18]. Однако причины и механизмы этих взаимосвязей остаются неясными и недостаточно изученными. Анемия также часто встречается и при других ССЗ, при которых механизм ее развития изучен более полно и часто обусловлен дефицитом железа. Например, в популяции больных с ХСН распространенность дефицита железа составляет около 20–30% [20, 21].
В представленном исследовании дефицит железа изолированно или одновременно с анемией выявлен у 32% пациентов с ФП, перенесших ОКС. На данный момент в доступной литературе отсутствуют данные о распространенности дефицита железа у пациентов с ФП, получающих ДАТ. В настоящее время анемия и дефицит железа не являются предметом рутинного скрининга у пациентов с ФП и/или ИБС в отличие от пациентов с ХСН, при которой общепринятая тактика лечения включает восполнение дефицита железа[3]. Однако недавно группа ведущих американских экспертов-кардиологов опубликовала ключевые положения о клинической и прогностической значимости дефицита железа у пациентов с ССЗ [22]. Так, согласно опубликованным данным, дефицит железа встречается у 43% пациентов с ОКС и у 60% пациентов с ИБС. Дефицит железа при ИБС ассоциирован с повышенным риском сердечно-сосудистой смертности и развития ИМ, однако эффективность и безопасность внутривенного введения препаратов железа в этой популяции не изучались. В то же время у 50% пациентов с ФП выявляется дефицит железа, при этом убедительные данные о влиянии применения препаратов железа на исходы заболевания также отсутствуют [22].
Таким образом, для уточнения распространенности анемии и ЛДЖ в различных подгруппах пациентов с ФП и для оценки потенциальной связи этих состояний с симптомами и осложнениями ФП, как это имеет место при ХСН, необходимы дальнейшие исследования.
Как уже было отмечено, значимый вклад в развитие анемии у пациентов с ФП вносят кровотечения, риск развития которых увеличивается при применении антикоагулянтной терапии, назначаемой пациентам с ФП с целью профилактики тромбоэмболических событий [17, 18]. Однако стоит подчеркнуть, что в развитии анемии у пациентов с ФП важную роль играет иммуноопосредованный механизм, которой обусловливает возникновение анемии хронических заболеваний, в основе которого лежит влияние цитокинов на гомеостаз железа, продукцию эритропоэтина и пролиферацию предшественников эритроидного ряда [23]. Как при самой ФП, так и при сопутствующих ей заболеваниях, таких как ХСН, ХБП и некоторые другие, повышается содержание маркеров системного воспаления, стимулирующих выработку гепсидина и приводящих к развитию анемии за счет уменьшения доступного для эритропоэза железа [24, 25]. Однако вклад системного воспаления как причины развития анемии в общую распространенность последней у пациентов с ФП практически не изучался и был отражен в единичных исследованиях, оценивающих генез анемии в данной когорте пациентов. Так, в ретроспективном исследовании 864 пациентов с ФП и ОИМ анемия была диагностирована у 449 пациентов, среди которых в анамнезе 180 пациентов была анемия, ассоциированная с ХБП, у 34 пациентов — дефицит железа или макроцитарная анемия, у 30 — заболевания органов пищеварения, у 22 — злокачественные новообразования, а у остальных пациентов причину установить не удалось [26].
Заключение
Данные проведенного исследования продемонстрировали, что анемия, а также ЛДЖ часто встречаются у пациентов с ФП, перенесших ОКС. При этом этиология анемии, согласно полученным результатам и данным литературы, разнообразна: значимый вклад в ее развитие вносят не только кровотечения, риск которых возрастает у пациентов, получающих ДАТ, но и сопутствующие дефицитные состояния, в частности дефицит железа, а также, возможно, хроническое системное воспаление, ассоциированное в том числе с наличием коморбидной патологии в изучаемой когорте. Для оценки потенциальной связи этих состояний с симптомами и осложнениями, ассоциированными с ФП, а также с нежелательными реакциями назначаемой антитромботической терапии необходимы дальнейшие исследования с большим объемом выборки и проспективным наблюдением.
Сведения об авторах:
Телкова Светлана Сергеевна — аспирант, старший лаборант кафедры терапии и полиморбидной патологии имени академика М.С. Вовси ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0003-1439-7371
Кочетков Алексей Иванович — к.м.н., доцент, доцент кафедры терапии и полиморбидной патологии имени академика М.С. Вовси ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0001-5801-3742
Стародубова Антонина Владимировна — д.м.н., профессор, заместитель директора по научной и лечебной работе ФГБУН «ФИЦ питания и биотехнологии»; 109240, Россия, г. Москва, Устьинский пр-д, д. 2/14, стр. 1; профессор кафедры факультетской терапии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-9262-9233
Короткова Татьяна Николаевна — к.м.н., заведующая лабораторией клинической биохимии, аллергологии и иммунологии ФГБУН «ФИЦ питания и биотехнологии»; 109240, Россия, г. Москва, Устьинский пр-д, д. 2/14, стр. 1; ORCID iD 0000-0002-3684-9992
Ворожко Илья Викторович — к.м.н., старший научный сотрудник лаборатории клинической биохимии, аллергологии и иммунологии ФГБУН «ФИЦ питания и биотехнологии»; 109240, Россия, г. Москва, Устьинский пр-д, д. 2/14, стр. 1; ORCID iD 0000-0003-2529-9152
Плотникова Наталья Андреевна — к.м.н., доцент кафедры терапии и полиморбидной патологии имени академика М.С. Вовси ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0001-5454-9339
Гаврилова Наталья Евгеньевна — д.м.н., профессор кафедры терапии и полиморбидной патологии имени академика М.С. Вовси ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; генеральный директор, главный врач ООО «СЦЗ»; 111024, Россия, г. Москва, ул. 2-я Кабельная, д. 2, стр. 25; ORCID iD 0000-0003-4624-9189
Остроумова Ольга Дмитриевна — д.м.н., профессор, заведующая кафедрой терапии и полиморбидной патологии имени академика М.С. Вовси ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; профессор кафедры клинической фармакологии и пропедевтики внутренних болезней ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-0795-8225
Контактная информация: Остроумова Ольга Дмитриевна, e-mail: ostroumova.olga@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 21.01.2025.
Поступила после рецензирования 13.02.2025.
Принята в печать 27.02.2025.
About the authors:
Svetlana S. Telkova — Postgraduate Student, Senior Assistant of the Academician M.S. Vovsi Department of Therapy and Polymorbid Pathology, Russian Medical Academy of Continuous Professional Education; 2/1, build. 1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0003-1439-7371
Alexey I. Kochetkov — C. Sc. (Med.), Assistant Professor of the Academician M.S. Vovsi Department of Therapy and Polymorbid Pathology, Russian Medical Academy of Continuous Professional Education; 2/1, build. 1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0001-5801-3742
Antonina V. Starodubova — Professor, Dr. Sc. (Med.), Deputy Director for Scientific and Therapeutic Work, Federal Research Center for Nutrition and Biotechnology; 2/14, build. 1, Ust’inskyi ln., Moscow, 109240, Russian Federation; Professor, Department of Faculty Therapy, Faculty of General Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0001-9262-9233
Tatiana N. Korotkova — C. Sc. (Med.), Head of the Laboratory of Clinical Biochemistry, Allergology and Immunology, Federal Research Center for Nutrition and Biotechnology; 2/14, build. 1, Ust’inskyi ln., Moscow, 109240, Russian Federation; ORCID iD 0000-0002-3684-9992
Il’ya V. Vorozhko — C. Sc. (Med.), Senior Researcher of the Laboratory of Clinical Biochemistry, Allergology and Immunology, Federal Research Center for Nutrition and Biotechnology; 2/14, build. 1, Ust’inskyi ln., Moscow, 109240, Russian Federation; ORCID iD 0000-0003-2529-9152
Natalia A. Plotnikova — C. Sc. (Med.), Assistant Professor of the Academician M.S. Vovsi Department of Therapy and Polymorbid Pathology, Russian Medical Academy of Continuous Professional Education; 2/1, build. 1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0001-5454-9339
Natalia E. Gavrilova — Dr. Sc. (Med.), Professor of the Academician M.S. Vovsi Department of Therapy and Polymorbid Pathology, Russian Medical Academy of Continuous Professional Education; 2/1, build. 1, Barrikadnaya str., Moscow, 125993, Russian Federation; General Director, Chief Physician of Scandinavian Health Center LLC; 2, build. 25, 2-ya Kabelnaya str., Moscow, 111024, Russian Federation; ORCID iD 0000-0003-4624-9189
Olga D. Ostroumova — Professor, Dr. Sc. (Med.), Head of the Academician M.S. Vovsi Department of Therapy and Polymorbid Pathology, Russian Medical Academy of Continuous Professional Education; 2/1, build. 1, Barrikadnaya str., Moscow, 125993, Russian Federation; Professor of the Department of Clinical Pharmacology and Propedeutics of Internal Diseases, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0002-0795-8225
Contact information: Olga D. Ostroumova, e-mail: ostroumova.olga@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 21.01.2025.
Revised 13.02.2025.
Accepted 27.02.2025
[1] Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/preview-cr/154_4?ysclid=m7vpuzhcia322132670 (дата обращения: 27.12.2024).
[2] Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/preview-cr/157_5 (дата обращения: 27.12.2024).
[3] Хроническая сердечная недостаточность. Клинические рекомендации. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/view-cr/156_2?ysclid=m7vu1a43mp162518355 (дата обращения: 27.12.2024).
Информация с rmj.ru



