В статье представлены результаты оригинального исследования, посвященного изучению влияния препарата на основе масляного экстракта морских водорослей на репродукцию вируса простого герпеса 1, 2 в эксперименте in vitro на чувствительной модели — клеточной культуре.
Содержание статьи
Введение
В настоящее время человечество разработало основанное на двух основных принципах лечение вирусных инфекций: 1) противовирусную терапию и 2) вакцинотерапию. Это применимо и актуально в т. ч. для лечения герпетических инфекций (ГИ). Профилактика ГИ входит в схему лечения заболеваний, обусловленных герпес-вирусами.
Основные группы препаратов, применяющиеся для лечения ГИ [1, 2]:
аналоги аминоадамантана: тромантадина гидрохлорид;
ациклогуанозины — ациклические аналоги нуклеозидов (ацикловир, валацикловир, фамцикловир, ганцикловир, валганцикловир, соривудин, цидофовир1);
аналоги пирофосфата — фосфономуравьиная (фоскарнет)1 и фосфоноуксусная кислоты1;
интерфероны;
иммунопротекторы;
вакцины.
В наших многолетних исследованиях [1, 3, 4] показано, в частности, что в связи с относительно невысокой биопроницаемостью через гематоэнцефалический барьер препаратов ряда ациклогуанозина, а также с учетом того, что герпес-вирусы — это прежде всего нейротропные патогены, применение этих препаратов не всегда оказывается высокоэффективным. Следует учитывать тот факт, что эти препараты давно используются в медицинской практике (с 1978 г.) и в связи с этим могут возникать резистентные формы мутантов. Резистентность практически в 95% случаев обусловлена мутациями в генах тимидинкиназы и ДНК-полимеразы, с которыми связан основной механизм действия этих препаратов [1, 2, 5].
Все герпес-вирусы — лимфопролиферативные, нейропатогенные, системные иммунодепрессанты — пантропны. Как иммуносупрессанты, герпес-вирусы, в течение всей жизни человека оказывают постоянное, с годами все более усиливающееся «прессинговое» воздействие на иммунную систему макроорганизма: 3–5% генетического материала герпес-вирусов представлено опухолеродными генами (онкогенами), которые имеют возможность встраиваться в геном клетки хозяина. Герпес-вирусы способны встраиваться в геном клетки хозяина, а также способны к иммортализации лимфоцитов человека, вызывая бласттрансфоромацию, а многие представители семейства Herpesviridae: вирус Эпштейна — Барр, вирус герпеса человека 6 и 8 типа, вирус герпеса обезьян Саймири — прототипные модели для изучения вирусного канцерогенеза [2, 5].
Вирусы герпеса активно влияют на жизненно важные функции организма, иммунобиологические системы его защиты (интерфероновый и цитокиновый статус, клеточные и гуморальные иммунные реакции), что приводит к изнашиванию компенсаторных механизмов организма с последующим развитием биологического угасания (старения) и модифицирует процесс апоптоза.
В настоящее время одним из новых направлений научного поиска нашей лаборатории является изучение соединений — гомологов фукоиданов.
Ученые всего мира много лет пытаются разработать способ управления процессом самоуничтожения измененных клеток. Первыми добились успехов японские ученые, когда они выделили из морской водоросли ламинарии особое вещество — фукоидан. Фукоидан связывается с рецептором — фактором некроза опухоли, который присутствует только на поверхности измененных клеток, и при этом запускается программа самоуничтожения — апоптоза. Многочисленные исследования, по данным современной литературы, подтверждают, что фукоидан является средством защиты не только от рака, но и от ревматизма, артритов, заболеваний сердца, желудочно-кишечных заболеваний, сахарного диабета и различного рода инфекций, повышают иммунитет. Так, в литературе имеются сообщения о противоопухолевых, иммуномодулирующих, антибактериальных, антивирусных, противовоспалительных и других свойствах фукоидана. По данным японских исследователей, фукоидан вызывает самоуничтожение больных клеток, пораженных раком, вирусом лейкемии [6, 7].
Цель настоящего исследования — изучение нового препарата — масляного экстракта водорослей (МЭВ), состоящего из комплекса сине-зеленых и бурых морских водорослей и растительных компонентов, основными из которых являются ламинария сахаристая (Saccharina latissima), фукус пузырчатый (Fucus vesiculosus), ирландский мох (Chondrus crispus), и его действия в отношении вируса простого герпеса 1 и 2 типа (ВПГ-1 и ВПГ-2) в культуре клеток in vitro.
Материал и методы
Исследование включало определение цитотоксичности препарата на культуре клеток, определение противовирусного действия препарата непосредственно в клетках, определение ингибирования репродукции вируса после воздействия препарата.
В работе использовали монослойные перевиваемые клетки почек зеленой мартышки (Vero), полученные из лаборатории культур тканей ФНИЦЭМ им. Н.Ф. Гамалеи. Клетки культивировали на питательной среде ИГЛА-МЭМ (с 10% содержанием эмбриональной телячьей сыворотки (ЭТС), 2 мМ L-глутамина, 100 мкг/мл гентамицина при t=37,5 °C, 5% СО2 и 98% влажности. Посевная доза составляла 2×105 клеток/мл. Клетки рассеивали в 96-, 48- и 24-луночные пластиковые планшеты до формирования полного монослоя.
Готовили серийные разведения препарата МЭВ (от 10–1 до 10–5) используя смесь диметилсульфоксида (ДМСО) (в конечной концентрации 1,0–0,1%) и 0,05% этилового спирта на питательной среде ИГЛА-МЭМ, растворы стерилизовали путем фильтрации через мембранные фильтры с диаметром пор 0,22 мкм для дальнейшего использования.
Для работы были взяты два вируса — ВПГ-1 штамм «L2» и ВПГ-2 штамм «ВН», полученные из Государственной коллекции вирусов ФГБУ НИЦЭМ им. Н.Ф. Гамалеи. Эксперименты проводили в 24-луночных культуральных планшетах, в тех объемах и условиях культивирования, что и при исследовании цитотоксичности. Множественность инфицирования составляла 0,1 ТЦИД50/клетка. После адсорбции вируса (в течение 1 ч) клетки отмывали и помещали в ростовую среду с содержанием 2% ЭТС.
Инфекционный титр вируса определяли при титровании вируса в 24-луночных планшетах. Титрование вируса проводили по общепринятой методике, используя метод конечных разведений от 10–1 до 10–6. Для титрования готовили возрастающие десятикратные разведения вируса, которые вносили по 0,1 мл в лунку с клетками, используя по 4 лунки на каждое разведение вируса, планшеты инкубировали при 37 °C в течение 2–3 дней до образования цитопатического действия вируса. Титр вируса определяли по формуле в lgТЦИД50/мл по методу Рида и Менча. Инфекционный титр вируса для опыта с препаратом составил для штамма «L2» -5,5 lgТЦИД50/мл и для штамма «ВН» -4,0 lgТЦИД50/мл соответственно.
В системе доклинического исследования лекарственных препаратов первым этапом является оценка токсичности соединений для культуры клеток. Как правило, в процессе исследования цитотоксичности соединений изучают влияние различных концентраций препаратов на морфологию клеток, на которых проводят все дальнейшие исследования. В нашем исследовании также на клеточный монослой вносили различные концентрации препарата МЭВ, инкубировали в тех же условиях. Учет результатов проводили через 24, 48, 72, 96 ч культивирования клеток. Результаты опыта оценивали по снижению темпов роста культуры: 1) подсчитывали концентрацию клеток, применяя метод окрашивания клеток 0,4% раствором трипанового синего (живые клетки не окрашиваются, а мертвые окрашиваются в синий цвет); 2) изучали пролиферативную активность клеток при добавлении препарата путем определения индекса пролиферации (отношение числа выросших клеток к числу засеянных, окрашивание 0,1% раствора кристалл виолета); 3) определяли уменьшение процента жизнеспособных клеток (оценивали по количеству неокрашенных клеток в процентах от общего числа клеток). Количественно цитотоксичность выражали как ТЦД50 (тканевая цитотоксическая доза) — это концентрация препарата, которая вызывает 50% изменение морфологии клеток и нарушение поглощения клетками витального красителя по сравнению с контролем.
Для более полной оценки токсичности препарата МЭВ провели дополнительный митохондриальный тест (МТТ). МТТ — колориметрический тест для оценки метаболической активности клеток. НАДФ-Н-зависимые клеточные оксидоредуктазные ферменты могут при определенных условиях отражать количество жизнеспособных клеток. МТТ широко используется как скрининговый метод измерения выживаемости клеток. В его основе лежит реакция восстановления желтой соли тетразолия (МТТ) митохондриальными дегидрогеназами живых клеток до пурпурных кристаллов формазана, которые нерастворимы в водной среде обитания клеток.
Клетки Vero инкубировали в 96-луночных планшетах в присутствии различных концентраций препарата. После 24 ч культивирования клеток в каждую лунку добавляется по 20 мкл 3-(4,5-диметилтиазолил-2ел)-2,5-дифенилтетразолиум бромида. Через 2 ч экспозиции при температуре 37 °C живые клетки восстанавливают желтый до темно-фиолетовых гранул формазана. Затем из лунок удаляли среду и добавляли 100 мкл ДМСО для растворения образовавшихся кристаллов формазана, количество восстановленного продукта измеряется фотометрически с помощью планшетного анализатора при длине волны 530 нм за вычетом измеренного фонового поглощения при 620 нм. Выживаемость клеток в присутствии препарата рассчитывается по формуле:
ОП опытных лунок = (ОП среды/ОП контр. лунок – ОП среды) ×100%,
где ОП — оптическая плотность.
Жизнеспособность клеток и количество оценивали по исключению трипанового синего. Концентрация препарата, которая вызывает 50% гибель клеток, рассчитывается по дозозависимой кривой.
Для изучения влияния препарата МЭВ в различных концентрациях на ВПГ (штаммы «L2» и «ВН») в культуре клеток инфицировали клетки вируссодержащей суспензией. Эксперименты проводили в 24-луночных культуральных планшетах, в тех объемах и условиях культивирования, что и при исследовании цитотоксичности. Множественность инфицирования составляла 0,1 ТЦИД50/клетка. После адсорбции вируса (через 1 ч) клетки отмывали и помещали в ростовую среду с содержанием 2% ЭТС.
Для определения противовирусного действия препарата МЭВ на накопление ВПГ в культуре клеток были исследованы образцы вируссодержащей жидкости (ВСЖ) из 96-луночных планшетов из предыдущих опытов (в эксперимент были взяты концентрации препарата 0,01% и 0,001% как наиболее перспективные). Для этого планшеты с инфицированными клетками и препаратом после проведения эксперимента (т. е. на 2–3-е сут) однократно замораживали и оттаивали и в дальнейшем отбирали из планшетов ВСЖ для исследования методом иммуноферментного анализа (ИФА).
Твердофазный ИФА проводили по стандартной методике. На 96-луночные планшеты сорбировали моноклональные антитела к ВПГ на 24 ч, затем вносили образцы ВСЖ в серийных разведениях 1:100, 1:300, 1:900, 1:2700, 1:8100, 1:24300 и далее в раститровке с шагом 3, контроли — контроль клеток, контроль вируса, ДМСО, культуральная питательная среда, препарат МЭВ в разведениях. Результаты оценивали по ОП на планшетном фотометре при длине волны 492 нм.
Статистический анализ выполнен с использованием пакета программного обеспечения Statistica StatSoft 10.0. Определялся ряд данных в процентном выражении, среднее арифметическое (М), стандартная ошибка среднего арифметического (m). Достоверность различий между показателями определялась с использованием критерия Стьюдента, различия считали достоверными при р<0,05, высокодостоверными при р<0,001, недостоверными при р>0,05.
Результаты и обсуждение
Определение цитотоксичности МЭВ
На первом этапе исследования необходимо было определить цитотоксичность препарата, т. е. возможность использования препарата без повреждающего действия на клетки и максимально переносимую концентрацию.
Данные представлены в таблице 1. Для адекватной статистической обработки материала на каждую концентрацию препарата отводилось 3–4 лунки, опыты воспроизводились в 3 повторах.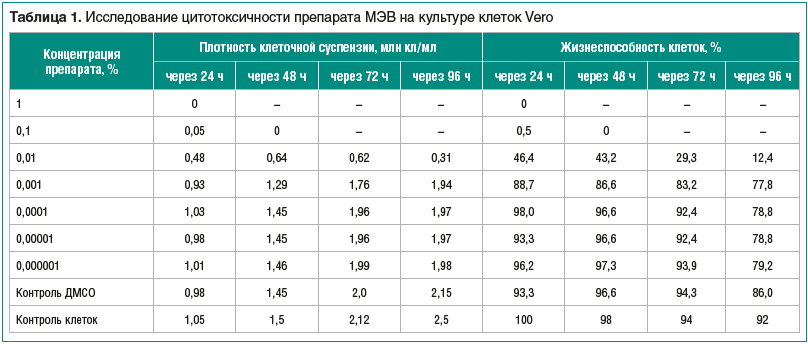
В результате проведенных исследований обнаружено, что препарат МЭВ в концентрации 0,1% оказывает выраженное цитопатическое действие на клетки в первые сутки (нарушение морфологии клетки, снижение жизнеспособности более чем на 90%), а в концентрации 0,001% не оказывает токсического влияния на физиологическое состояние клеток, показатели равнялись контрольным. МЭВ в концентрации 0,01% слаботоксичен, при этом отмечается снижение темпов роста культуры и процента жизнеспособных клеток на 54%. В случае воздействия 1,0 и 0,1% раствором препарата наблюдался выраженный цитотоксический эффект, что отражалось на первые сутки наблюдения статически достоверным снижением как плотности клеточной суспензии, так и жизнеспособности клеток (р
Установлено, что 50% тканевая цитотоксическая доза
ТЦД50/мл составила 0,0055% раствора препарата МЭВ.
В митохондриальном тесте были определены эффективные концентрации препарата, вызывающие 50% ингибирование выживаемости клеток (IC 50). Значения абсорбции представлены в относительных единицах. Для контроля (без препарата, 1% ДМСО) значения линий составляют 0,904±0,05 и 1,03±0,08 (рис. 1).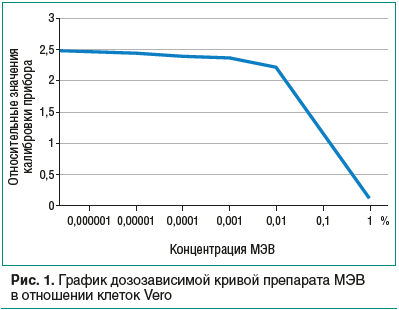
В дальнейших исследованиях использованы только концентрации препарата МЭВ 0,01–0,00001%, т. к. более высокие концентрации (1,0–0,1%) использовать нецелесообразно, поскольку они оказывалют выраженный цитотоксический эффект на клетки.
Исследование противовирусного действия препарата МЭВ на репродукцию вируса простого герпеса in vitro в культуре клеток
В опыт были взяты только концентрации препарата МЭВ 0,01–0,00001%. Разведения препарата вносили в культуру клеток по трем различным схемам: 1) за 1 ч до инфицирования вирусом (профилактическая схема); 2) одномоментно с вирусом; 3) после инфицирования вирусом в течение 1 ч (лечебная схема). После проведения эксперимента (до полного проявления цитопатического действия (ЦПД) вируса на клеточном монослое, которое оценивали под микроскопом по появлению характерного ЦПД каждого штамма вируса) планшеты однократно замораживали, оттаивали и отбирали содержимое лунок для определения степени ингибирования инфекционной активности вируса двумя методами: 1) титрованием вируса на культуре клеток по методу Рида и Менча
и 2) определением титра вируса в ИФА с моноклональными антителами (табл. 2).
В результате исследования противовирусного действия препарата МЭВ (см. табл. 2) было установлено, что при внесении препарата одномоментно с вирусом в концентрации 0,01% раствор оказывал незначительное ингибиторное действие на репродукцию вируса в клетках на вторые сутки, но при этом также отмечался цитотоксический эффект. Инфекционный титр вирусов составил: для ВПГ-1 (штамм «L2») — 4,25 lgТЦИД50/мл, для ВПГ-2 (штамм «ВН») — 3,0 lgТЦИД50/мл. То есть снижение инфекционной активности вирусов отмечалось в среднем на 1,125 lgТЦИД50/мл по сравнению с контролем. А в концентрации 0,001% снижение инфекционности вирусов составило: ВПГ-1 («L2») титр 4,0 lgТЦИД50/мл, а для ВПГ-2 («ВН») — 2,75 lgТЦИД50/мл. Снижение инфекционной активности вирусов отмечалось в среднем на 1,375 lgТЦИД50/мл. При использовании профилактической схемы (внесение препарата в концентрации 0,001% за 1 ч до инфицирования клеток вирусом) отмечено снижение вирусной активности: ВПГ-1 («L2») титр — 3,75 lgТЦИД50/мл, ВПГ-2 («ВН») — 2,5 lgТЦИД50/мл. Вирусная активность ВПГ-1 снизилась на 1,75 lgТЦИД50/мл, ВПГ-2 — на 1,5 lgТЦИД50/мл по сравнению с контролем. При использовании концентрации 0,01% отмечалось незначительное противовирусное действие, в среднем снижение титра было на 1,5 lgТЦИД50/мл. При внесении препарата после 1 ч заражения клеток вирусом (лечебная схема использования препарата) отмечалось незначительное ингибиторное действие препарата, снижение инфекционной активности вируса в среднем отмечалось на 0,5 lgТЦИД50/мл.
Таким образом, концентрация препарата 0,001% принимается как ТЦИД50 (ИД50) — доза, ингибирующая репродукцию вируса на 50%, дающая максимальное снижение на 2 lgТЦИД50/мл для ВПГ-1 («L2») и на 1,75 lgТЦИД50/мл
для ВПГ-2 («ВН») инфекционной активности вируса при профилактической схеме внесения препарата (за 1 ч до воздействия вируса).
Для оценки перспективности препарата как возможного химиотерапевтического средства в исследованиях рассчитывается химиотерапевтический индекс (ХТИ), который наиболее статистически достоверно характеризует специфическую активность препарата по формуле:
![Таблица 1. Характеристика аллергенов, используемых в лабораторной диагностике [3] Таблица 1. Характеристика аллергенов, используемых в лабораторной диагностике [3]](https://medblog.su/wp-content/uploads/2019/05/1558329320_39_ingibitornyj-effekt-preparata-na-osnove-maslyanogo-ekstrakta-vodoroslej-na-reproduktsiyu-virusa-gerpesa-v-kulture-kletok-in-vitro-n-d-lvov-melnichenko-a-v-l-m-alimbarova-a-a-nikitina.png)
где ТЦД50 (тканевая цитотоксическая доза, вызывающая морфологические изменения ткани и снижающая жизнеспособность клеточной культуры на 50%)
составила 0,0055, ТЦИД50 (ИД 50) (тканевая цитотоксическая доза, ингибирующая репродукцию вируса на 50%) составила 0,001.
Если препарат имеет ХТИ<1, то это практически неактивное вещество в отношении вируса. Если ХТИ>8, то препарат обладает сильным противовирусным действием. По данным литературы, также рассматривается снижение титра вируса при действии препарата не менее чем на 1,25–2,0 lgТЦИД50/мл вирусной активности в условиях одноциклового исследования.
По результатам проведенных исследований ХТИ для препарата МЭВ составил 5,5, что свидетельствует о противовирусной активности препарата.
Исследование инфекционной активности ВПГ в иммуноферментном анализе
На дальнейшем этапе определения противовирусного действия МЭВ проводили ИФА для оценки активности ВПГ в культуре клеток. Результаты представлены в таблице 3.
В результате исследования было выявлено, что при концентрации препарата 0,001%, внесенного за 1 ч до инфицирования вирусом (в условиях эксперимента), отмечается наиболее значительное снижение инфекционной активности вируса (титр вируса составил 1:300 по сравнению с контролем — 1:656 100).
Заключение
Таким образом, препарат МЭВ оказывает максимальное противовирусное действие против ВПГ в концентрации 0,001% при внесении за 1 ч до появления вируса (профилактическая схема) и менее выраженное противовирусное действие по лечебной схеме (после инфицирования вирусом). ХТИ для препарата МЭВ составил 5,5, что свидетельствует о противовирусной активности препарата. МЭВ является новым перспективным препаратом с механизмом действия, отличным от механизма известных лекарств (препараты ряда ациклогуанозина), в лечение ВПГ-инфекции.
Данные исследования представляют собой начальную фазу наших экспериментов в этом направлении, и уже первые шаги показали перспективность МЭВ как антигерпетического препарата.
1 препарат не зарегистрирован в РФ
.
Информация с rmj.ru


