Введение
Инфекции, вызванные вирусом простого герпеса (ВПГ), являются одними из наиболее распространенных в мире, поражая, по разным оценкам, до 90% населения [1–4]. Согласно глобальной оценке Всемирной организации здравоохранения, количество инфицированных ВПГ (как 1-го, так и 2-го типа) составляет около 4 млрд человек[1]. Существенное бремя рецидивирующих поражений: орофациальный герпес (ВПГ 1-го типа, ВПГ-1) и генитальный герпес (чаще ВПГ-2, но растет доля ВПГ-1 у молодежи) приводят к частым рецидивам, снижению качества жизни из-за болей и стигматизации.
Персистенция ВПГ в паравертебральных ганглиях нервной системы обеспечивает пожизненную защиту вируса от иммунной системы и формирует фон иммуносупрессии. Иммунодефицит развивается за счет вирусных белков, блокирующих рецепторы иммунокомпетентных клеток, что приводит к нарушению специфического иммунного ответа [3, 5–8]. На этом фоне пациенты становятся восприимчивыми к другим оппортунистическим инфекциям. Особое значение имеет вклад ВПГ в ВИЧ-эпидемию: генитальный герпес повышает риск приобретения и передачи ВИЧ ввиду наличия язвенных поражений и локального воспаления. ВПГ-2 повышает риск приобретения и передачи ВИЧ, усиливая эпидемическое взаимодействие возбудителей инфекций, передаваемых половым путем; растет вклад ВПГ-1 в генитальные инфекции у молодежи в странах с высоким доходом [9, 10].
Стандартная противовирусная терапия (ацикловир и аналоги) не всегда предотвращает рецидивы и недостаточно влияет на иммунный дисбаланс, сопутствующий персистенции ВПГ [11, 12]. Это обосновывает поиск комплексных схем с препаратами, воздействующими на клинические проявления и элементы иммунного ответа, а также оптимизацию лечебных алгоритмов в профилактике рецидивов герпетической инфекции. В этой связи препарат суммы полисахаридов побегов Solanum tuberosum (Панавир®), проявляя противовирусные, противовоспалительные и иммуномодулирующие свойства, показывает свою эффективность в клинических наблюдениях. Его добавление к ацикловиру ускоряло регресс симптомов, уменьшало воспаление, снижало частоту рецидивов и увеличивало продолжительность ремиссий при рецидивирующем генитальном герпесе [12]. Экспериментально показана его противовоспалительная и антипиретическая активность, сопоставимая с таковой диклофенака, при отсутствии характерной для нестероидных противовоспалительных препаратов ульцерогенности [13].
При смежных вирус-ассоциированных патологиях урогенитального тракта (ВПЧ-инфекция, цервикальная дисплазия) комплексное применение разных форм препарата суммы полисахаридов побегов Solanum tuberosum ассоциировано со снижением уровня локальных провоспалительных цитокинов, позитивной динамикой интерферонового статуса и клиническими исходами, что дополнительно обосновывает его использование как компонента комбинированной терапии в очагах вирусного воспаления слизистых [14, 15].
С учетом высокой распространенности ВПГ, ограниченности эффектов стандартной монотерапии и данных о клинико-иммунологических эффектах препарата суммы полисахаридов побегов Solanum tuberosum, ретроспективная оценка его эффективности в реальной клинической практике при герпетической инфекции представляется актуальной для оптимизации лечебных алгоритмов и профилактики рецидивов.
Цель исследования: изучить клинико-этиологические особенности ВПГ-инфекции и провести анализ эффективности включения иммуномодулирующей терапии в комплексное лечение герпетической инфекции.
Содержание статьи
Материал и методы
На базе клиник ФГБОУ ВО СамГМУ Минздрава России проведен ретроспективный когортный анализ случаев приобретенной герпетической инфекции, вызванной ВПГ-1/2, в период реактивации вируса за период с 2022 по 2024 г.
Критерии включения в общую когорту (n=109): пациенты 18 лет и старше с верифицированным диагнозом «приобретенная герпетическая инфекция, вызванная ВПГ-1/2, в период реактивации»; наличие полной медицинской документации (медицинская карта пациента, получающего медицинскую помощь в условиях дневного или круглосуточного стационара), позволяющей провести описательный анализ (форма и локализация процесса, сезонность, этиология, провоцирующие факторы, наличие осложнений).
Для сравнительного анализа эффективности терапии из общей когорты (n=109) были выбраны 35 пациентов. Критерии формирования сравнительных групп: возраст, пол, клиническая форма герпеса и тяжесть состояния.
В группу 1 (основная, n=17) вошли пациенты, которые в период лечения на фоне стандартной терапии по рекомендации лечащего врача дополнительно получали препарат с иммуномодулирующей активностью (Панавир®) в условиях дневного стационара. Показаниями к рекомендации являлись: частые рецидивы (≥3 эпизодов в год), наличие микст-герпетической инфекции (ВПГ + вирус Эпштейна — Барр (ВЭБ) / цитомегаловирус (ЦМВ)), признаки иммунной дисфункции (лимфопения, снижение интерферонового статуса), развитие осложненных или диссеминированных форм инфекции. Пациенты получали препарат внутривенно капельно по 5,0 мл через день (всего 2 инъекции) в соответствии с инструкцией к препарату. Стандартная противовирусная терапия (ацикловир/валацикловир) также проводилась всем пациентам.
В группу 2 (контрольная, n=18), которую сформировали из оставшихся 92 пациентов общей когорты методом псевдорандомизации (метод подобранных пар), вошли пациенты, получавшие только стандартную противовирусную терапию (ацикловир/валацикловир) без включения иммуномодуляторов.
Критерии исключения из сравнительного анализа: ВИЧ-инфекция с уровнем CD4+ лимфоцитов <100 кл/мкл, острая фаза тяжелого герпетического энцефалита, требующая реанимационных мероприятий.
Источником данных послужили медицинские карты больных. Оценивали следующие параметры: продолжительность госпитализации, частоту и структуру осложнений, динамику клинических симптомов, а также динамику лабораторных показателей (аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), С-реактивный белок (СРБ), лактатдегидрогеназа (ЛДГ)).
Статистическую обработку данных проводили с использованием пакета статистических программ SPSS 23.0. Для оценки различий количественных показателей между группами применяли t-критерий Стьюдента для независимых выборок. Для анализа категориальных переменных использовали критерий χ2 с поправкой Йейтса. Различия считали статистически значимыми при p<0,05.
Результаты исследования
Всего в ретроспективный анализ было включено 109 случаев с реактивацией ВПГ-инфекции. Среди пациентов преобладали лица молодого и среднего возраста 18–44 лет (70/63,8%). Распределение пациентов по форме и локализации процесса представлено в таблице 1.
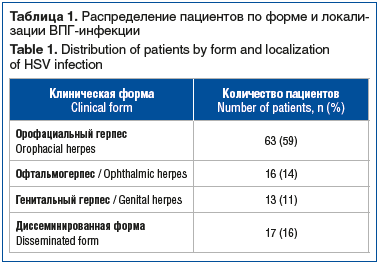
Анализ сезонной заболеваемости показал наибольшую частоту случаев в зимний период (31/28,3%), минимальную — летом (22/20,4%). На холодный период (ноябрь — март) пришелся 61 (55,8%) случай (χ2=2,45, p=0,12). Несмотря на отсутствие строгой сезонности, стоит учитывать зимне-весенний подъем (возможная роль стресса, ОРВИ). Среди пациентов во все сезоны преобладали лица в возрасте 18–44 лет. В то же время в общей когорте распределение по полу было равномерным.
У 51 (46,8%) пациента из общей когорты с подтвержденным ВПГ-1/2 выявлена сочетанная герпетическая инфекция, чаще всего с ВЭБ (30/58,1%) (табл. 2).
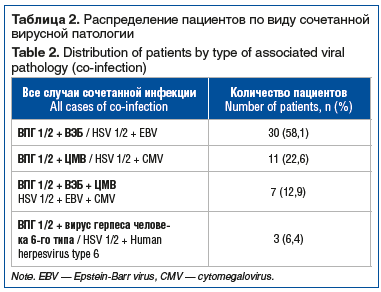
У 100 (91,7%) пациентов частота рецидивов составляла от 2 до 4 эпизодов в год. По нашим данным, ведущим фактором, провоцирующим реактивацию вирусной инфекции, являлся психоэмоциональный стресс (табл. 3).
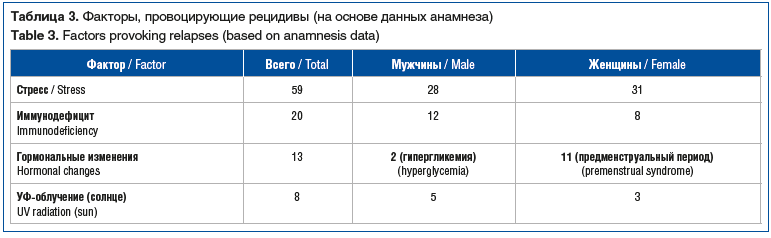
Всего в общей когорте было 26 (23,9%) пациентов с осложнениями, наиболее часто осложнения отмечались у пациентов в возрасте старше 60 лет (табл. 4).

Осложнения чаще отмечались у мужчин (p=0,04) и пациентов старше 45 лет (p=0,001), а также коррелировали с наличием иммунодефицита (p<0,001) и хронических заболеваний (p=0,03). У 15 (58%) пациентов с осложнениями выявлен иммунодефицит различной этиологии (ВИЧ-инфекция, онкологическое заболевание, прием иммуносупрессантов).
Так как все пациенты в общей когорте — это пациенты с рецидивами, а Панавир® обладает иммуномодулирующим действием, повышение выработки интерферона и активности NK-клеток важно для контроля рецидивов. Кроме того, 46,8% пациентов имеют микст-инфекцию (ВПГ + ВЭБ/ЦМВ), а Панавир® показал in vitro активность не только против ВПГ, но и против ВЭБ и ЦМВ, что делает его назначение актуальным при сочетанных инфекциях. Наличие противовоспалительного действия у данного препарата обусловливает целесообразность его использования у пациентов с офтальмогерпесом и при диссеминированных формах.
Для оценки эффективности дополнения стандартной терапии иммунотропным препаратом нами был проведен сравнительный анализ в двух сформированных из основной когорты группах пациентов.
Статистически значимых различий между группами по полу не было (χ2=0,42, p=0,52): в группе 1 мужчин было 12 (71%), в группе 2 — 11 (61%). Группы были сопоставимы по возрасту, что минимизирует влияние возрастного фактора. Средний возраст в группе 1 составил 39,7 года, в группе 2 — 38,6 года.
В группе 1 чаще диагностировалась микст-инфекция ВПГ+ВЭБ — 15 (88%) случаев по сравнению с 10 (56%) в группе 2 (χ2=4,82, p=0,028).
В группе 1 среднетяжелое течение отмечалось у 11 (65%) пациентов, легкое — у 3 (18%), тяжелое — у 3 (18%). В группе 2 течение средней тяжести также являлось преобладающим — отмечено у 10 (56%) пациентов, легкое и тяжелое течение регистрировали одинаково часто — по 4 (22%) случая.
В группе 1 преобладала клиническая картина, при которой орофациальный герпес протекал с мононуклеозоподобным синдромом (11/65%), в то время как в группе 2 такое сочетание отмечалось реже (8/44%).
До начала терапии лейкоцитоз был зафиксирован у 7 (41%) пациентов в группе 1 и у 13 (72%) — в группе 2 (χ2=3,56, p=0,059). Повышение СОЭ >30 мм/ч отмечалось в 12 (71%) случаях в группе 1 и в 11 (61%) — в группе 2; повышение уровня АЛТ/АСТ наблюдалось с одинаковой частотой — в 53 и 50% соответственно, значительное повышение уровня СРБ (>50 мг/л) отмечалось в 10 (59%) и 7 (39%) случаях соответственно (χ2=1,56, p=0,21).
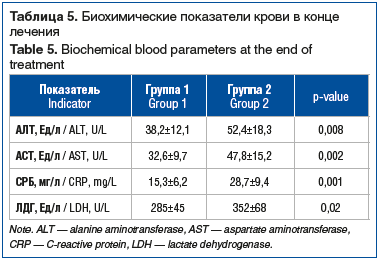
На фоне лечения в группе 1 отмечалась положительная динамика биохимических маркеров, свидетельствующая о противовоспалительном и цитопротективном эффектах (снижение уровня АЛТ и АСТ на 25–30%, СРБ на 47% и ЛДГ на 19%) (табл. 5).
Средняя продолжительность госпитализации в группе 1 составила 10,4 дня, что на 2,3 дня меньше, чем в группе 2 (12,7 дня) (p<0,05).
Обсуждение
Проведенный ретроспективный анализ 109 случаев реактивации ВПГ-инфекции позволил выявить ряд клинико-этиологических особенностей: инфекция наиболее часто реактивируется у лиц молодого и среднего возраста (18–44 года, 63,8%). Это указывает на значительное влияние герпетической инфекции на качество жизни и трудоспособность экономически активного населения. Значительная доля офтальмогерпеса (14%) и диссеминированной формы (16%) в нашем исследовании подтверждает потенциальный риск серьезных осложнений инфекции. 91,7% страдают от рецидивов ВПГ-инфекции, что требует разработки эффективных мер, увеличивающих продолжительность безрецидивного течения. Высокая частота (46,8%) сочетанной герпетической инфекции, в первую очередь с ВЭБ (58,1% от числа коинфицированных), возможно, свидетельствует о взаимном влиянии герпесвирусов на реактивацию.
Панавир® — растительный полисахаридный препарат с противовирусной и иммуномодулирующей активностью. В отличие от ациклических нуклеозидов, действующих только на активную репликацию вируса, он может снижать частоту рецидивов за счет усиления иммунного ответа и активации естественных киллеров [16, 17].
Согласно современным исследованиям иммуномодулирующая терапия особенно эффективна при хронических рецидивирующих формах герпетической инфекции [16, 18, 19]. Полученные нами данные согласуются с результатами других авторов относительно целесообразности применения иммуномодуляторов при микст-инфекциях [19].
Проведенное ретроспективное исследование демонстрирует, что включение иммуномодулирующей терапии в комплексное лечение герпетической инфекции ассоциировано со статистически значимым сокращением длительности госпитализации на 2,3 дня. Этот результат имеет не только клиническое, но и важное организационно-экономическое значение, так как сокращение количества койко-дней снижает нагрузку на стационар и косвенные расходы на лечение. Полученные данные согласуются с результатами других авторов, отмечавших способность иммуномодуляторов ускорять регресс клинической симптоматики [16, 20].
Важным аспектом нашего исследования является выявление положительного влияния иммуномодулирующей терапии на лабораторные маркеры. Зафиксированное снижение уровня СРБ на 47% и уменьшение активности печеночных трансаминаз (АЛТ, АСТ) на 25–30% и ЛДГ на 19% может отражать уменьшение системного воспаления и гепатоцитолиза, что может быть особенно ценно при диссеминированных формах герпеса с вовлечением печени или у пациентов с лекарственной нагрузкой, что подтверждается данными экспериментальных работ [13].
С учетом того, что большинство пациентов в нашем исследовании страдали рецидивирующими формами инфекции, а 46,8% имели микст-герпесвирусную патологию (преимущественно с ВЭБ и ЦМВ), иммуномодулирующая активность представляется ключевым компонентом эффективности. Как показано в литературе, препараты этой группы способны индуцировать выработку эндогенных интерферонов и повышать активность NK-клеток [16, 17], что является патогенетически обоснованным при хронической персистенции вирусов. In vitro активность используемого препарата не только против ВПГ, но и против ВЭБ и ЦМВ делает его перспективным для терапии сочетанных герпесвирусных инфекций, где стандартные нуклеозиды могут быть недостаточно эффективны. Иммуномодуляция (повышение интерферонового ответа, активация NK-клеток) потенциально влияет на частоту рецидивов, что соответствует современным подходам к лечению хронических форм герпетической инфекции[2].
Несмотря на то, что в группе 1, получавшей иммуномодулирующую терапию, достоверно чаще встречалась микст-инфекция (ВПГ+ВЭБ) и имелась тенденция к более высокому уровню системного воспаления (по уровню СРБ) при поступлении, именно в этой группе достигнуто статистически значимое сокращение длительности госпитализации на 2,3 дня (p<0,05). Это позволяет предположить, что выявленные в нашем исследовании группы риска по развитию осложнений (пациенты старше 45 лет, мужчины, лица с иммунодефицитом) являются целевой аудиторией для назначения комплексной терапии с иммунотропным компонентом. Ограниченность эффектов монотерапии ациклическими нуклеозидами у таких пациентов, включая риск развития резистентности, хорошо известна [21]. Таким образом, добавление иммуномодулятора к стандартной схеме может преодолевать эти ограничения за счет синергии прямого противовирусного действия и иммунокоррекции.
Вместе с тем исследование имеет ограничения: ретроспективный дизайн, малый объем подгрупп в сравнительном анализе. Оценка влияния на частоту последующих рецидивов не проводилась в рамках долгосрочного наблюдения. Для подтверждения полученных результатов и установления более точных показаний необходимы дальнейшие проспективные рандомизированные контролируемые исследования с большим объемом выборки и стратификацией пациентов по типу вируса (ВПГ-1/2), иммунному статусу и наличию микст-инфекции.
Выводы
Результаты исследования демонстрируют, что клиническое течение ВПГ-инфекции характеризуется рецидивами — у 91,7% пациентов отмечается не менее 2 эпизодов в год, при этом ведущим провоцирующим фактором является психоэмоциональный стресс. Преобладание лиц трудоспособного возраста (63,8%) свидетельствует о значительном медико-социальном влиянии заболевания.
Особенности этиологии включают высокую частоту коинфекций — у 46,8% пациентов выявлена сочетанная герпетическая инфекция, преимущественно с ВЭБ (58,1%).
Включение иммуномодулирующей терапии (препарата суммы полисахаридов побегов Solanum tuberosum) в комплексное лечение герпетической инфекции способствует достоверному сокращению сроков госпитализации — в среднем на 2,3 дня и сопровождается положительной динамикой лабораторных показателей (снижение уровня СРБ, АЛТ/АСТ, ЛДГ), отражающей его противовоспалительный и цитопротективный эффекты.
Применение иммуномодуляторов патогенетически обосновано и может быть рекомендовано для пациентов с частыми рецидивами герпетической инфекции, микст-герпесвирусными инфекциями (ВПГ + ВЭБ/ЦМВ).
Наибольшую клиническую пользу комплексная терапия с включением иммунотропного компонента растительного происхождения может принести пациентам с иммунодефицитными состояниями, а также при развитии осложненных форм заболевания.
Сведения об авторах:
Коннов Павел Евгеньевич — к.м.н., доцент, доцент центра подготовки по дерматовенерологии и косметологии Медицинский университет «Реавиз»; 443001, Россия, г. Самара, ул. Чапаевская, д. 227; доцент кафедры дерматовенерологии и косметологии ФГБОУ ВО СамГМУ Минздрава России; 443099, Россия, г. Самара, ул. Чапаевская, д. 89; ORCID iD 0000-0002-6505-7943
Коннова Татьяна Витальевна — к.м.н., доцент, доцент кафедры инфекционных болезней с курсом эпидемиологии, ФГБОУ ВО СамГМУ Минздрава России; 443099, Россия, г. Самара, ул. Чапаевская, д. 89; ORCID iD 0000-0003-2425-6732
Коннова Екатерина Павловна — студентка Института клинической медицины ФГБОУ ВО СамГМУ Минздрава России; 443099, Россия, г. Самара, ул. Чапаевская, д. 89.
Семенова Мария Алексеевна — студентка ФГБОУ ВО «РОСБИТЕХ»; 125080, Россия, г. Москва, Волоколамское ш., д. 11; ORCID iD 0009-0006-2449-8589
Веденкин Александр Сергеевич — научный сотрудник ФИЦ ХФ РАН; 119991, Россия, г. Москва, ул. Косыгина, д. 4; ORCID iD 0000-0001-9295-583X
Контактная информация: Коннов Павел Евгеньевич, e-mail: konnoff@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 08.09.2025.
Поступила после рецензирования 01.10.2025.
Принята в печать 24.10.2025.
About the authors:
Pavel E. Konnov — C. Sc. (Med.), Associate Professor of the Center for Training in Dermatovenerology and Cosmetology, Medical University «Reaviz»; 227, Chapaevskaya str., Samara, 443001, Russian Federation; Associate Professor of the Department of Dermatovenerology and Cosmetology, Samara State Medical University; 89, Chapaevskaya str., Samara, 443099, Russian Federation; ORCID iD 0000-0002-6505-7943
Tatiana V. Konnova — C. Sc. (Med.), Associate Professor of the Department of Infectious Diseases with a course
in Epidemiology, Samara State Medical University; 89, Chapaevskaya str., Samara, 443099, Russian Federation; ORCID iD 0000-0003-2425-6732
Ekaterina P. Konnova — student of the Institute of Clinical Medicine, Samara State Medical University; 89, Chapaevskaya str., Samara, 443099, Russian Federation.
Maria A. Semenova — student of the Russian Biology University (ROSBIOTECH); 11, Volokolamskoe road, Moscow, 125080, Russian Federation; ORCID iD 0009-0006-2449-8589
Alexander S. Vedenkin — Researcher at the Federal Research Center of Chemical Physics of the Russian Academy of Science; 4, Kosygina str., Moscow, 119991, Russian Federation; ORCID iD 0000-0001-9295-583X
Contact information: Pavel E. Konnov, e-mail: konnoff@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 08.09.2025.
Revised 01.10.2025.
Accepted 24.10.2025.
[1] Вирус простого герпеса. (Электронный ресурс.) URL: https://www.who.int/ru/news-room/fact-sheets/detail/herpes-simplex-virus (дата обращения: 15.08.2025).
[2] Клинические рекомендации. Простой герпес (ПГ) у взрослых. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/view-cr/492_2?ysclid=mibj09q4sp283277188 (дата обращения: 15.08.2025).
Информация с rmj.ru


