Введение
Дефицит лизосомной кислой липазы (ДЛКЛ) — редкое прогрессирующее аутосомно-рецессивное заболевание, вызванное мутациями в гене LIPA, кодирующем фермент лизосомальная кислая липаза (ЛКЛ). Недостаток или отсутствие активности ЛКЛ приводит к нарушению внутрилизосомного гидролиза сложных эфиров холестерина и триглицеридов и их накоплению в органах-мишенях [1, 2].
Заболевание представлено двумя основными фенотипами: тяжелой быстропрогрессирующей формой с ранним началом — инфантильной формой ДЛКЛ, исторически называемой болезнью Вольмана, и формой ДЛКЛ у детей и взрослых, ранее известной как болезнь накопления эфиров холестерина (БНЭХ).
Инфантильная форма ДЛКЛ (болезнь Вольмана) проявляется в раннем младенчестве задержкой роста и тяжелым поражением печени, о чем свидетельствуют быстропрогрессирующее увеличение печени, повышение уровня трансаминаз, гипербилирубинемия, гипоальбуминемия и коагулопатия, а также синдром активации макрофагов, которые являются ключевыми факторами неблагоприятных исходов. Важными патогномоничными признаками заболевания являются мальабсорбция, кальцификация надпочечников (у 50% больных), которые выявляются визуализирующими методами исследования (УЗИ органов брюшной полости, рентгенография, компьютерная томография (КТ)). До появления ферментной заместительной терапии (ФЗТ) болезнь Вольмана приводила к летальному исходу в течение первых 6 мес. жизни [3–5].
Форма ДЛКЛ у детей и взрослых, или БНЭХ, — это вторая форма ДЛКЛ. Накопление липидов в лизосомах приводит к поражению печени и селезенки (гепатоспленомегалия с развитием фиброза и/или цирроза печени, повышение активности трансаминаз в сыворотке крови), дислипидемии (повышение уровня холестерина за счет ЛПНП и снижение уровня холестерина ЛПВП, также может наблюдаться повышение уровня триглицеридов), приводящее к раннему атеросклерозу. Вторичные осложнения разнообразны и могут включать портальную гипертензию, асцит, кахексию, варикозное расширение вен пищевода, желудочно-кишечное кровотечение, ИБС, аневризму, инсульт, анемию и тромбоцитопению. Примерно у трети детей наблюдаются тяжелые желудочно-кишечные симптомы, включая частую диарею, рвоту, боли в животе, мальабсорбцию и стеаторею [6].
Для постановки диагноза используют анализ активности фермента ЛКЛ в сухих каплях крови и молекулярно-генетическое исследование.
До появления ФЗТ рекомбинантным человеческим ферментом себелипаза альфа в августе 2015 г. не существовало безопасной и эффективной терапии ДЛКЛ. Себелипаза альфа представляет собой рекомбинантную ЛКЛ, которая вводится путем внутривенной инфузии 1 раз в неделю пациентам с инфантильной формой заболевания или 1 раз в 2 нед. при БНЭХ, уменьшает накопление эфиров холестерина и триглицеридов в лизосомах, тем самым снижая выраженность клинических проявлений заболевания [7–10].
По данным литературы, применение в течение 1 года себелипазы альфа у взрослых пациентов приводит к уменьшению размеров печени и селезенки, значительному улучшению клинико-лабораторных показателей (снижение уровня трансаминаз, холестерина). У младенцев с ДЛКЛ лечение себелипазой альфа привело к значительному увеличению выживаемости, прибавке в весе, уменьшению желудочно-кишечных симптомов, улучшению биохимических показателей и уменьшению гепатоспленомегалии [1, 11–13].
В настоящей статье представлены клинические наблюдения двух пациентов с подтвержденным в возрасте 7 и 12 лет диагнозом БНЭХ с целью продемонстрировать высокую эффективность патогенетической терапии ДЛКЛ, которая проявляется, главным образом, регрессом фиброза (от F3 до F0), значимым снижением уровней трансаминаз, общего холестерина и фракций, а также уменьшением выраженности органомегалии. Наряду с этим отмечены некоторые сложности, с которыми может столкнуться практикующий врач при мониторинге пациентов с ДЛКЛ на патогенетической терапии.
Клиническое наблюдение 1
Мальчик, 2011 г. р., рос и развивался соответственно возрасту. Наследственность отягощена по материнской линии (язвенная болезнь желудка у бабушки и сахарный диабет 2 типа у дедушки) и по отцовской линии (ИБС у дедушки). Впервые в возрасте 6 лет во время диспансерного осмотра при оформлении в школу обратили внимание на периорбитальные «тени интоксикации», увеличение размеров печени до +2,5–3 см и селезенки до +1–1,5 см.
При обследовании в биохимическом анализе крови выявлены синдром цитолиза (АЛТ 106 Ед/л, АСТ 51 Ед/л), повышение уровня холестерина до 6 ммоль/л (при норме 3,2–5,2 ммоль/л), дислипидемия: ЛПВП 0,65 мммоль/л (норма 0,9–2,1 ммоль/л), ЛПНП 4,35 ммоль/л (норма 1,55–3,8 ммоль/л); маркеры вирусных гепатитов А, В и С отрицательные. УЗ-признаки гепатомегалии (вертикальный размер правой доли (ПД) 99 мм, левой доли (ЛД) 34 мм), спленомегалии (99×34 мм), застойных явлений в желчном пузыре. На основании результатов проведенного обследования установлен диагноз: «Дисфункция сфинктера Одди по билиарному типу, дисфункция желчного пузыря по гипомоторному типу. Анемия легкой степени тяжести». Получал урсодезоксихолиевую кислоту (УДХК) без существенной динамики.
В 7 лет (03.2018) с жалобами на повышенную утомляемость, слабость, периодические головные боли, с сохраняющимся синдромом цитолиза был госпитализирован в стационар по месту жительства. В динамике отмечалось нарастание размеров печени: выступала на 5 см из-под реберной дуги по правой среднеключичной линии (размеры печени по Курлову: 12,5×8×6,5 см). Селезенка пальпировалась по краю левой реберной дуги. Выявлены анемия легкой степени (Нb 107 г/л), повышение содержания транс-аминаз до 3 норм; сохранялась гиперхолестеринемия (6,7 ммоль/л) за счет ЛПНП (5,48 ммоль/л). При УЗИ брюшной полости определялись гепатоспленомегалия, уплотнение перипортальных трактов, деформация желчного пузыря. При фиброэластографии: стадия фиброза F1–F2 (по Metavir). Проведена пункционная биопсия печени. Результаты морфологического исследования: представлены фрагменты 7–8 портальных трактов. Все портальные тракты имеют рассеянную лимфогистиоцитарную инфильтрацию. В дольках балочное строение часто утрачено, формируются псевдорозетки, встречаются двухъядерные гепатоциты. Повсеместно внутридольковые воспалительные инфильтраты из купферовских клеток и лимфоцитов. Диффузная белковая дистрофия гепатоцитов и очаги крупнокапельного стеатоза. Встречаются дольки с перисинусоидальным, перицеллюлярным и периваскулярным фиброзом. Во всех дольках многочисленные фиброзные септы слепо оканчиваются в паренхиме или достигают центральной вены. Фиброзные септы инфильтрированы лимфоцитами. Заключение: морфологические признаки соответствуют хроническому гепатиту, активность умеренная, стадия фиброза по шкале Metavir F2–F3.
Дифференциальная диагностика проводилась между заболеваниями печени невирусной этиологии. Были исключены аутоиммунный гепатит, дефицит α1-антитрипсина, болезнь Вильсона — Коновалова. Исследование активности ЛКЛ в сухом пятне крови выявило резкое ее снижение — 0,01 нМ/ч/пятно (норма 0,16–1,8 нМ/ч/пятно). Методом прямого автоматического секвенирования проведен анализ гена LIPA. В экзоне 7 обнаружена однонуклеотидная замена с.796G>T (р.Gly266Term) в гетерозиготном состоянии. В экзоне 8 обнаружена однонуклео-тидная замена с.894G>A в гетерозиготном состоянии. Таким образом, диагноз «Дефицит лизосомной кислой липазы: болезнь накопления эфиров холестерина» был подтвержден молекулярно-генетическим методом. Обследованы родители и два старших брата пациента, уровень ЛКЛ у всех был в норме.
В июне 2018 г. мальчик впервые был обследован в ФГБУН «ФИЦ питания и биотехнологии» с установленным диагнозом «Дефицит лизосомной кислой липазы: болезнь накопления эфиров холестерина». Жалобы при поступлении на утомляемость, слабость, периодические головные боли. При осмотре: масса тела 27 кг, рост 120 см, индекс массы тела (ИМТ) 18,8 кг/м2; Z-score ИМТ +1,6. Живот симметричный, доступен глубокой пальпации во всех отделах, мягкий, безболезненный. Печень выступала из-под края реберной дуги по среднеключичной линии на 4 см, по срединной линии на 7 см, мягко-эластической консистенции, край закруглен, безболезненный. Селезенка увеличена: выступала на 1,5 см из-под края левой реберной дуги. В биохимическом анализе крови сохранялся цитолиз минимальной степени активности (АЛТ/АСТ 102/89,3 Ед/л), холестерин общий 5,21 ммоль/л, ЛПВП 0,7 ммоль/л, ЛПНП 4,27 ммоль/л. Ультразвуковые признаки гепатомегалии (ПД 121 мм, ЛД 92 мм) с выраженными признаками стеатоза (диффузная неоднородность паренхимы, ослабление УЗ-сигнала на ¼), спленомегалии (107×48 мм), деформации и увеличения размеров желчного пузыря (78×18 мм). По результатам эластографии печени: медиана измерений эластичности печени составила 8,3 кПа, IQR 1,3 кПа, что соответствует гистологической стадии фиброза ~F3 (по Metavir).
Принимая во внимание прогрессирующий характер течения заболевания, консилиум врачей ФГБУН «ФИЦ питания и биотехнологии» принял решение назначить пациенту по жизненным показаниям ФЗТ себелипазой альфа (Sebelipasa alfa) по месту жительства в дозе 1 мг/кг 1 раз в 2 нед. пожизненно.
Терапия себелипазой альфа была начата в июне 2019 г. (с 8 лет). Мальчик получал ФЗТ нерегулярно, с перерывами до 2 мес. ввиду проблем с финансовым обеспечением. На фоне проводимой патогенетической терапии отмечается положительная динамика в виде улучшения общего самочувствия, уменьшения печени и селезенки до размеров, соответствующих возрастной норме, что подтверждено данными УЗИ. Однако сохраняются признаки стеатоза печени: мелкоочаговая диффузная неоднородность, ослабление УЗ-сигнала на ⅓. По результатам эластографии печени также отмечается положительная динамика: плотность печени не изменена: медиана эластичности составила 4,8 kПa, IQR 0,8 кПа, что соответствует гистологической стадии фиброза ~F0 (по Metavir).
В биохимическом анализе крови уже через 3–6 мес. наблюдалась нормализация активности трансаминаз (АЛТ/АСТ 34/33,7 Ед/л) и холестерина, однако отмечаются эпизоды повышения уровня холестерина. Максимальные цифры были зафиксированы через 2 года от начала ФЗТ (холестерин 6,37 ммоль/л, ЛПНП 5,04 ммоль/л, ЛПВП 1,04 ммоль/л). В настоящее время у ребенка признаки цитолиза не определяются, показатели липидного обмена в пределах нормы (АЛТ 41 Ед/л, АСТ 47 Ед/л, холестерин общий 4,2 ммоль/л, ЛПНП 3,0 ммоль/л, ЛПВП 0,9 ммоль/л, триглицериды 0,62 ммоль/л) (рис. 1).
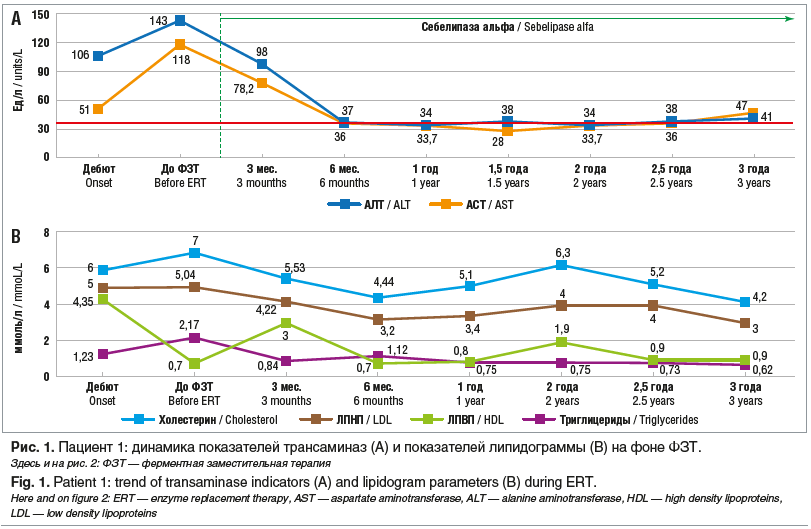
Таким образом, на фоне проводимой патогенетической терапии у ребенка с ДЛКЛ наблюдалась положительная динамика в виде улучшения соматического статуса, уменьшения размеров печени и селезенки, купирования синдрома цитолиза, снижения уровня холестерина, нивелирование признаков фиброза по данным эластографии печени. Однако в связи с прерывистым курсом лечения сохраняются эпизоды гиперхолестеринемии и дислипидемии, признаки стеатоза печени.
Клиническое наблюдение 2
Девочка, 2003 г. р. Из анамнеза известно, что с 5 лет (2008 г.) наблюдалась по месту жительства в связи с периодическими болями в животе. В возрасте 8 лет в связи с длительно сохраняющимся субфебрилитетом впервые проведен биохимический анализ крови и выявлено повышение уровня трансаминаз (АЛТ 82 Ед/л, АСТ 61 Ед/л) и билирубина до 31,8 мкмоль/л. При УЗИ брюшной полости была установлена гепатоспленомегалия, деформация желчного пузыря. В январе 2012 г. была госпитализирована в стационар по месту жительства; при обследовании: сохранялся синдром цитолиза (АЛТ 95,5 Ед/л, АСТ 73,7 Ед/л), впервые определена гиперхолестеринемия — 9,74 ммоль/л (ЛПНП 7,94 ммоль/л), а также гипертриглицеридемия — 2,17 ммоль/л, уровень ЛПВП составил 1,35 ммоль/л. КТ брюшной полости подтвердила наличие гепатомегалии, стеатоза печени, лимфаденопатии (конгломерат лимфатических узлов в области ворот, увеличение лимфатических узлов брыжейки кишечника, забрюшинных лимфатических узлов). По результатам обследования поставлен диагноз: «Хронический гепатит минимальной степени активности, гиперлипидемия». Периодически получала УДХК курсами по 2–3 мес.
При динамическом наблюдении в связи с сохраняющимися высокими показателями холестерина, ЛПНП в 2014 г. выставлен диагноз: «Первичная гиперхолестеринемия, стеатогепатит». В этом же году девочка впервые была госпитализирована в ФГБУН «ФИЦ питания и биотехнологии». При осмотре: кожные покровы физио-логической окраски, склеры субиктеричные, язык густо обложен белым налетом. Живот при пальпации мягкий, болезненный в эпигастральной области, пузырные симптомы положительные. Печень увеличена, выступала из-под края реберной дуги по среднеключичной линии на 6 см (край закруглен, мягко-эластической консистенции). Селезенка пальпировалась по краю реберной дуги. В биохимическом анализе крови сохранялись: синдром цитолиза (АЛТ 80 Ед/л, АСТ 82 Ед/л), гипербилирубинемия за счет непрямой фракции (общий билирубин 60,35 мкмоль/л, прямой билирубин 3,0 мкмоль/л), гиперхолестеринемия, дислипидемия (общий холестерин 10,52 ммоль/л, ЛПНП 8,66 ммоль/л, ЛПВП 1,4 ммоль/л, триглицериды 1,02 ммоль/л, коэффициент атерогенности 6,55 (норма до 3,0)). Маркеры вирусных гепатитов А, В, С отрицательные. ПЦР: цитомегаловирус, вирус Эпштейна — Барр, вирусы простого герпеса 1-го и 2-го типа, вирус герпеса человека 6-го типа не обнаружены. Аутоантитела не выявлены, обмен меди не нарушен. Исключались также глистные инвазии (лямблии, аскарида человека, токсокары, описторхисы, трихинеллы, эхинококки — отрицательно). УЗ-признаки гепатомегалии (ЛД 84 мм, ПД 123 мм, воротная вена (ВВ) 7 мм) с мелкоочаговой диффузной неоднородностью паренхимы, спленомегалия (124×59 мм), эхогенность повышена, селезеночная вена (СВ) расширена до 7 мм.
Эзофагогастродуоденоскопия: катаральный рефлюкс-эзофагит. Недостаточность кардии. Поверхностный рефлюкс-гастрит. Дуоденогастральный рефлюкс.
При эластографии печени признаков фиброза не было, медиана измерений эластичности печени: 5,7 кПа, IQR 1,8 кПа, что соответствует гистологической стадии фиброза F0 (по Metavir). На основании результатов обследования были исключены хронические вирусные гепатиты, дефицит α1-антитрипсина, болезнь Вильсона, аутоиммунный гепатит, гемохроматоз, гликогеновая болезнь. Данных за наследственные аминоацидопатии, органические ацид-урии, дефекты митохондриального β-окисления не было получено. Девочке был поставлен диагноз: «Хронический криптогенный гепатит минимальной степени активности. Синдром Жильбера (подтвержден данными молекулярно-генетического исследования). Хронический гастродуоденит, обострение. Катаральный рефлюкс-эзофагит. Недостаточность кардии. Дуоденогастральный рефлюкс. Дисфункция билиарного тракта на фоне деформации желчного пузыря». Даны рекомендации по диете, назначены гепатопротекторы и симптоматическая терапия.
В 2015 г. девочке при повторной плановой госпитализации проведена пункционная биопсия печени. Результаты морфологического исследования ткани печени: биоптат длиной 1,3 см, в срезе присутствует 7–8 портальных трактов, 3–2 центральные вены. Портальные тракты фиброзированы, множественные порто-портальные септы, фиброзированы стенки центральных вен, поля гепатоцеллюлярного фиброза в центральных отделах дольки. В портальных трактах определяются мелкие пролиферирующие желчные протоки, просвет плохо различим. Гепатоциты различных размеров, округлой формы. Цитоплазма их светлая, содержит множественные мелкие вакуоли, пенистая, низкое накопление ШИК-позитивного вещества. Заключение: морфологическая картина болезней накопления, наиболее вероятно накопление эфиров холестерина.
С учетом выявленных характерных морфологических изменений, сохраняющейся гиперхолестеринемии, гепатоспленомегалии с выраженными признаками стеатогепатита была заподозрена БЭНХ и взяты пятна крови для определения уровня ЛКЛ. В пятне крови уровень кислой липазы был резко снижен (11.2015) — 0,001 нМ/ч/пятно (норма 0,40–3,0 нМ/ч/пятно). При молекулярно-генетическом исследовании крови в гене LIPA методом прямого автоматического секвенирования были проанализированы экзоны 7, 8 и 9 гена и прилегающие интронные участки. В экзоне 7 обнаружена делеция двух нуклеотидов с.817_818delAA в гетерозиготном состоянии, а в экзоне 8 выявлена однонуклеотидная замена с.822G>A в гетерозиготном состоянии. Таким образом, диагноз «Дефицит лизосомной кислой липазы: болезнь накопления эфиров холестерина» был подтвержден генетически.
На момент постановки диагноза девочке было 12 лет. За период наблюдения с возраста 5 лет обращало на себя внимание нарастание размеров печени (до +5–6 см) и селезенки (до +3 см из-под края реберной дуги). В 12 лет у девочки наблюдалась задержка роста (Z-score роста -2,39), дефицит массы тела легкой степени (Z-score массы тела -1,29). Сохранялись цитолиз умеренной степени активности, гиперхолестеринемия, выраженный стеатоз печени по данным УЗИ брюшной полости, фиброз печени F2 по Metavir (медиана эластичности 7,6 кПa, IQR 3,1 кПa) по результатам эластографии печени.
Учитывая прогрессирующее течение заболевания, консилиум врачей ФГБУН «ФИЦ питания и биотехнологии» назначил пациентке по жизненным показаниям, для постоянного индивидуального применения не зарегистрированный на тот момент на территории РФ препарат себелипаза альфа в дозе 1 мг/кг 1 раз в 2 нед. внутривенно через инфузомат, постоянно.
Терапия себелипазой альфа в дозе 1 мг/кг 1 раз в 2 нед. была начата в июне 2016 г. (возраст пациентки на тот момент — 13 лет) в ФГБУН «ФИЦ питания и биотехнологии», где регулярно проводились инфузии до сентября 2017 г., далее ФЗТ была продолжена по месту жительства. Нежелательных явлений на введение не зарегистрировано, переносимость препарата удовлетворительная. Следует отметить, что у данной пациентки также отмечались длительные перерывы в лечении ввиду финансовых проблем с обеспечением.
Результаты обследования перед началом патогенетической терапии: АЛТ 103 Ед/л, АСТ 71,6 Ед/л, холестерин 8,77 ммоль/л, ЛПВП 0,8 ммоль/л, ЛПНП 7,71 ммоль/л, триглицериды 1,34 ммоль/л; печень +5 см, селезенка +3 см.
На фоне проводимой ФЗТ за 5-летний период наблюдения масса тела и рост пациентки достигли возрастных показателей, составив 47 кг и 159 см соответственно (Z-score ИМТ -0,99, Z-score роста -0,61), девушка активна, жалоб не предъявляла, сократились размеры печени и селезенки, половое развитие по Таннер — 5. Уровень трансаминаз соответствовал референсным значениям (АЛТ/АСТ 34/28,5 Ед/л), однако сохранялись гиперхолестеринемия (11,28 ммоль/л), дислипидемия (ЛПНП 9,61 ммоль/л, ЛПВП 1,7 ммоль/л, триглицериды 0,8 ммоль/л) (рис. 2). При УЗИ брюшной полости размеры печени и селезенки сократились (печень: ПДПД 109 мм, ЛД 68 мм, ВВ 7 мм (н), селезенка: 110×50 мм, СВ 5,3 мм), по результатам эластографии печени фиброз F1–F0 по Metavir.
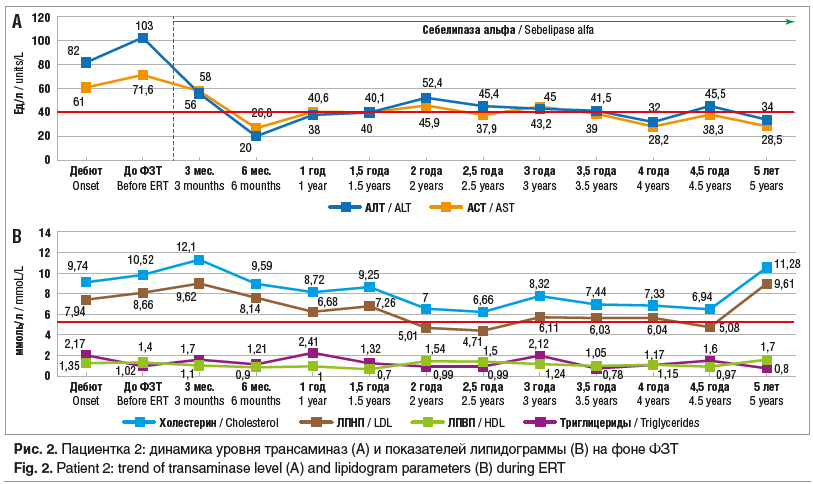
Таким образом, у девочки с ДЛКЛ (БНЭХ) на фоне проводимой ФЗТ наблюдались улучшение темпов физического и полового развития, сокращение размеров печени и селезенки, нормализация активности печеночных ферментов, уменьшение признаков фиброза печени по данным эластографии печени. Сохраняются гиперхолестеринемия, дислипидемия, признаки стеатоза печени, что может быть связано как с нарушением гиполипидемической диеты, так и с прерыванием инфузий себелипазы альфа, как и у первого пациента.
Обсуждение
В статье представлены два клинических наблюдения редкого наследственного заболевания — ДЛКЛ (БНЭХ), характеризующегося гиперхолестеринемией, дислипидемией, повышенным уровнем печеночных ферментов, прогрессирующим поражением печени с формированием фиброза и цирроза печени, задержкой физического развития. Неспецифичность клинико-лабораторных признаков болезни, низкая распространенность заболевания объясняют трудности постановки диагноза, что приводит к отсрочке лечения и развитию осложнений.
До 2015 г. лечение данного заболевания было симптоматическим. В августе 2015 г. себелипаза альфа получила свое первое глобальное одобрение в Европейском союзе для долгосрочной ФЗТ у пациентов всех возрастов с дефицитом ЛКЛ. Себелипаза альфа одобрена для применения в 38 странах мира [5], включая Российскую Федерацию, с конца 2017 г. В представленных нами клинических наблюдениях поводом для обследования на ДЛКЛ были интеркуррентные заболевания, потребовавшие проведения биохимического анализа крови и изучения липидограммы. Показано, что течение заболевания характеризуется прогрессирующими гепатоспленомегалией, УЗ-признаками стеатоза печени, наличием синдрома цитолиза, гиперхолестеринемии и дислипидемии, фиброза печени, резистентными к гепатопротекторам и препаратам базисной терапии. На фоне ФЗТ в обоих клинических наблюдениях отмечается выраженная положительная динамика в виде улучшения самочувствия, показателей физического развития, сокращения размеров печени и селезенки, купирования синдрома цитолиза. Сохраняющиеся гиперхолестеринемия, дислипидемия, УЗ-признаки стеатоза печени, по всей вероятности, связаны с прерывистым курсом проводимого лечения.
Во втором клиническом наблюдении у ребенка отмечались более высокие показатели липидного обмена как до начала терапии, так и на ее фоне, что связано со старшим возрастом и, соответственно, большим временным интервалом накопления эфиров холестерина. Это свидетельствует о необходимости более ранней постановки диагноза и своевременного назначения ФЗТ, что сопряжено с лучшим ответом на лечение.
Заключение
Дефицит лизосомной кислой липазы — редкое орфанное заболевание, приводящее к накоплению эфиров холестерина и триглицеридов в печени, селезенке и других органах. Данные анализа двух клинических наблюдений наглядно демонстрируют важность повышения настороженности к ДЛКЛ и необходимость как можно более ранней диагностики этого заболевания, так как: 1) ДЛКЛ характеризуется зачастую длительным латентным течением, а также может скрываться под маской более распространенных заболеваний (семейная гиперхолестеринемия, неалькогольная жировая болезнь печени, болезнь Вильсона, гепатит неясной этиологии), что затрудняет своевременную диагностику и может привести к раннему формированию фиброза и цирроза печени; 2) в связи с непрерывным патологическим накоплением эфиров холестерина в лизосомах существует постоянный риск возникновения необратимых поражений органов и тканей [14].
Эффективность проводимой ФЗТ ДЛКЛ зависит от возраста манифестации, возраста верификации диагноза и выраженности клинико-лабораторных проявлений. Следует отметить, что соблюдение гиполипидемической диеты является важнейшей и неотъемлемой составляющей терапии ДЛКЛ наряду с основной патогенетической ФЗТ. Недостаточную эффективность снижения уровня холестерина у части пациентов с ДЛКЛ при патогенетической терапии некоторые исследователи объясняют как несоблюдением специальной гиполипидемической диеты, так и возможным формированием фермент-специфических нейтрализующих антител [15]. Однако убедительных доказательств этого факта на данный момент не получено. Возможно, у этой группы пациентов следует провести дополнительное исследование по изменению режимов дозирования препарата, что также продолжает обсуждаться учеными [16].
Сведения об авторах:
Полянская Наталья Александровна — к.м.н., доцент, доцент кафедры госпитальной педиатрии с курсом ДПО ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-8555-8761.
Горбунова Алевтина Александровна — врач гастронефрологического отделения БУЗОО «ОДКБ»; 644001, Россия, г. Омск, ул. Куйбышева, д. 77.
Павлинова Елена Борисовна — д.м.н., доцент, заведующая кафедрой госпитальной педиатрии с курсом ДПО ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-6444-1871.
Савченко Ольга Анатольевна — к.м.н., доцент кафедры госпитальной педиатрии с курсом ДПО ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0003-2035-5653.
Киршина Ирина Алексеевна — к.м.н., ассистент кафедры госпитальной педиатрии с курсом ДПО ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-3081-4676.
Багаева Мадлена Энверовна — к.м.н., старший научный сотрудник отделения педиатрической гастроэнтерологии, гепатологии и диетотерапии ФГБУН «ФИЦ питания и биотехнологии»; 109240, Россия, г. Москва, Устьинский пр-д, д. 2/14; ассистент кафедры гастроэнтерологии и диетологии ФДПО РНИМУ им. Н.И. Пирогова Минздрава России; 117437, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-1752-6901.
Строкова Татьяна Викторовна — д.м.н., профессор РАН, заведующая отделением педиатрической гастроэнтерологии, гепатологии и диетотерапии ФГБУН «ФИЦ питания и биотехнологии»; 109240, Россия, г. Москва, Устьинский пр-д, д. 2/14; заведующая кафедрой гастроэнтерологии и диетологии ФДПО РНИМУ им. Н.И. Пирогова Минздрава России; 117437, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-0762-0873. Контактная информация: Полянская Наталья Александровна, e-mail: polyansknatalya@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 15.06.2022.
Поступила после рецензирования 08.07.2022.
Принята в печать 02.08.2022.
About the authors:
Natalia A. Polyanskaya — C. Sc. (Med.), Associate Professor of the Department of Hospital Pediatrics with the course of Continuing Professional Education, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-8555-8761.
Alevtina A. Gorbunova — doctor of the Department of Gastroenterology, Regional Children’s Clinical Hospital; 77, Kuibyshev str., Omsk, 644001, Russian Federation.
Elena B. Pavlinova — Dr. Sc. (Med.), Associate Professor, Head of the Department of Hospital Pediatrics with the course of Continuing Professional Education, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-6444-1871.
Olga A. Savchenko — C. Sc. (Med.), Associate Professor of the Department of Hospital Pediatrics with the course of Continuing Professional Education, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0003-2035-5653.
Irina A. Kirshina — C. Sc. (Med.), Assistant Professor of the Department of Hospital Pediatrics with the course of Continuing Professional Education, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-3081-4676.
Madlena E. Bagaeva — C. Sc. (Med.), Senior Researcher of the Department of Pediatric Gastroenterology, Hepatology and Nutrition Therapy, Federal Research Center for Nutrition and Biotechnology; 2/14, Ust’inskiy pass., Moscow, 109240, Russian Federation; Assistant Professor of the Department of Gastroenterology and Nutrition Science of the Faculty of Continuous Professional Education, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-1752-6901.
Tatiana V. Strokova — Dr. Sc. (Med.), Professor of the Russian Academy of Sciences, Head of the Department of Pediatric Gastroenterology, Hepatology and Nutrition Therapy, Federal Research Center for Nutrition and Biotechnology; 2/14, Ust’inskiy pass., Moscow, 109240, Russian Federation; Head of the Department of Gastroenterology and Nutrition Science of the Faculty of Continuous Professional Education, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-0762-0873.
Contact information: Natalia A. Polyanskaya, e-mail: polyansknatalya@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 15.06.2022.
Revised 08.07.2022.
Accepted 02.08.2022.
.
Информация с rmj.ru






