Вариант фенотипа частичной атрофии зрительного нерва вследствие мутации в гене С19orf12 (нейродегенерация с накоплением железа в мозге (nbia))
Содержание статьи
Введение
Мутации в гене C19orf12 характеризуются первоначально изменениями походки, сопровождающимися прогрессирующим спастическим парезом, прогрессирующей дистонией (которая может быть ограничена руками и ногами или быть более общего характера), психоневрологическими нарушениями (например, эмоциональной лабильностью, депрессией, беспокойством, импульсивностью, галлюцинациями, невнимательностью и гиперактивностью), снижением когнитивных способностей [1, 2]. Дополнительные ранние признаки могут включать дисфагию, дизартрию, атрофию зрительного нерва, аксональную нейропатию, паркинсонизм и недержание кала/мочи. Обычно пациенты доживают до взрослого возраста, но не оставляют потомства. Конечная стадия заболевания характеризуется тяжелой деменцией, спастичностью, дистонией и паркинсонизмом [3, 4]. Мутации в гене C19orf12 характерны для населения восточноевропейских стран [5, 6].
Клиническое наблюдение
У мальчика 7 лет в течение 2 лет значительно снизилось зрение без видимой причины, очковая коррекция не давала улучшения зрения до 100%. При обследовании была выявлена частичная атрофия зрительных нервов, проведены консультации неврологом, нейроофтальмологом. Выявлена гиперрефлексия, изменение походки (ходит на носочках), незначительная задержка речевого развития. Другой характерной клинической неврологической симптоматики не наблюдалось. Телосложение нормостеничное, рост 140 см, вес 30 кг, роды в срок, стигм дизэмбриогенеза не выявлено, перинатальные инфекции отрицают.
При офтальмологическом обследовании (2018 г.)
Vis OD = 0,5 sph -0,50 = 0,8
Vis OS = 0,5 sph -0,50 = 0,8
Авторефрактометрия:
OD sph -0,50 cyl 0,00
OS sph -0,25 cyl -0,5 ax 5
Пневмотонометрия OD 22 мм рт. ст., OS 18 мм рт. ст.
Status oculorum: положение глаз в орбите правильное, глазные структуры сформированы полностью, врожденных пороков органа зрения не наблюдается, движение глаз в полном объеме, девиация по Гиршбергу 0 градусов, передняя камера средней глубины, влага чистая, радужная оболочка в норме, зрачки в центре округлой формы, диаметр OD=OS=4 мм, прямая и содружественная фотореакция зрачков в норме, хрусталики в задней камере, прозрачны, в стекловидном теле единичные плавающие помутнения.
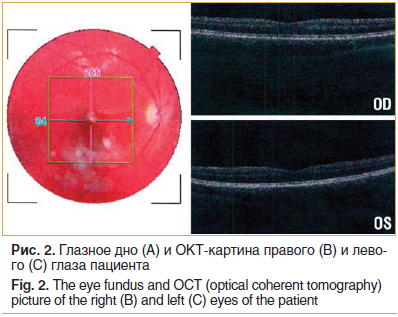
Офтальмоскопия: глазное дно: OU — диски зрительного нерва бледные, монотонные, границы четкие, сосудистый пучок в центре, сосуды сужены, макулярный и фовеальный рефлексы четкие, периферия сетчатки без патологии (тропикамид 1,0%) [7].
По данным электроретинографии (ЭРГ) выявлено нарушение электрогенеза наружных и средних слоев в макулярной зоне (рис. 1).
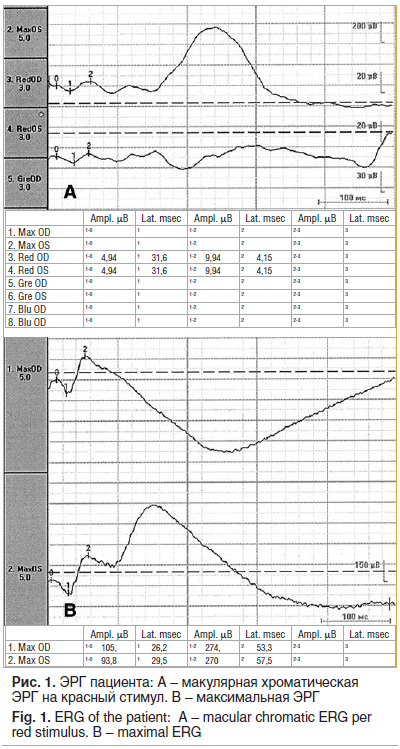
Зрительные вызванные потенциалы: на паттерн, амплитуда снижена на 30 угловых минут OD, на 60 угловых минут OS.
Оптическая когерентная томография (ОКТ) показала равномерное истончение наружных слоев сетчатки. Макулярный рефлекс слабо дифференцируется (рис. 2).
Периметрия (результаты недостоверны): сужение полей зрения до 20–25 градусов.
Цветовосприятие: сохранено.
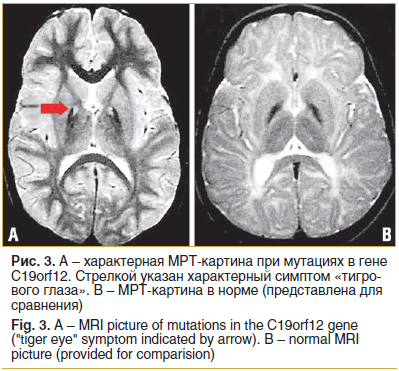
По результатам магнитно-резонансной томогра-
фии (МРТ) очаговой патологии не выявлено. Отмечается формирование симптома «пустого турецкого седла» (рис. 3) Пациенту показано наблюдение в динамике для определения накопления железа по типу «tiger eye» [6].
При неврологическом обследовании выявлена гиперрефлексия, изменение походки (ходит на носочках), незначительная задержка речевого развития. Другой характерной клинической неврологической симптоматики не наблюдается.
Консультация нейроофтальмолога: патология сетчатки, зрительного нерва врожденного характера.
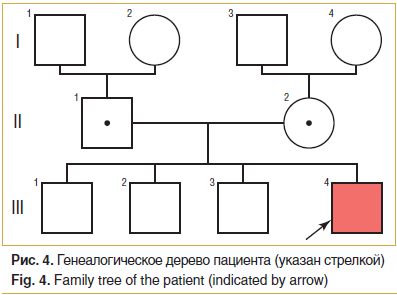
Консультация генетика: родители здоровы, национальность — русские, родственный брак полностью исключить не представляется возможным. У пробанда три старших брата (рис. 4), ни у кого в семье схожих заболеваний не было. У самого старшего брата выявлена миопия
-4,0 дптр, а также склонность к нервным тикам. Других заболеваний глаз, нервной системы и других органов у старших братьев пробанда не обнаружено.
Результаты генетического анализа. По результатам проведения полноэкзомного секвенирования (Illumina Novaseq 6000 с применением набора Agilent SureSelect Human AII Exon V.7, биоинформатическая обработка проприетарными алгоритмами Независимой лабораторией клинической биоинформатики, Москва) обнаружена описанная ранее мутация в гомозиготном состоянии в 3-м экзоне C19orf12 (chr19:30193863AACAGCCCCCCG>A, rs515726204), приводящая к сдвигу рамки считывания, начиная с 69-го кодона (p.Gly69fs, NM_001031726.3). Мутация описана в гомозиготной форме и компаунд-гетерозиготной форме вместе с другими мутациями у пациентов с нейродегенерацией с накоплением железа в головном мозге, тип 4 (OMIM: 614298) [3, 5]. Частота мутации в контрольной выборке ExAC составляет 0,0074%. По совокупности сведений мутацию следует расценивать как патогенную.
Обсуждение
Белок C19orf12 локализован в основном в мембране эндоплазматического ретикулума (ЭПР) и в мембране митохондрий. Вторичная и третичная структура C19orf12 представлена на рисунке 5. Предсказание трансмембранных областей выполнено с помощью MEMSAT, трансмембранные области прогнозируются в спиральных структурах PSI-Pred, выделены зеленым цветом (рис. 5А). Трехмерная (3D) модель полноразмерного белка C19orf12 гомологичного N-домену MgtE представлена в виде лент (рис. 5В). Белок показан оттенком цвета от синего до красного, от N- до С-конца соответственно. Точки и стрелки обозначают области, которые, как ожидается, соединяют домен с мембраной [8].
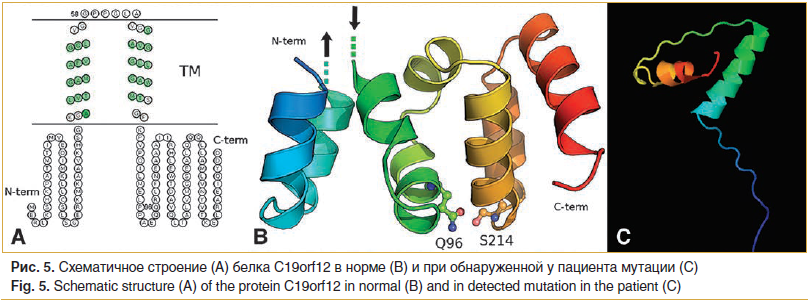
На рисунке 5С показан предиктивный анализ укороченной вследствие мутации у пробанда версии белка C19orf12 с применением инструмента Phyre2 для построения модели. Функциональный анализ in silico предсказывает значительное нарушение функции белка вследствие имеющейся мутации, что объясняет наблюдаемую клиническую картину, однако нельзя исключить резкое прогрессирование заболевания в этом случае.
ТМ — трансмембранный домен митохондриальной мембраны и мембраны эндоплазматического ретикулума, где наблюдается расположение большей части белка C19orf12. Пространственное строение нормального белка C19orf12 указано на рисунке 5В. Предиктивный in silico анализ возможного изменения структуры белка у данного пациента вследствие frameshift-мутации в 3-м экзон chr19:30193863AACAGCCCCCCG>A, rs515726204 со сдвигом рамки считывания, начиная с 69-го кодона p.Gly69fs с применением online программного инструмента Phyre2 [9], показан на рисунке 5С.
Прогноз: средней тяжести.
Медико-генетическое консультирование: риск рождения в семье ребенка с NBIA (Neurodegeneration With The Brain Iron Accumulation — нейродегенерация с накоплением железа в головном мозге) составляет 25%. Вопрос деторождения в данной семье не актуален.
Лечение и наблюдение: в данном случае целесообразно применять хелатные препараты, например деферипрон (не зарегистрирован в РФ) для уменьшения накопления железа в нейронах головного мозга с целью снижения потенциального прогрессирования неврологической симптоматики. Назначено регулярное применение хелатных препаратов железа в течение 2 лет с дальнейшей оценкой клинического и функционального состояния, проведение МРТ в динамике.
Заключение
Приведенный клинический случай иллюстрирует важность своевременной и точной диагностики пациентов с различными формами аномалий сетчатки и зрительного нерва, в т. ч. с применением технологий секвенирования нового поколения. В данном случае по результатам генетического анализа был значительно уточнен клинический и генетический диагноз нейродегенерации с накоплением железа в мозге (NBIA), что дает шанс замедлить прогрессирование заболевания с помощью препаратов, влияющих на метаболизм железа в организме. Несмотря на то, что некоторые клиницисты [10] низко оценивают перспективы патогенетически направленной терапии хелатами, применение препаратов, влияющих на различные звенья патогенеза данного заболевания, в свете подробных знаний о нем позволит облегчить течение болезни. Также с учетом свойств гена C19orf12 вероятность применения генной терапии в будущем с хорошим терапевтическим эффектом довольно высока.
Сведения об авторах:
1Иванова Марианна Евгеньевна — к.м.н., врач-офтальмолог, руководитель, ORCID iD 0000-0002-1089-4293;
2Кадышев Виталий Викторович — к.м.н., старший научный сотрудник, врач-генетик, офтальмолог, ORCID iD 0000-0001-7765-3307;
3Атарщиков Дмитрий Сергеевич — к.м.н., врач-офтальмолог, ORCID iD 0000-0003-4401-9099;
4Зольникова Инна Владимировна — д.м.н., врач-офтальмолог, старший научный сотрудник, ORCID iD 0000-0001-7264-396X;
4Акчурина Наталья Павловна — к.м.н., врач-офтальмолог, ORCID iD 0000-0001-9155-791X;
5Серова Наталья Константиновна — д.м.н., нейроофтальмолог, главный научный сотрудник, ORCID iD 0000-0003-0148-7298;
6Коновалов Федор Андреевич — к.б.н., биоинформатик, руководитель, ORCID iD 0000-0001-6414-436X;
6Лозиер Екатерина Ричардовна — биоинформатик, ORCID iD 0000-0003-2901-0539;
7Померанцева Екатерина Алексеевна — к.б.н., врач-генетик, ORCID iD 0000-0002-6765-7133;
7Ветрова Наталья Владимировна — к.м.н., врач-генетик, ORCID iD 0000-0001-5142-6851;
8Бар Дебмала — PhD, руководитель отдела анализа омиксных данных, ORCID iD 0000-0002-2557-7768;
9Балашова Лариса Маратовна — д.м.н., врач-офтальмолог, ORCID iD 0000-0001-9349-7092;
10 Салмаси Жеан Мустафаевич — д.м.н., профессор, заведующий кафедрой патофизиологии, ORCID iD 0000-0001-8524-0019.
1ООО «Офтальмик». 125167, Россия, г. Москва, Ленинградский пр-т, д. 47/3–3.
2ФГБНУ «МГНЦ». 115478, Россия, г. Москва, ул. Москворечье, д. 1.
3ФГБУ «ЦКБ с поликлиникой». 121359, Россия, г. Москва, ул. Маршала Тимошенко, д. 15.
4ФГБУ «МНИИ ГБ им. Гельмгольца» Минздрава России. 105062, Россия, г. Москва, ул. Садовая-Черногрязская, д. 14/19.
5ФГАУ «НМИЦ нейрохирургии им. ак. Н.Н. Бурденко» Минздрава России. 125047, Россия, г. Москва, ул. 4-я Тверская-Ямская, д. 16.
6Лаборатория клинической биоинформатики. 123181, Россия, г. Москва, ул. Маршала Катукова, д. 21, корп. 1.
7ООО «ЦГРМ «Генетико». 119333, Россия, г. Москва, ул. Губкина, д. 3, корп. 1.
8Центр геномики и прикладной генной технологии. 560032, Индия, г. Бангалор, ул. Чоланаяканахалли, д. 209.
9НП «МНПЦПТ». 119034, Россия, г. Москва, ул. Пречистенка, д. 29/14.
10ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
Контактная информация: Иванова Марианна Евгеньевна, e-mail: info@oftalmic.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов: Иванова М.Е. является сотрудником компании ООО «Офтальмик», Коновалов Ф.А., Лозиер Е.Р. являются сотрудниками лаборатории клинической биоинформатики, Померанцева Е.А., Ветрова Н.В. являются сотрудниками лаборатории «Генетико». Остальные авторы заявляют об отсутствии конфликта интересов. Статья поступила 14.09.2019.
About the authors:
1Marianna E. Ivanova — MD, PhD, Head of CRO, ORCID iD 0000-0002-1089-4293;
2Vitaly V. Kadyshev — MD, PhD, Senior Researcher ophthalmologist, geneticist, ORCID iD 0000-0001-7765-3307;
3Dmitry S. Atarshchikov — MD, PhD, ophthalmologist, ORCID iD 0000-0003-4401-9099;
4Inna V. Zolnikova — MD, PhD, ophthalmologist, Senior Researcher, ORCID iD 0000-0001-7264-396X;
4Natalya P. Akchurina — MD, PhD, ophthalmologist, ORCID iD 0000-0002-6726-4612;
5Natalya K. Serova — MD, PhD, neuroophthalmologist, Chief Researcher, ORCID iD 0000-0003-0148-7298;
6Fedor A. Konovalov — PhD, Head of bioinformatics department, ORCID iD 0000-0001-6414-436X;
6Ekaterina R. Lozier — bioinformatician, ORCID iD 0000-0003-2901-0539;
7Ekaterina A. Pomerantseva — MD, PhD, geneticist, ORCID iD 0000-0002-6765-7133;
7Natalya V. Vetrova — MD, PhD, geneticist, ORCID iD 0000-0002-7012-2359;
8Debmalya Barh — PhD, Head of OMICs analysis department, ORCID iD 0000-0002-2557-7768;
9Larisa M. Balashova — MD, PhD, Professor, Head of the Center, ORCID iD 0000-0001-9349-7092;
10Jean M. Salmasi — MD, PhD, Professor, Head of Patho-physiology Department, ORCID iD 0000-0001-8524-0019.
1LLC “Oftalmic”. 47/3–3, Leningradsky Prospekt, Moscow, 125167, Russian Federation.
2Research Centre for Medical Genetics. 1, Moskvorechie str., Moscow, 115478, Russian Federation.
3Central Clinical Hospital for Presidential Affairs. 15, Marshala Timoshenko str., Moscow,121359, Russian Federation.
4Moscow Helmholtz Research Institute of Eye Diseases. 14/19, Sadovaya-Chernogryazskaya str., Moscow, 105062, Russian Federation.
5N.N. Burdenko National Medical Research Center of Neurosurgery. 16, 4-th Tverskaya-Yamskaya str., Moscow, 125047, Russian Federation.
6Independent Clinical Bioinformatics Laboratory, 21/1, Marshala Katukova str., Moscow, 123181, Russian Federation.
7Center for Genetics and Reproductive Medicine “Genetiko”. 3/1, Gubkina str., Moscow, 119333, Russian Federation.
8Institute of Integrative Omics and Applied Biotechnology (IIOAB). 209, Cholanayakanahalli str., Bangalore, 560032, India.
9Non-profit partnership International Scientific and Practical Center for the Proliferation of Tissues of Russia. 29/14, Prechistenka str., Moscow, 119034, Russian Federation.
10Pirogov Russian National Research Medical University. 1, Ostrovityanov str., Moscow, 117513, Russian Federation.
Contact information: Marianna E. Ivanova, e-mail: info@ oftalmic.ru. Financial Disclosure: Marianna E. Ivanova is the collaborator of LLC “Oftalmic”. Fedor A. Konovalov, Ekaterina R. Lozier are employees of the Independent Clinical Bioinformatics Laboratory, Ekaterina A. Pomerantseva, Natalya V. Vetrova are employees of the “Genetiko” Center. Other authors declare that there is no conflict of interests. Received 14.09.2019.
материал rmj.ru
