Введение
Глаукома является одной из ведущих причин необратимого снижения зрения у населения разных стран мира и включает в себя группу глазных заболеваний с прогрессирующим поражением зрительного нерва. В экономически развитых странах на глаукому приходится большая доля амбулаторных обращений к офтальмологу. Распространенность первичной открытоугольной глаукомы (ПОУГ) зависит от этнической принадлежности и составляет от 1% в странах Азии [1] до 8,8% у жителей стран Африканского континента [2].
Глаукома нормального давления (ГНД) представляет собой клиническую разновидность ПОУГ, при которой глаукоматозное поражение зрительного нерва происходит при максимальном внутриглазном давлении (ВГД) ниже 21 мм рт. ст. [3]. Ранние предположения о том, что глаукома при низком ВГД является редкой патологией, не подтвердились в многочисленных эпидемиологических исследованиях [4–8]. Так, в исследовании B.E.K. Klein et al. [4] было показано, что практически у трети пациентов с глаукомой ВГД не было повышено. Y. Shiose et al. [5] обследовали 8126 человек старше 40 лет и выявили, что две трети японских пациентов с глаукомой имеют ГНД. В азиатских популяциях распространенность ГНД составила от 50 до 92% от числа лиц с ПОУГ [6], что значительно превышает соответствующие показатели у европейцев — 30–38% [7, 8].
В настоящее время выделяют ряд факторов, влияющих на развитие ГНД, таких как изменения в иммунной системе, давление спинномозговой жидкости, нарушения тонуса сосудов [9]. Точный механизм влияния вышеупомянутых факторов риска развития глаукомы до сих пор полностью не выяснен, эти данные свидетельствуют о том, что факторы, не связанные с ВГД, имеют решающее значение для развития ГНД. Известно, что глаукома и родственные эндофенотипы (ВГД, центральная толщина роговицы, параметры диска зрительного нерва) в значительной степени наследуются [10]. Превалирующее число генетических локусов, идентифицированных в многочисленных молекулярно-генетических исследованиях глаукомы, подтверждают полигенную природу заболевания [11, 12].
Содержание статьи
Генетические исследования ГНД
Результаты эпидемиологических и генетических исследований позволяют сделать предположение о наличии специфичных средовых и генетических факторов риска развития ГНД.
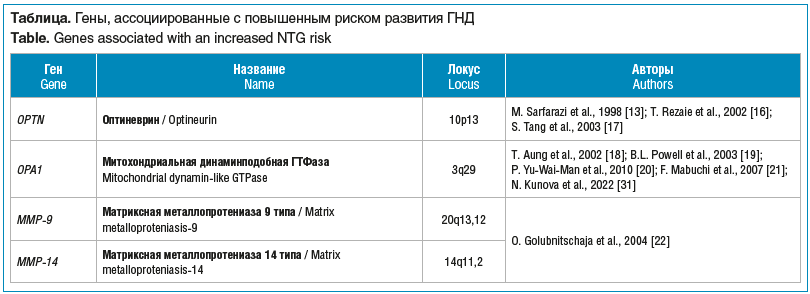
В 1998 г. M. Sarfarazi et al. [13] опубликовали результаты на основе исследования большой британской семьи с 16 индивидами с ГНД и картировали локус 10p15-p14 (GLC1E). В данном локусе находится ген OPTN, который кодирует белок оптиневрин, индуцирующий нейропатию зрительного нерва. Данный ген экспрессируется в тканях глаза, включая трабекулярную сеть, цилиарный эпителий, сетчатку и водянистую влагу. Мутация E50K в гене OPTN способна избирательно индуцировать гибель ганглиозных клеток, опосредованную окислительным стрессом [14]. Исследования также выявили возможную связь между ГНД и болезнью Альцгеймера, опосредованную оптиневрином [15]. T. Rezaie et al. [16] предположили, что OPTN может играть нейропротекторную роль и сообщили, что мутации в OPTN могут быть причиной 16,7% наследственных форм ГНД с дополнительным фактором риска 13,6% как в семейных, так и в спорадических случаях.
Однако в исследовании S. Tang et al. [17], проведенном в Японии на выборке из 148 неродственных пациентов с ГНД, а также 165 пациентов с ПОУГ и 196 человек контрольной группы, не было обнаружено связи OPTN с повышенным риском развития ГНД. T. Aung et al. [18] предположили, что полиморфизмы в гене OPA1 связаны с ГНД в европейской популяции и могут служить генетическим маркером риска развития заболевания. Авторы обследовали две группы пациентов (83 пациента с ГНД в первой группе и 80 пациентов во второй) и выявили, что однонуклеотидный полиморфизм IVS8+4C/T был связан с развитием ГНД в обеих группах. Другой полиморфизм — IVS8+32T/C был ассоциирован с ГНД только в первой группе. Эти же авторы изучали связь полиморфизмов OPA1 IVS8+4C/T, +32T/C с ПОУГ и выявили, что данные локусы не были значимо связаны с ПОУГ. На основании этого авторы сделали предположение о генетической гетерогенности между ГНД и ПОУГ [18].
Интересно, что в исследовании B.L. Powell et al. [19] была выявлена ассоциация генотипа IVS8+32T/C с ГНД у представителей европейской популяции. Также ассоциация полиморфизмов OPA1 IVS8+4C/T, +32T/C с ГНД, но не с ПОУГ была обнаружена в исследовании, проведенном в Англии в 2010 г. на группе из 137 пациентов с ПОУГ, в том числе 67 — с гипертензивной глаукомой и 70 — с ГНД [20].
В Японии F. Mabuchi et al. [21] на выборке из 194 человек обнаружили значимую связь ГНД с полиморфизмом IVS8+32T/C, но не с IVS8+4C/T. Наблюдалась значительная разница в распределении частот генотипов OPA1 IVS8 +32 T/C в группе пациентов с ГНД по сравнению с контрольной группой.
O. Golubnitschaja et al. [22] выявили повышенную экспрессию генов MMP-9 и MMP-14 в циркулирующих лимфоцитах у больных ГНД. MMP‑9 принимает участие в процессах воспаления (как и MMP‑2, может обладать про- и противовоспалительной активностью), в процессе ремоделирования тканей и репарации, мобилизации матрикс-связанных факторов роста и процессинга цитокинов [23]. Основная функция ММР‑14 или металлопротеиназы мембранного типа 1 заключается в активации про-ММР‑2 путем формирования трехмолекулярного комплекса с про-ММР-2 и тканевого ингибитора металлопротеиназы 2 (TIMP‑2).
В России М.О. Кирилловой и соавт. [24] была выполнена работа, посвященная оценке вовлеченности генов, связанных с ремоделированием соединительной ткани, при развитии ПОУГ, но не ГНД. C. Wolf et al. [25] изучали связь 98 полиморфных маркеров генов, кодирующих митохондриальные белки, включая митофузин 1 (MFN1) и митофузин 2 (MFN2) с ГНД у 285 пациентов с ГНД и 282 контрольных пациентов, проживающих в Германии. Связанными с ГНД оказались полиморфизмы rs2111534 в гене MFN1 и rs873458, rs2295281, rs11588779 в гене MFN2 [25]. Интересно, что помимо ГНД, MFN2 также был связан с другими нейродегенеративными и неврологическими заболеваниями, включая болезнь Шарко — Мари — Тута типа 2А [26, 27], аксональную нейропатию с атрофией зрительного нерва [28] и инсульт [29].
Другим геном, полиморфизмы которого были связаны с повышенным риском развития ГНД, как показано в работе C. Wolf et al. [25], является ген PARL, кодирующий пресенилин-ассоциированный ромоидоподобный белок. Патогенетическое значение PARL может быть обусловлено тем, что он кодирует протеазу для митохондриальной динаминподобной ГТФазы OPA1 [30] и влияет на процессы апоптоза [31].
Ассоциация однонуклеотидных полиморфизмов гена Toll-подобного рецептора 4 (TLR4) была установлена в работе, проведенной в 2008 г. в Японии, и была подтверждена в исследовании Y. Takano et al. [32] в этой же популяции. Toll-подобный рецептор 4 является трансмембранным рецептором и опосредованно влияет на патогенез ГНД, взаимодействуя с белками теплового шока.
Повышенная экспрессия гена RORC (ретиноид-связанный орфанный рецептор типа гамма) в лимфоцитах пациентов с ГНД была обнаружена в исследовании S.A. Fraenkl et al. [33]. Имеются данные об участии данного кодируемого ядерного рецептора в иммунном ответе и апоптозе. Измененный иммунный ответ, так же как и усиленный апоптоз, вовлечены в патогенез ГНД [34].
K. Murakami et al. [35] обнаружили ассоциацию локуса гена GLC1F с ГНД на выборке из 242 пациентов с глаукомой (в том числе 141 человек с ГНД) в Японии.
F. Mabuchi et al. [21] выявили, что полиморфизмы генов CDKN2B и ATOH7 были связаны с повышенным риском развития ГНД, но не были ассоциированы с ВГД. Ассоциация полиморфизма гена CDKNB1 с ГНД подтвердилась в работе Y. Chen et al. [36] в 2015 г.
Помимо однонуклеотидных полиморфизмов, вариации числа копий способствуют развитию ПОУГ, включая ГНД [37]. В ряде исследований было показано, что дупликации сегмента хромосомы 12q14 гена TBK1 связаны с 0,4–1,3% случаев ГНД у европеоидов и монголоидов [38, 39]. Конкретный механизм, с помощью которого дупликации гена TBK1 приводят к ГНД, неизвестен. Мутации генов TBK1, OPTN и TLR4, вероятно, могут активировать аутофагию и приводить к гибели ганглиозных клеток сетчатки при глаукоме. Другой возможный механизм связан с тем, что TBK1 участвует в регуляции иммунного ответа [40].
Полногеномные исследования ГНД
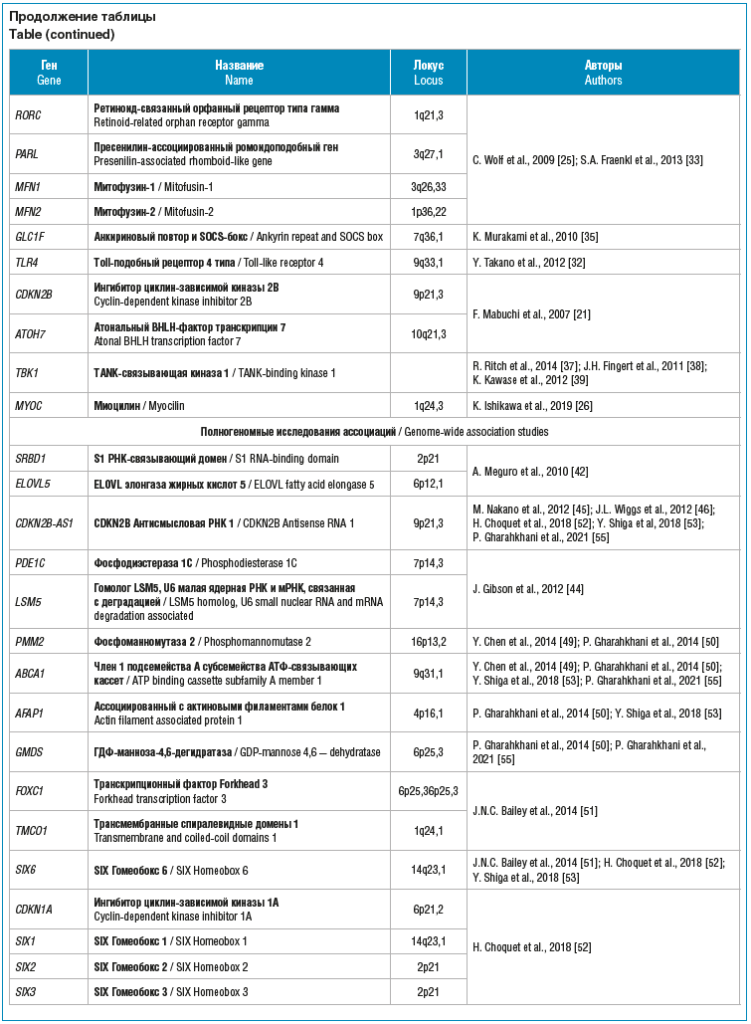
В настоящее время в каталоге полногеномных исследований ассоциаций (genome-wide association study, GWAS) GWAS catalog [41] содержится 39 записей о 22 проведенных исследованиях открытоугольной глаукомы, включая всего одну запись о работе, в которой изучалась генетическая архитектура ГНД.
В 2010 г. в Японии было проведено полногеномное исследование ГНД на выборке из 305 индивидов с ГНД и 355 человек контрольной группы [42]. Авторы идентифицировали локусы SRBD1 и ELOVL5 как новые гены предрасположенности к ГНД. Поскольку гены SRBD1 и ELOVL5, как сообщается, участвуют в индукции ингибирования клеточного роста или апоптоза [43], регуляция молекулярных каскадов, в которые вовлечены продукты генов SRBD1 и ELOVL5, может играть важную физиологическую роль в развитии ГНД.
В 2013 г. были проведены 3 полногеномных исследования глаукомы, которые включали подгруппы пациентов с ГНД на выборках различной этнической принадлежности [44–46]. В работе, проведенной M. Nakano et al. [45] в Японии на выборке из 833 пациентов с глаукомой, включая 503 человека с ГНД и 686 индивидов контрольной группы, был идентифицирован локус гена CDKN2B-AS1, значимо ассоциированный с ГНД. Интересно, что ассоциация данного локуса была подтверждена J.L. Wiggs et al. [46] на выборке из 720 пациентов с ГНД и 3443 участников контрольной группы европеоидной расы. Функциональная значимость CDKN2B-AS1 связана с его опосредованным участием в работе ряда отделов центральной нервной системы, а также в воспалительных процессах [47, 48]. Результаты исследования J. Gibson et al. [44] также подтвердили ассоциацию гена CDKN2B-AS1 с ГНД в GWAS, однако авторы не получили значимых результатов при репликации на независимой выборке.
Y. Chen et al. [49] в 2014 г. опубликовали результаты GWAS ПОУГ, в котором они идентифицировали 7 однонуклеотидных полиморфизмов, ассоциированных с заболеванием. Авторы проверили ассоциацию этих полиморфизмов на выборке из 759 человек, страдающих ГНД, и 2728 участников контрольной группы в Китае и выявили связь локусов генов ABCA1 и PMM с ГНД. Локус ABCA1 также был идентифицирован в GWAS глаукомы, проведенном P. Gharahkhani et al. [50] в 2014 г. в Австралии. Было исследовано 330 индивидов с ГНД, 709 с глаукомой при повышенном ВГД и 1992 человека контрольной группы и установлено, что, помимо ABCA1, локусы AFAP и GMDS значимо увеличивают риск ГНД. Важно отметить, что данные локусы были также ассоциированы с ПОУГ.
J.N.C. Bailey et al. [51] в 2016 г. провели GWAS глаукомы на выборке из 1868 лиц с ПОУГ (из них 725 с ГНД) и идентифицировали новый локус в гене FOXC1, а также два локуса (TMCO1 и SIX6), которые были ранее выявлены в исследовании ПОУГ.
Крупномасштабное мультиэтническое исследование было проведено в 2018 г. H. Choquet et al. [52] на выборке из 4986 пациентов с глаукомой, из них 743 с ГНД, и 58 642 индивидуумов контрольной группы. Из 12 полиморфизмов, идентифицированных на полной выборке, три были значимо связаны с повышенным риском развития ГНД, а именно полиморфизмы генов CDKN1A, CDKN2B-AS1 и SIX1-SIX6.
Y. Shiga et al. [53] провели GWAS глаукомы на выборке из 7378 пациентов с ПОУГ и 36 385 участников контрольной группы Биобанка Японии и идентифицировали 11 локусов, которые были реплицированы на 1026 пациентах с ГНД (см. таблицу).
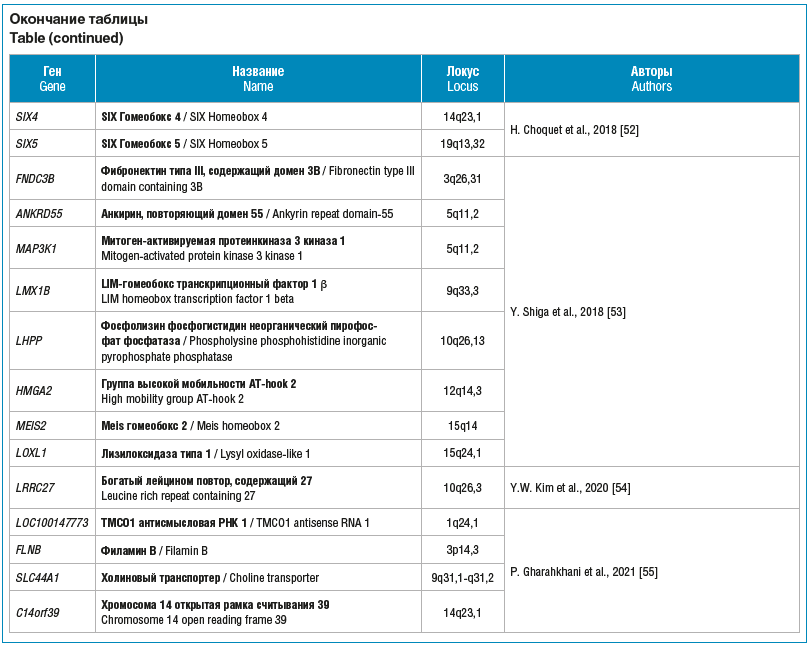
В работе Y.W. Kim et al. [54] в 2020 г. была выявлена ассоциация однонуклеотидного полиморфизма гена LRRC27 c ГНД у пациентов из Японии и Южной Кореи.
Крупнейшее на данный момент полногеномное исследование глаукомы было проведено в 2021 г. P. Gharakhani et al. [55] на выборке из 34 179 пациентов с глаукомой и 349 321 индивидуума контрольной группы. При проведении анализа на подгруппе из 3427 лиц с ГНД и 47 997 человек контрольной группы авторы идентифицировали 6 локусов, ассоциированных с ГНД (см. таб-лицу). Почти все эти локусы были также ассоциированы с ПОУГ, кроме FLNB. Примечательно, что связь FLNB с изменениями зрительного нерва была обнаружена в предыдущем исследовании [56].
Заключение
Результаты современных исследований подчеркивают значимость генетических факторов в развитии ГНД. Проведенные полногеномные исследования помогли выявить новые локусы, связанные с риском развития ГНД, что дает ключ к пониманию молекулярных механизмов патогенеза заболевания. Эти знания открывают возможности для улучшения диагностики и разработки персонализированных методов лечения, основанных на генетических особенностях пациентов. Применение генетических биомаркеров может повысить точность раннего выявления и мониторинга заболевания, что особенно важно для предотвращения прогрессирования глаукомы и необратимой потери зрения. Несмотря на значительный прогресс в этой области за рубежом, в России подобные исследования практически не проводились, что подчеркивает необходимость их проведения для изучения специфических генетических факторов риска ГНД у населения Российской Федерации.
Сведения об авторах:
Плотников Денис Юрьевич — к.м.н., врач-офтальмолог, заведующий лабораторией интегративной эпидемиологии Центральной научно-исследовательской лаборатории ФГБОУ ВО Казанский ГМУ Минздрава России; 420012, Россия, г. Казань, ул. Бутлерова, д. 49; ORCID iD 0000-0002-9950-8992
Валеева Елена Валерьевна — к.б.н., младший научный сотрудник лаборатории генетики старения и долголетия ФГБОУ ВО Казанский ГМУ Минздрава России; 420012, Россия, г. Казань, ул. Бутлерова, д. 49; ORCID iD 0000-0001-7080-3878
Контактная информация: Плотников Денис Юрьевич, e-mail: Denis.plotnikov@kazangmu.ru
Источник финансирования: работа выполнена при финансовой поддержке гранта ФГБОУ ВО Казанский ГМУ Минздрава России (№ 2/22-2 от 01.08.2022).
Конфликт интересов отсутствует.
Статья поступила 06.03.2024.
Поступила после рецензирования 29.03.2024.
Принята в печать 23.04.2024.
About the authors:
Denis Yu. Plotnikov — C. Sc. (Med.), ophthalmologist, Head of the Laboratory of Integrative Epidemiology, Central Scientific Research Laboratory, Kazan State Medical University; 49, Butlerov str., Kazan, 420012, Russian Federation; ORCID iD 0000-0002-9950-8992
Elena V. Valeeva — C. Sc. (Biol.), Junior Scientific Officer of the Laboratory of Genetics of Aging and Longevity, Kazan State Medical University; 49, Butlerov str., Kazan, 420012, Russian Federation; ORCID iD 0000-0001-7080-3878
Contact information: Denis Yu. Plotnikov, e-mail: Denis.plotnikov@kazangmu.ru
Financial Disclosure: the work was carried out under the sponsorship of a grant from the Kazan State Medical University (No. 2/22-2 dt. 01.08.2022).
There is no conflict of interest.
Received 06.03.2024.
Revised 29.03.2024.
Accepted 23.04.2024.
материал rmj.ru
