Содержание статьи
Введение
Глаукома — одна из главных причин слепоты во всем мире, диагностирование этого заболевания на его начальной стадии является довольно сложной задачей. На долю первичной открытоугольной глаукомы (ПОУГ) приходится около 90% всех случаев заболевания. Повышенное внутриглазное давление (ВГД) рассматривают как основной фактор риска развития и прогрессирования ПОУГ [1, 2]. Однако данный параметр не позволяет в полной мере объяснить этиологию заболевания и проводить успешную раннюю диагностику, поэтому ведется поиск предикторов развития ПОУГ среди факторов, которые изменены у пациентов с данной патологией. Фактор некроза опухоли α (TNF-α) — один из таких предикторов, повышенный уровень которого выявляется в крови у пациентов с ПОУГ [3]. Ряд исследований [4, 5] убедительно свидетельствуют в пользу участия этого мультифункционального провоспалительного цитокина в этиологии глаукомы. Показано, что ишемические глиальные клетки при повышенном ВГД увеличивают продукцию TNF-α и способствуют апоптозу ганглиозных клеток сетчатки. Выявлено несколько функциональных полиморфизмов в промоторной области гена TNF-α, связанных с изменением уровня его транскрипции. Так, транзиция TNF-α (rs1800629) может изменять транскрипцию в 6–7 раз [6]. Предположительно точечные замены в области регуляторного региона гена могут быть ассоциированы с риском развития ПОУГ [7, 8]. Однако в различных популяционных группах выявленная ассоциированность носит неоднозначный характер.
Цель исследования: анализ полиморфизма 3 позиций промоторного региона гена TNF-α (rs361525, rs1800629, rs1800630) и их комплексов у проживающих в Западной Сибири пациентов европеоидного происхождения, страдающих ПОУГ, и у здоровых добровольцев.
Материал и методы
В исследование включен 401 пациент. Основную группу составили 99 пациентов, которым в Новосибирском филиале ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России был выставлен диагноз «II стадия ПОУГ». Диагноз выставлялся на основании результатов клинико-офтальмологического обследования (проведение бинокулярной офтальмоскопии, сферопериметрии, эхоофтальмографии, оптической когерентной томографии, тонометрии и исследование остроты зрения). Основным критерием включения в контрольную группу (302 пациента) было отсутствие у обследованных лиц признаков и диагноза ПОУГ. Критериями исключения пациентов из исследования было наличие ряда офтальмологических заболеваний (воспалительные заболевания глаз, непролиферативная или пролиферативная диабетическая ретинопатия, любые, кроме ПОУГ, виды глаукомы, увеит, возрастная макулярная дистрофия сетчатки, кератоконус), а также аутоиммунных и опухолевых процессов, сахарного диабета любого типа. Исследование было одобрено комитетом по биомедицинской этике Новосибирского филиала ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России и локальным этическим комитетом НИИКиЭЛ — филиала ИЦиГ СО РАН.
Исследовали однонуклеотидный полиморфизм (SNP — single nucleotide polymorphism) промоторного региона гена TNF-α-863 C>A, TNF-α-308 G>A, TNF-α-238 G>A. Генотипирование осуществляли методом рестриктного анализа продуктов амплификации (RFLP — restriction fragment length polymorphism). Участки промоторного региона генов амплифицировали с использованием пары специфичных праймеров, затем продукты амплификации подвергали гидролизу эндонуклеазами рестрикции («СибЭнзим», Новосибирск) (табл. 1). Электрофорез проводили в 2,5% агарозном геле.

При статистическом анализе результатов исследования использовали такие показатели, как частота встречаемости генотипов, отношение шансов (ОШ) с расчетом 95% доверительного интервала (95% ДИ). Расчет величины ОШ проводили по методу Вульфа — Холдейна. Уровень значимости (р) различий частот распределения изучаемых признаков в альтернативных группах определяли по двустороннему точному критерию Фишера для четырехпольных таблиц. Использовали пакет программ SPSS 23.
Результаты исследования
В основную группу вошли 99 пациентов с диагнозом ПОУГ, из них 47 (47,5%) женщин и 52 (52,5%) мужчины, средний возраст пациентов составил 62,8±4,3 года. В контрольную группу вошли 302 пациента — 207 (68,5%) женщин и 95 (31,5%) мужчин, средний возраст составил 53,5±5,1 года.
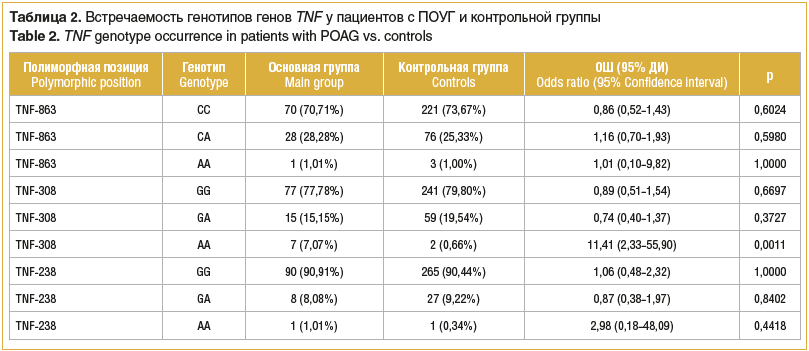
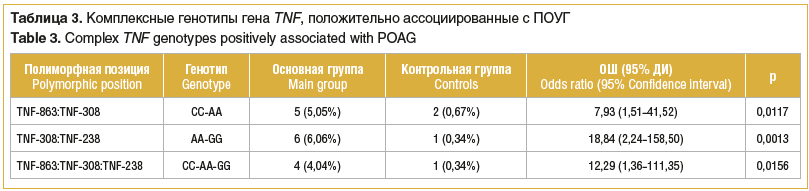
Нами исследовался полиморфизм регуляторного региона гена TNF-α в 3 полиморфных позициях у пациентов с ПОУГ и у пациентов контрольной группы. Минорный генотип TNF-α-308*АА достоверно чаще встречался в основной группе (ОШ 11,41, p=0,0011). При этом встречаемость редкого генотипа у пациентов с ПОУГ более чем семикратно превышает частоту данного генотипа в контрольной группе. Частоты генотипов двух других анализируемых позиций между группами статистически значимо не различались (табл. 2). Было выявлено 3 комплексных генотипа промоторного региона гена, положительно ассоциированных с заболеванием TNF-863*CC:TNF-308*AA, TNF-308*AA:TNF-238*GG и TNF-863*CC:TNF-308*AA:TNF-238*GG (табл. 3). При этом величина ОШ развития ПОУГ в 2 из 3 комплексов значительно выше данной величины для генотипа TNFА-308*АА (ОШ 7,93, p=0,0117; ОШ 18,84, p=0,0013; ОШ 12,29, p=0,0156 соответственно). Стоит отметить, что нами не выявлено единичных полиморфизмов и комплексов, негативно ассоциированных с данной патологией.
Обсуждение
Большое количество данных [9–11], полученных в результате клинических и экспериментальных исследований, убедительно свидетельствуют об участии иммунной системы в развитии глаукомы. При этом описываются одновременно как нейропротективная, так и нейродеструктивная роль иммунной системы. Опосредованный Т-клетками иммунный ответ первоначально может играть положительную роль, препятствуя нейродегенерации (как вариант: ограничивая зону нейрогенерации), однако в ряде случаев может запускать аутоиммунный нейродегенеративный процесс у пациентов с глаукомой. Подтверждением этого предположения является повышение уровня TNF-α в водянистой влаге глаза у пациентов с глаукомой, коррелирующее с отмиранием ганглиозных клеток сетчатки. В связи с этим интенсивно исследуется полиморфизм регуляторного региона данного гена. Интерес вызван тем, что, несмотря на неоднозначность представленных в литературе данных, генетический полиморфизм может влиять на связывание факторов транскрипции, контролируя активность промотора и, как следствие, уровни мРНК и белка [12, 13]. Большинством исследователей [7, 8, 14] показана ассоциированность полиморфизма данного гена с развитием глаукомы, причем чаще выявляются TNF-α-308*А аллельного варианта гена и TNF-α-308*АA генотипа у пациентов с ПОУГ. В ряде метаанализов [13, 14] подтверждается как связь полиморфизма TNF-α-308*А с риском развития ПОУГ при повышенном ВГД, так и наличие более высоких уровней TNF-α у пациентов с данной патологией по сравнению с контрольной группой. Однако, как отмечают авторы, требуются дальнейшие исследования для пациентов с нормотензивной глаукомой. Нами получены аналогичные результаты для пациентов, проживающих в Западной Сибири, свидетельствующие о положительной ассоциированности минорного генотипа с развитием ПОУГ. При этом встречаемость редкого генотипа у пациентов с глаукомой достигает 7%, в то время как в контрольной группе частота данного генотипа составляла менее 1%. Согласно данным, представленным в международной базе данных allelefrequencies.net [15], частота минорного генотипа в европеоидной популяции России составляет 0,9%. Подобное распределение получено и нами ранее при популяционном исследовании европеоидов Западной Сибири, в котором частота минорного аллеля составила 1,02% [16], что позволяет считать величину частоты распределения аллельного варианта TNF-α-308*А около 1% нормативной для европеоидной популяции жителей России.
Следует, однако, отметить, что в литературе представлены данные [17], свидетельствующие как об отсутствии связи полиморфизма в данной позиции с развитием заболевания, так и о наличии негативной ассоциированности данного генотипа с патологией [18]. На наш взгляд, противоречивые результаты могут быть связаны с такими факторами, как размер выборки исследования, этническая принадлежность обследованных лиц, с активностью других молекул, взаимодействующих с промоторной областью гена. Кроме того, патогенез ПОУГ сложен и генетически неоднороден, поэтому на результаты генетических исследований, несомненно, может влиять тип открытоугольной глаукомы. Связь двух других полиморфных позиций промоторного региона гена с ПОУГ нами не выявлена, что также согласуется с большинством представленных в международной литературе данных [19].
Более продуктивный подход к поиску ассоциированности с патологией — это проведение комплексного анализа нескольких полиморфных позиций промоторного региона гена, влияющих на его транскрипционную активность. Нами выявлено 3 комплекса, положительно ассоциированных с ПОУГ, причем в составе всех комплексов присутствует минорный генотип TNF-308*АА. Генотипы двух других анализируемых нами позиций, входящие в состав комплексов, — это генотипы дикого типа. Что интересно, величина отношения шансов развития заболевания в комплексах, содержащих полиморфную позицию TNF-238 G>A, выше, чем данная величина моногенотипа TNF-308*АА, хотя непосредственной связи TNF-238 G>A полиморфизма с ПОУГ в данном исследовании нами не установлено. В ряде сообщений [12, 20] продемонстрировано, что промотор гена TNF может быть метилирован и это оказывает влияние на его функцию. Показано, что в позициях TNF-238 и TNF-244 регуляторного региона расположены последние метилированные CpG-динуклеотиды перед обычно неметилированным промотором, и полиморфизм этих сайтов может влиять на границы метилирования промотора. Можно предположить, что аберрантное метилирование может играть роль в нарушении регуляции TNF-α, а эпигенетический контроль регуляции гена в данной позиции оказывает влияние на риск развития болезни. Однако на сегодняшний день этот аспект мало изучен и требует дальнейшего анализа.
Заключение
В настоящем исследовании проведен анализ полиморфизма 3 позиций промоторного региона гена TNF-α (rs361525, rs1800629, rs1800630) и их комплексов у пациентов с установленным диагнозом ПОУГ, проживающих в Западной Сибири, и у здоровых добровольцев. Нами была выявлена ассоциированность TNF-308*АА минорного генотипа с изучаемым заболеванием. Два других анализируемых нами полиморфных варианта гена не являются факторами риска развития этого сложного многофакторного заболевания, однако для них выявлена ассоциированность с ПОУГ в составе комплексных генотипов. В составе трех изучаемых комплексов присутствует минорный генотип. Все вышесказанное подтверждает необходимость при анализе «случай — контроль» учитывать возможные полиморфные взаимодействия в регуляторной области гена.
Сведения об авторах:
1Шевченко Алла Владимировна — д.б.н., ведущий научный сотрудник лаборатории клинической иммуногенетики; ORCID iD 0000-0001-5898-950X.
1Прокофьев Виктор Федорович — к.м.н., ведущий научный сотрудник лаборатории клинической иммуногенетики; ORCID iD 0000-0001-7290-1631.
1Коненков Владимир Иосифович— д.м.н., профессор, академик РАН, руководитель лаборатории клинической иммуногенетики; ORCID iD 0000-0001-7385-6270.
2Еремина Алена Викторовна— к.м.н., научный сотрудник; ORCID iD 0000-0002-6913-0925.
2Трунов Александр Николаевич — д.м.н., профессор, руководитель научного отдела; ORCID iD 0000-0002-7592-8984.
2Черных Валерий Вячеславович— д.м.н., профессор, директор; ORCID iD 0000-0002-7623-3359.
1НИИКиЭЛ — филиал ФГБНУ ИЦиГ СО РАН. 630060, Россия, г. Новосибирск, ул. Тимакова, д. 2.
2Новосибирский филиал ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России. 630096, Россия, г. Новосибирск, ул. Колхидская, д. 10.
Контактная информация: Шевченко Алла Владимировна, e-mail: shalla64@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 18.09.2021.
About the authors:
1Alla V. Shevchenko — Dr. Sc. (Biol.), leading researcher of the Laboratory of Clinical Immunogenetics; ORCID iD 0000-0001-5898-950X.
1Viktor F. Prokof’ev — C. Sc. (Med.), leading researcher of the Laboratory of Clinical Immunogenetics; ORCID iD 0000-0001-7290-1631.
1Vladimir I. Kononenkov — Dr. Sc. (Med.), Professor, Full Member of the RAS, Head of the Laboratory of Clinical Immunogenetics; ORCID iD 0000-0001-7385-6270.
2Alena V. Eremina — C. Sc. (Med.), researcher; ORCID iD 0000-0002-6913-0925.
2Aleksandr N. Trunov — Dr. Sc. (Med.), Professor, Head of the Scientific Division; ORCID iD 0000-0002-7592-8984.
2Valeriy V. Chernykh — Dr. Sc. (Med.), Professor, Director; ORCID iD 0000-0002-7623-3359.
1Research Institute of Clinical and Experimetal Lymphology — Branch of the Federal Research Center Institute of Cytology and Genetics of the Siberian Branch of the RAS, 2, Timakov str., Novosibirsk, 630060, Russian Federation.
2Novosibirsk Branch of the S. Fyodorov Eye Microsurgery Federal State Institution, 10, Kolkhidskaya str., Novosibirsk, 630096, Russian Federation.
Contact information: Alla V. Shevchenko, e-mail: shalla64@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 18.09.2021.
.
материал rmj.ru
