Введение
Вторичная глаукома (ВГ), несмотря на ее меньшую распространенность по сравнению с первичной глаукомой, представляет собой серьезную медико-социальную проблему. Это обусловлено, прежде всего, тяжестью течения патологического процесса, резистентностью к медикаментозному и хирургическому лечению, а также крайне неблагоприятным функциональным прогнозом. Длительное время проявления ВГ могут находиться в тени клинической картины основного заболевания, что обусловливает позднюю диагностику глаукомы, зачастую в поздней или терминальной стадии, на фоне необратимой утраты зрительных функций или стойкого болевого синдрома. ВГ может развиться на фоне целого ряда офтальмологических и системных заболеваний. В нашей стране принята этиологическая классификация ВГ, предложенная Е.А. Егоровым в 2016 г. [1]. Несмотря на простоту восприятия и патогенетическую обоснованность, данная классификация не лишена недостатков. В частности, в ней отсутствует группа ятрогенных глауком, выделяемая Европейским глаукомным обществом и представленная медикаментозно-индуцированной глаукомой, а также ВГ вследствие хирургического или лазерного вмешательства [2]. Необходимо отметить, что в зарубежной литературе к ВГ относят также псевдоэксфолиативную и пигментную глаукому, которые в нашей стране принято считать разновидностями первичной открытоугольной глаукомы (ПОУГ) [3]. Указанные различия в терминологии и классификациях не позволяют экстраполировать общемировые данные о распространенности ВГ и связанной с ней слепоты на Российскую Федерацию, что подчеркивает актуальность проведения отечественных эпидемиологических исследований.
Вместе с тем классические работы, посвященные эпидемиологии глаукомы в РФ, основываются на данных итоговых статистических отчетов, предоставляемых офтальмологами первичного звена. В подобных отчетах ВГ не выделена в самостоятельную нозологию, а является частью общей картины заболеваемости глаукомой в данном регионе и в целом по стране. Единственным источником сведений о распространенности различных форм ВГ в нашей стране служат оригинальные клинические исследования. В большинстве случаев эти сведения носят разрозненный и субъективный характер, что объясняет необходимость систематизации данных в рамках настоящего обзора [4, 5].
Таким образом, целью данного обзора стало проведение системного анализа доступных отечественных данных о клинико-эпидемиологических особенностях ВГ, выявление ее структурных характеристик, а также определение наиболее значимых этиологических факторов и факторов риска.
По поисковому запросу «вторичная глаукома» в электронной базе данных ООО «Научная электронная библиотека» (elibrary.ru) было найдено 378 печатных работ в журналах, 26 патентов и 45 статей в сборниках конференций, опубликованных с 2013 по 2023 г. Несмотря на обилие работ, фундаментальные исследования, посвященные эпидемиологии ВГ, в нашей стране отсутствуют. Большинство публикаций посвящены хирургическому лечению различных форм ВГ. Для изучения структуры заболеваемости ВГ и ее клинико-эпидемиологических характеристик нами были отобраны только те работы, которые соответствовали следующим критериям: в публикации должно быть указано количество пациентов (глаз) с конкретной формой ВГ, причина ее развития, средний возраст пациентов и распределение по полу.
Содержание статьи
Структура заболеваемости
Среди отобранных нами отечественных работ структура заболеваемости ВГ была изучена в двух исследованиях.
В исследовании С.Л. Кузнецова и соавт. [6] проведен ретроспективный анализ медицинских карт 2927 пациентов, прооперированных по поводу глаукомы с 2008 по 2012 г. ВГ была диагностирована у 212 (7,2%) пациентов (средний возраст 62,2±13,1 года, 128 мужчин), среди которых у 101 (47,6%) пациента оказалась факогенная глаукома, у 58 (27,4%) — неоваскулярная, у 32 (15,1%) — травматическая, у 19 (9,0%) — увеальная, у 2 (0,9%) — неопластическая глаукома.
В работе М.М. Бикбова и соавт. [7] проанализированы результаты имплантации клапана Ahmed (New World Medical Inc., США) у 116 пациентов (121 глаз) с рефрактерной глаукомой (средний возраст 62,71±14,25 года, 67 мужчин). ВГ диагностирована в 71 (58,68%) случае, среди которых в 21 (17,4%) случае это была неоваскулярная глаукома, в 25 (20,6%) случаях глаукома развилась на фоне афакии и артифакии, в 10 (8,4%) случаях диагностирована увеальная глаукома, в 8 (6,7%) — травматическая, в 5 (4%) случаях глаукома возникла после витрэктомии и в 2 (1,6%) — после сквозной кератопластики.
Если сравнить данные результаты с зарубежными работами, например с ретроспективными исследованиями S. Dubey et al. [8] и K.S. Praveen et al. [9], то можно проследить определенную корреляцию между количеством отдельных нозологических групп ВГ в отечественной и зарубежной литературе. Это свидетельствует о примерно одинаковой заболеваемости в различных регионах. На основании анализа литературы можно отметить, что неоваскулярная и факогенная глаукомы наиболее часто встречаются в клинической практике как в России, так и за рубежом. При этом средний возраст пациентов с ВГ варьирует от 49,6 до 62,7 года, что значительно ниже, чем при ПОУГ, для которой характерна манифестация после 65 лет (см. таблицу).
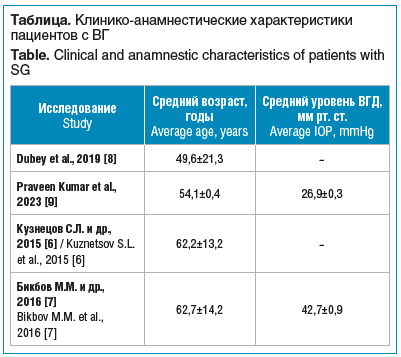
Это подтверждает гипотезу о более раннем развитии и агрессивном течении ВГ. Уровень внутриглазного давления (ВГД) также демонстрирует тенденцию к более высоким значениям по сравнению с таковым при ПОУГ, что требует более активной и, зачастую, хирургической тактики лечения. Полученные данные подчеркивают необходимость дальнейшего изучения и стандартизации подходов к ведению пациентов с ВГ.
Воспалительная глаукома
Увеальная глаукома
Особенности увеальной глаукомы как осложнения воспалительных заболеваний глаза были подробно изучены в ряде отечественных и зарубежных исследований, охватывающих как взрослых, так и детей. С учетом разнообразия этиологических факторов, форм увеита и патогенетических механизмов повышения ВГД, данный тип глаукомы представляет особую сложность в диагностике и лечении.
Увеиты — гетерогенная группа воспалительных заболеваний сосудистой оболочки глаза, характеризующаяся длительным, преимущественно хроническим рецидивирующим течением. По данным отечественных авторов, на долю увеитов приходится от 5 до 15% всех заболеваний органа зрения [10]. Многолетнее рецидивирующее течение заболевания обусловливает высокую частоту развития осложнений, которая достигает 40,8% при увеитах ревматоидной этиологии. Одно из наиболее серьезных осложнений увеита — ВГ, которая может развиваться как на фоне острого воспаления, так и при хроническом вялотекущем процессе даже в период ремиссии, в срок от 1 года до 6 лет от момента последнего обострения заболевания [11].
В своем исследовании Е.А. Дроздова и др. [12] проанализировали частоту развития и клинические особенности осложнений увеитов ревматоидной этиологии у 382 пациентов (553 глаза) за 10-летний период (возраст пациентов варьировал от 14 до 73 лет, средний возраст 36,86±14,04 года, 247 (64,67%) мужчин, что почти в 2 раза превышало количество женщин). У трети (33,8%) пациентов заболевание диагностировано впервые, остальные наблюдались по поводу хронического рецидивирующего увеита. ВГ диагностирована в 58 (10,5%) случаях, из них двустороннее поражение — у 4 пациентов. В подавляющем большинстве случаев ВГ развилась на фоне переднего увеита (65,51%) и панувеита (31,03%) и лишь в 2 (3,46%) случаях — на фоне промежуточного увеита. У 25 (43,1%) пациентов ВГД повысилось уже при первой атаке увеита, в остальных случаях — при рецидивах заболевания. Интерес представляет тот факт, что повышение ВГД было зарегистрировано преимущественно вне фазы активного воспаления, спустя от 1 года до 6 лет после последнего клинического проявления увеита, что подчеркивает необходимость длительного диспансерного наблюдения этой группы пациентов. Уровень ВГД при этом варьировал от 28 до 50 мм рт. ст., составив в среднем 31,4±4,3 мм рт. ст. Диагноз ВГ устанавливали при наличии характерной офтальмогипертензии в сочетании с изменениями диска зрительного нерва (ДЗН) и типичными дефектами полей зрения, подтвержденными периметрией. Подавляющее большинство (77,6%) случаев относилось к вторичной закрытоугольной глаукоме, основными механизмами которой являлись: множественные гониосинехии (14 случаев), фиброваскулярные мембраны (6 случаев), плоскостное сращение трабекулярной зоны с корнем радужки (8 случаев) и неоваскуляризация угла передней камеры (6 случаев). Хотя неоваскуляризация и образование фиброзных мембран могут сочетаться, в ряде случаев эти процессы наблюдались как самостоятельные патогенетические механизмы. Кроме того, у 11 пациентов имел место зрачковый блок, обусловленный тотальной окклюзией зрачка (8 случаев) или набухающей катарактой (3 случая), в 1 случае — по типу злокачественной глаукомы. Вторичная открытоугольная глаукома была диагностирована у 7 (12%) пациентов, преимущественно в исходе длительного поствоспалительного ремоделирования угла передней камеры [12].
В работе О.Г. Ионовой и соавт. [13] были изучены данные медицинских карт 146 пациентов (152 глаза) с туберкулезным увеитом. Возраст пациентов исследуемой группы варьировал от 26 до 60 лет, составив в среднем 46,5 года. Количество женщин (105 (72%) человек) вдвое превышало количество мужчин. Подавляющее большинство пациентов (85%) были госпитализированы в активной стадии туберкулезного увеита, 15% — в неактивной стадии, с жалобами на прогрессирующее снижение зрения и постоянные или периодические боли в глазу. Стойкое повышение ВГД выявлено у 24 (16,4%) пациентов. Сроки развития ВГ в активной стадии туберкулезного увеита составили в среднем 2,5 мес. от начала заболевания, в неактивной стадии — от 4 до 6 лет. В 79% случаев ВГ развилась на фоне переднего увеита или кератоувеита, в 21% случаев — на фоне генерализованного увеита. Основными причинами нарушения оттока внутриглазной жидкости стали задние и передние синехии, выявленные у 9 (37,5%) пациентов, гониосинехии — у 7 (29,2%) и зрачковый блок — у 6 (25%) пациентов. В ряде случаев (у 16 (11%) пациентов) авторы наблюдали транзиторное повышение ВГД (до 28 мм рт. ст.) пораженного глаза без характерных для глаукомы изменений ДЗН и поля зрения. Причиной транзиторной офтальмогипертензии стал реактивный отек трабекулы и отложение экссудата в углу передней камеры. Во всех случаях эпизод офтальмогипертензии был купирован на фоне как гипотензивной терапии, так и противотуберкулезной, противовоспалительной и осмотерапии [13].
Стоит отметить, что ВГ является одним из наиболее частых и тяжелых осложнений увеитов, приводящим к слепоте и слабовидению у детей. По данным Л.А. Катаргиной и соавт. [14], ВГ развивается в 15–20% случаев увеитов у пациентов детского возраста. Важно понимать, что хроническое течение увеита с развитием необратимых изменений структур дренажной зоны и стойкого нарушения гидродинамики обусловливает необходимость продолжения диспансерного наблюдения таких пациентов и после достижения ими совершеннолетия.
Проблемы вторичной офтальмогипертензии и глаукомы у детей изучали Е.А. Дроздова и соавт. [15]. Среди 60 детей (36 девочек и 24 мальчика) в среднем возрасте 9,1±3,1 года с передним увеитом на фоне ювенильного идиопатического артрита повышение ВГД было выявлено у 11 (18,3%) пациентов. В большинстве случаев (80%) офтальмогипертензия была диагностирована в фазу активного воспаления, реже — в период ремиссии. У 3 (27,2%) детей повышение ВГД было отмечено уже при первом эпизоде увеита, в остальных случаях — при повторных проявлениях заболевания. Уровень ВГД варьировал от 24 до 32 мм рт. ст., составив в среднем 27,5±4 мм рт. ст. При этом у 4 (36,4%) детей повышение офтальмотонуса носило транзиторный характер, а у 7 (63,6%) детей была диагностирована ВГ. Основными причинами нарушения оттока внутриглазной жидкости стала окклюзия и секклюзия зрачка (8 детей), зрачковая мембрана (3 детей) и наличие экссудата в передней камере (1 ребенок) [15].
В свою очередь Л.А. Катаргина и соавт. [16] наблюдали 11 детей (8 девочек и 3 мальчика) в возрасте от 4 до 15 лет (в среднем 11,1±0,9 года), прооперированных по поводу увеальной глаукомы. У большинства детей (n=9) ВГ развилась на фоне переднего увеита, по 1 случаю — на фоне периферического увеита и панувеита. У 5 детей была установлена взаимосвязь увеита с ювенильным идиопатическим артритом, в остальных случаях причину воспалительного процесса в глазу выявить не удалось. На момент проведения хирургического вмешательства у 9 детей увеит был в стадии ремиссии, в 2 случаях сохранялась субклиническая активность воспалительного процесса. Уровень ВГД до операции варьировал от 25 до 43 мм рт. ст., составив в среднем 30,1±2,1 мм рт. ст. [16].
Редкие формы воспалительных глауком
В статье И.С. Ганноченко [17] представлено клиническое наблюдение синдрома Познера — Шлоссмана у пациента 50 лет, который обратился с жалобами на внезапно возникшие одностороннее затуманивание зрения и дискомфорт в левом глазу. Характерными особенностями глаукомоциклитического криза автор называет внезапность возникновения жалоб, отсутствие выраженного болевого синдрома, значительное повышение ВГД (до 65 мм рт. ст.), наличие перикорнеальной инъекции и преципитатов на эндотелии роговицы, свидетельствующих о роли увеопатии в патогенезе криза. Механизм повышения офтальмотонуса предположительно — трабекулярная ретенция оттока внутриглазной жидкости за счет аллергического отека трабекулярной сети, а также гиперсекреция водянистой влаги на фоне отека цилиарного тела. Стоит отметить, что глаукомоциклитический криз был полностью купирован в течение 7 дней на фоне инстилляций 0,1% раствора дексаметазона и фиксированной комбинации 1% раствора бринзоламида и 0,5% раствора тимолола [17].
В работе А.Д. Чупрова и соавт. [18] описано клиническое наблюдение пациентки 49 лет с двусторонней ВГ на фоне прогрессирования эссенциальной мезодермальной атрофии радужки. Объективный осмотр выявил значительное истончение переднего листка радужки обоих глаз с образованием несквозных дефектов стромы и деформацией зрачка. При гониоскопии практически во всех секторах угла передней камеры обнаружены периферические передние синехии, а на некоторых участках — мембраноподобная ткань, покрывающая трабекулу и переднюю поверхность радужки. ВГД на фоне гипотензивной терапии было в пределах 23–29 мм рт. ст. на правом глазу и 24–34 мм рт. ст. на левом глазу. Ввиду недостаточной эффективности местной гипотензивной терапии пациентке было проведено хирургическое вмешательство [18].
Таким образом, увеальная ВГ представляет собой одно из наиболее частых и тяжелых осложнений хронических увеитов различной этиологии, включая ревматоидные, инфекционные и аутоиммунные формы. Анализ литературы показывает, что развитие ВГ связано как с активной фазой воспаления, так и с последствиями длительного ремоделирования структур угла передней камеры. Основными патогенетическими механизмами выступают формирование синехий, фиброваскулярная облитерация трабекулярной сети и развитие зрачкового блока. Данные о частоте возникновения увеальной глаукомы варьируют в зависимости от возраста пациентов, характера увеита и сроков наблюдения, что подчеркивает необходимость длительного диспансерного наблюдения и проведения своевременного гипотензивного лечения.
Сосудистая глаукома
Неоваскулярная глаукома
Неоваскулярная глаукома представляет собой одну из наиболее тяжелых и резистентных к лечению форм ВГ. Для нее характерны высокое ВГД, выраженный болевой синдром и торпидное течение патологического процесса, что приводит не только к полной утрате зрительных функций, но и в ряде случаев к потере глаза [19]. Среди причин развития неоваскулярной глаукомы лидируют диабетическая пролиферативная ретинопатия и ишемическая форма окклюзии центральной вены сетчатки. Реже неоваскуляризация переднего сегмента глаза развивается на фоне окклюзии центральной артерии сетчатки, при поражении каротидных артерий, а также при других, более редких, заболеваниях [20]. Вне зависимости от этиологии ведущее звено патогенеза неоваскулярной глаукомы — ишемия сетчатки, запускающая продукцию ангиогенных факторов, которые стимулируют рост новообразованных сосудов сетчатки и радужной оболочки. Дальнейшее прогрессирование неоваскуляризации радужки сопровождается врастанием новообразованных сосудов в структуры угла передней камеры глаза. Растущая поверх трабекулы фиброваскулярная мембрана препятствует оттоку внутриглазной жидкости, что приводит к подъему ВГД и развитию открытоугольной стадии неоваскулярной глаукомы. В дальнейшем сокращение фиброваскулярной мембраны приводит к формированию передних периферических синехий и закрытию угла передней камеры [3].
По данным Т.Е. Липаткиной и соавт. [21], среди 1222 пациентов с артериальной гипертензией и ретинальной венозной окклюзией неоваскулярная глаукома была диагностирована в 8% случаев, преимущественно у лиц старше 60 лет (в среднем 67±5,3 года). При этом женщины (n=63) страдали глаукомой почти вдвое чаще, чем мужчины (n=35). Срок развития ВГ варьировал от 6 мес. до 5 лет с момента ретинальной венозной окклюзии. При этом у 33,6% пациентов глаукома развилась в течение первого года, у 23,5% — на втором или третьем году с момента сосудистой катастрофы. У половины пациентов с неоваскулярной глаукомой на фоне окклюзии центральной вены сетчатки наблюдались выраженный болевой синдром и остаточные зрительные функции (на уровне светоощущения) или полная слепота. У 49 пациентов, перенесших окклюзию ветви центральной вены сетчатки, острота зрения сохранялась на уровне 0,02–0,45, составив в среднем 0,2±0,18. Следует отметить, что в исследовании отсутствует информация о наличии у этих пациентов признаков первичной или открытоугольной глаукомы до тромбоза, что ограничивает возможность интерпретации причинно-следственной связи между глаукомой и сосудистой патологией [21].
В свою очередь В.В. Нероев и соавт. [22] представили результаты транссклеральной диодлазерной циклокоагуляции при неоваскулярной глаукоме у 92 пациентов (96 глаз) в возрасте от 21 года до 70 лет. Количество мужчин (n=43) и женщин (n=49) в исследуемой группе было практически равным. У 61 пациента ВГ развилась на фоне пролиферативной диабетической ретинопатии, у 21 пациента — на фоне ишемической формы окклюзии центральной вены сетчатки или ее ветвей, у 10 пациентов — на фоне окклюзирующего ангиита [22]. Следует отметить, что в последнем случае трактовка глаукомы как неоваскулярной требует осторожности, так как, согласно классификации, принятой в отечественной литературе, при увеитах, в том числе аутоиммунной природы, чаще развивается увеальная глаукома, как это представлено в работе Е.А. Дроздовой и соавт. [11]. Тем не менее наличие ишемии и пролиферации сосудов может способствовать формированию именно неоваскулярного компонента.
В исследовании М.А. Полуниной и соавт. представлены результаты хирургического лечения неоваскулярной глаукомы у 56 пациентов (56 глаз) в возрасте от 18 до 89 лет (средний возраст 61 год). Более половины пациентов исследуемой группы составили женщины (64,1%). В 57,1% (32 глаза) случаев неоваскулярная глаукома развилась на фоне диабетической ретинопатии, в 37,5% (21 глаз) — в исходе ретинальной венозной окклюзии и по 1,8% (1 глаз) — на фоне гипертонической ретинопатии, окклюзии центральной артерии сетчатки и ретинопатии недоношенных. У 48,2% (27 глаз) диагностирована терминальная глаукома с выраженным болевым синдромом. Предметное зрение (от счета пальцев на расстоянии 10 см у лица до 0,7) определялось у 53,6% пациентов, свето-ощущение или полное отсутствие зрительных функций — у 46,4% [23].
В своей работе М.М. Бикбов и соавт. [24] оценивали результаты дренажной хирургии неоваскулярной глаукомы у 44 пациентов (44 глаза). Исследуемая группа состояла из 19 мужчин и 25 женщин в возрасте от 40 до 78 лет (в среднем 60,84±1,29 года). Неоваскулярная глаукома развилась на фоне ретинальной венозной окклюзии у 28 пациентов, на фоне пролиферативной диабетической ретинопатии — у 16 [24].
Согласно данным Д.В. Липатова и соавт. [25] неоваскулярная глаукома, ассоциированная с диабетической ретинопатией, развивается преимущественно у лиц старших возрастных групп. Средний возраст пациентов варьировал от 58,5±2,4 до 65,7±3,4 года. В проанализированных когортах преобладали женщины (64,3%), а основным этиологическим фактором был сахарный диабет 2 типа (у 62% пациентов). Среднее ВГД у пациентов достигало 30,2±0,8 мм рт. ст., в отдельных наблюдениях превышало 40 мм рт. ст., что свидетельствует о выраженной офтальмогипертензии и высоком риске необратимых функциональных нарушений. Лечение пациентов с неоваскулярной глаукомой на фоне диабетической ретинопатии, как правило, носит комбинированный характер и включает медикаментозную гипотензивную терапию, лазерную коагуляцию сетчатки, введение анти-VEGF препаратов и применение дренажных хирургических методик [25].
Флебогипертензивная глаукома
Флебогипертензивная глаукома — редкая форма сосудистой ВГ, в основе патогенеза которой лежит стойкое повышение давления в эписклеральных венах.
В статье Е.С. Макаревич и соавт. [26] представлено клиническое наблюдение пациентки 42 лет с односторонней флебогипертензивной глаукомой. Авторы обращают внимание на взаимосвязь между уровнем ВГД и степенью расширения эписклеральных вен. Было установлено, что при одностороннем процессе ВГД повышено в глазу с расширенными эписклеральными сосудами, а при двустороннем процессе ВГД выше в глазу с более выраженным расширением эписклеральных вен в сравнении со вторым глазом [26].
В исследовании И.А. Гндоян и соавт. [27] наблюдались 12 пациентов (24 глаза) в возрасте от 46 до 74 лет с глаукомой на фоне идиопатической гипертензии в эпи-склеральных венах. Женщин было вдвое больше (n=8), чем мужчин (n=4). Характерными признаками флебогипертензивной глаукомы во всех случаях стали: открытый угол передней камеры, наличие крови в шлеммовом канале, а также расширенные, полнокровные и извитые эписклеральные вены. Сосудистые мальформации орбиты и головного мозга были исключены по данным ультразвукового исследования и магнитно-резонансной томографии. У 10 пациентов гипертензия в эписклеральных венах носила семейный характер, у 4 — один из родителей наблюдался по поводу глаукомы [27].
Полученные данные подчеркивают необходимость раннего выявления факторов риска сосудистой патологии сетчатки, своевременной профилактики неоваскулярных изменений и дальнейшего совершенствования лечебных протоколов в группах высокого риска.
Посттравматическая глаукома
Посттравматическая глаукома отличается агрессивным течением, недостаточным ответом на консервативное и хирургическое лечение. Повышение ВГД вследствие травматических повреждений глазного яблока наблюдается у 0,78–6,2% всех офтальмологических пациентов. По мнению авторов Национального руководства по глаукоме [28], на первом месте среди причин повышения ВГД находятся проникающие ранения (22,5%), на втором — контузии глаза (7,65%). Иное соотношение причин описывали Р.А. Гундорова и соавт. [29], считая тупую травму глаза самым частым источником возникновения травматической ВГ. Химические и термические ожоги — на втором месте по частоте таких последствий, как глаукома.
Основной причиной посттравматической глаукомы при проникающих повреждениях глаза и химических ожогах считают вторичное закрытие угла передней камеры периферическими передними синехиями. После тупой травмы глаза глаукома развивается вследствие рецессии угла передней камеры, гифемы и ее последствий, а также повреждений хрусталика [30].
Наличие дефекта радужки и его размер являются значимым фактором, влияющим на выраженность нарушений гидродинамики. Частота ВГ у пациентов с травматической аниридией достигает 35%, гипотония наблюдается в 25% случаев, и только у 40% пациентов ВГД находится в пределах нормальных значений. При полной аниридии и посттравматическом мидриазе глаукома развивается в 2 раза чаще, чем при частичной аниридии. Оптико-реконструктивные операции с имплантацией иридохрусталиковой диафрагмы также могут приводить к ВГ. В работе Н.П. Соболева и соавт. [31] описаны случаи посттравматической глаукомы, развитие которой, по мнению авторов, может быть связано с сохраняющимися фибропластическими процессами, способными приводить к нарушению оттока внутриглазной жидкости за счет прогрессирующего рубцевания. При этом даже спустя годы после травмы отмечались признаки пролиферации фиброзной ткани и формирование новообразованных сосудов, что, вероятно, способствует обструкции интрасклеральных путей.
В представленном Е.А. Дроздовой и соавт. [32] ретроспективном анализе данных пациентов, обратившихся за помощью в офтальмо-травматологический кабинет ГБУЗ «ОКБ № 3» г. Челябинска за 2015–2017 гг., посттравматическая глаукома была выявлена у 76 пациентов — 65 (85,5%) мужчин и 11 (14,5%) женщин, при этом средний возраст пациентов составил 49±12,7 года. Глаукома развивалась вследствие контузии глазного яблока тяжелой степени у 55 (72,3%) пациентов. Причинно-следственные механизмы гипертензии были установлены на основании результатов клинико-инструментального обследования, включая биомикроскопию, гониоскопию, офтальмоскопию и ультразвуковое исследование. Основными причинами повышения ВГД при этом были: травматический мидриаз (16,4%), гемофтальм (25,4%), дислокация хрусталика (7,3% в раннем постравматическом периоде и 30,9% через 3 мес. после травмы). Прободное ранение роговицы и корнеосклеральной области стало причиной ВГ у 21 (27,7%) пациента. В первые сутки после ранения основными причинами гипертензии были тотальный гемофтальм и гифема, повреждение иридоцилиарной зоны, а в более поздние сроки — посттравматический увеит и длительное использование стероидов.
В связи с наличием склеро-конъюнктивальных сращений, рубцов роговицы и дренажной зоны посттравматическая глаукома плохо поддается лечению. Так, посттравматическая глаукома приводит к потере глаза с частотой до 83,4% [29]. В свою очередь А.В. Степанов и др. [33], проведя сравнительный анализ результатов операций, выполненных на 53 глазах у пациентов с посттравматической глаукомой, пришли к выводу, что дренажная хирургия — наиболее перспективное направление в лечении рефрактерной посттравматической глаукомы, а субсклеральная имплантация дренажа Glautex («ХайБиТек», РФ) внушает наибольший оптимизм. Однако сохранение высокого риска неблагоприятного прогноза подчеркивает необходимость ранней диагностики, правильной оценки степени травматизации угла передней камеры и своевременного хирургического вмешательства в случае признаков неконтролируемой офтальмогипертензии.
Факогенная (хрусталик-индуцированная) глаукома
Анализ имеющейся в открытом доступе литературы показал значительное уменьшение количества публикаций по данной проблеме за последнее десятилетие. Возможно, офтальмологи стали реже сталкиваться с факогенной глаукомой в связи с более ранней и качественной хирургией катаракты.
Традиционно к факогенной относят факоморфическую, факотопическую, факолитическую и факоанафилактическую глаукомы. Однако, по мнению М.М. Дронова [34], истинной вторичной факогенной глаукомой стоит считать только факоморфическую и факотопическую. Факолитическую и факоанафилактическую глаукомы, по мнению автора, необходимо рассматривать как увеальные.
По данным О.С. Коноваловой и соавт. [35], факогенная глаукома встречается в 61,1% случаев ВГ. Среди пациентов с ВГ, проходивших лечение в ГБУЗ ТО «ОКБ № 2» г. Тюмени в 2014 г., у 54 развитие заболевания было связано с хрусталиком (51,8% мужчин, средний возраст 55,1±26,8 года) [35].
Таким образом, факогенная глаукома продолжает составлять значительную долю ВГ в клинической практике, особенно среди пациентов с осложненным течением катаракты. Выявление факторов риска позднего обращения и адекватная организация офтальмологической помощи имеют ключевое значение для профилактики развития тяжелых форм хрусталик-индуцированной офтальмогипертензии.
Неопластическая глаукома
Внутриглазные и внутриорбитальные новообразования могут приводить к повышению ВГД и развитию глаукомы. Основными механизмами возникновения неопластической ВГ считают блокаду дренажной зоны опухолью, неоваскуляризацию структур угла передней камеры и переднее смещение иридохрусталиковой диафрагмы. Повышение офтальмотонуса связано с нарушением оттока водянистой влаги через основные дренажные пути глаза. Эти данные подчеркивают важность своевременной диагностики и разработки патогенетически направленных методов лечения неопластической ВГ [36]. Частота нарушений офтальмотонуса при внутриглазных опухолях варьирует от 30 до 55% [37].
Отечественных публикаций, посвященных вопросам неопластической ВГ, немного, чаще всего это описание клинических наблюдений.
В работе Е.Е. Гришина и соавт. [38] были проанализированы 84 истории болезни пациентов с увеальной меланомой. ВГ была выявлена у 27 пациентов (41,9% мужчин, средний возраст 65 лет, 58,1% женщин, средний возраст 61,9 года). Авторы полагают, что повышение ВГД может быть одним из первых проявлений увеальной меланомы. По этой причине пациентам ошибочно устанавливают диагноз «первичная глаукома». Такая диагностическая ошибка приводит к потере времени и ухудшает прогноз.
В исследовании И.Ю. Жерко и соавт. [39] установлена связь между клиническими характеристиками увеальной меланомы, дозовыми параметрами радиохирургии и ВГ. Анализ показал, что ВГ, развившаяся после радиохирургии меланомы хориоидеи, ассоциирована с показателями объема и толщины опухоли. Так, при объеме опухоли <838 мм3 не было зарегистрировано случаев развития ВГ, в то время как при объеме ≥838 мм3 осложнение развилось в 71% случаев. В свою очередь при толщине опухоли <7,6 мм ВГ формировалась лишь в 5% случаев, а при толщине опухоли >7,6 мм — в 72% случаев. Авторы приходят к выводу о необходимости прибегать к комбинированному методу при лечении опухолей объемом >800 мм3.
Развитие ВГ может осложнить течение не только увеальной меланомы, но и более редких опухолей. Так, С.В. Саакян и соавт. [40] описывают ряд клинических наблюдений декомпенсированной ВГ с болевым синдромом на фоне внутриглазной медуллоэпителиомы. За период с 2005 по 2018 г. в отделе офтальмоонкологии и радиологии ФГБУ «НМИЦ ГБ им. Гельмгольца» Минздрава России наблюдались 9 таких пациентов (5 мужчин и 4 женщины) в возрасте от 1 года до 44 лет (15,8±13,5 года). Во всех описываемых случаях поводом для обращения к врачу были яркие клинические проявления ВГ и катаракты. Офтальмоонкология не была заподозрена ни у одного пациента.
Анализ литературы показал, что неопластическая ВГ чаще всего развивается на фоне увеальной меланомы и значительно реже — при других внутриглазных опухолях. Критическим фактором риска служит увеличение объема и толщины опухоли, что требует особого внимания при планировании методов лечения, включая комбинированные хирургические подходы при опухолях >800 мм3. Ошибки в ранней диагностике неопластической глаукомы, когда повышение ВГД ошибочно трактуется как проявление первичной глаукомы, остаются актуальной проблемой, приводящей к задержке специализированной помощи. Полученные данные подчеркивают необходимость повышения настороженности офтальмологов к опухолевой природе ВГ и актуализируют задачи дальнейшей оптимизации методов раннего выявления и лечения данной патологии.
Ятрогенная глаукома
Ятрогенная глаукома — форма ВГ, возникающая в результате медицинского вмешательства. Например, вследствие неудачно выполненной хирургической операции или в результате использования медикаментозных препаратов, назначенных врачом. Вопросы врачебных ошибок крайне редко обсуждаются в литературе, окружены большим количеством психологических, юридических и персональных ограничений, однако рассмотрение всех аспектов ятрогенной глаукомы крайне важно как для врачей, так и для пациентов.
Стероид-индуцированная глаукома
В доступной нам литературе чаще встречаются описания отдельных клинических наблюдений ВГ, вызванной длительным применением глюкокортикостероидов (ГКС).
Развитие офтальмогипертензии связывают со способностью ГКС задерживать жидкость. Нарушение гидродинамики происходит вследствие нарушения ионного баланса, задержки натрия, что приводит к отеку трабекулярной ткани и накоплению продуктов обмена в трабекулах. ГКС также подавляют синтез простагландинов Е2 и F2α, необходимых для регуляции офтальмотонуса. Стероидная глаукома с большей вероятностью может развиться у пациентов с ПОУГ. У 90% пациентов с ПОУГ, получающих гипотензивную терапию, после 4-недельного курса лечения глазными каплями с 0,1% дексаметазоном ВГД повышалось на 6 и более мм рт. ст. Высок риск развития стероидной глаукомы также у пациентов с сахарным диабетом, системными заболеваниями соединительной ткани, синдромом пигментной дисперсии [41].
В работе А.С. Козловой и соавт. [42] описано клиническое наблюдение стероидной глаукомы, развившейся на фоне перорального приема метилпреднизолона у пациента с системной красной волчанкой. Пример наглядно демонстрирует необходимость мультидисциплинарного подхода к различной патологии, требующей назначения стероидных препаратов.
Интересное клиническое наблюдение стероидной глаукомы представлено И.Л. Симаковым и соавт. [43]. ВГ возникла на фоне длительного лечения хронического блефарита кортикостероидными каплями и мазями.
Вторичная глаукома после хирургических вмешательств
Развитие ВГ вследствие различных офтальмохирургических вмешательств как на переднем, так и на заднем отрезке глаза представляет серьезную многогранную проблему. Понимание патогенеза, факторов риска и способов предотвращения этого состояния очень важно для хирургической практики. Разные виды кератопластики, по данным зарубежных авторов, приводят к ВГ с частотой от 6 до 54% [44]. Механизмы формирования ВГ после кератопластических операций включают: длительное применение местных стероидов, послеоперационное воспаление, тугие швы на границе роговица — трансплантат с деформацией угла передней камеры, прямую травму трабекулярной сети и формирование периферических передних синехий. Кератопластика может усугублять течение уже имеющейся глаукомы или способствовать ее развитию. Повышенное ВГД, в свою очередь, является фактором риска отторжения трансплантата роговицы [45, 46]. Медикаментозное лечение такой глаукомы, как правило, неэффективно, в большинстве случаев требуется антиглаукомная операция.
Несколько иной механизм возникновения ВГ после хирургии заднего отрезка глазного яблока. Так, при длительной тампонаде витреальной полости силиконовым маслом нарушение гидродинамики связано с оседанием эмульгированных частиц силикона на структурах трабекулярной зоны. А.В. Сидорова и соавт. [47] обследовали 35 пациентов (19 мужчин, 16 женщин в возрасте от 18 до 73 лет (54,6±17,5 года)) с ВГ после хирургического лечения отслойки сетчатки. Силиконовое масло удалили у всех пациентов в сроки от 1 до 6 мес. после витреоретинального вмешательства, однако полностью освободить переднюю камеру от силиконового масла не представляется возможным. Эмульгированный силикон не только становится причиной формирования ВГ, но и приводит к низкой эффективности антиглаукомных вмешательств. Авторы рекомендуют прибегать в таких случаях к дренажной хирургии с имплантацией мини-шунта Ex-PRESS (Alcon, США), а в случаях обтурации отверстия клапана пузырьками силикона устранять ее с помощью YAG-лазера [47].
А.З. Калентьева и соавт. [48] проанализировали причины и сроки возникновения ВГ у пациентов с эндовитреальной силиконовой тампонадой. За период 2014–2015 гг. под наблюдением были 32 таких пациента (32 глаза). В 25% случаев повышение ВГД диагностировано через 3 мес. после операции, в 16% — в период 3–6 мес., в 28% — в период 6–12 мес. и в 31% случаев — через 1 год и более. По данным авторов, среди причин развития ВГ у пациентов с эндовитреальной силиконовой тампонадой превалирует зрачковый блок (в 31,3% случаев), а длительность пребывания силиконового масла в глазу коррелирует с частотой возникновения ВГ.
Силиконовую глаукому при длительной тампонаде витреальной полости изучали Н.В. Иванова и соавт. [49]. Они наблюдали 38 пациентов (38 глаз) с ВГ после успешной хирургии регматогенной отслойки сетчатки. Средний возраст составил 49,6±7,8 года. Средний срок тампонады составлял 7,6±2,72 мес. После операции по выведению силикона у всех обследуемых пациентов были признаки декомпенсации ВГД, связанной с наличием эмульгированного силикона в камерах глаза. Пациентам выполнялось промывание передней камеры и витреальной полости с антиглаукомным вмешательством.
Анализ литературы показывает, что ятрогенная глаукома развивается в результате как медикаментозного, так и хирургического воздействия на структуры глаза. Стероид-индуцированная ВГ остается одним из наиболее частых вариантов, причем наибольший риск выявлен у пациентов с предрасположенностью к первичной глаукоме и с системными заболеваниями. Хирургические причины включают как передние, так и заднесегментарные вмешательства, где длительная эндовитреальная силиконовая тампонада особенно часто приводит к формированию рефрактерной глаукомы. Эффективность медикаментозной терапии в таких случаях ограничена, что обусловливает необходимость раннего перехода к хирургическим методам контроля ВГД, в том числе с использованием дренажных устройств. Полученные данные подчеркивают важность тщательной стратификации риска перед назначением ГКС или планированием офтальмохирургии, а также своевременного динамического наблюдения пациентов в послеоперационном периоде.
Заключение
Таким образом, многообразие этиологических факторов, отсутствие унифицированной международной классификации и различия в номенклатуре между отечественной и зарубежной школами офтальмологии существенно затрудняют сопоставление данных о распространенности ВГ. Особенно это актуально в условиях, когда ВГ в статистической отчетности РФ не выделяется как самостоятельная нозологическая единица. Получение объективной информации о заболеваемости и структуре ВГ возможно исключительно на основе оригинальных клинических и популяционных исследований.
Изучение эпидемиологических аспектов ВГ представляется научно обоснованным и крайне актуальным с точки зрения клинической практики. Систематизация этих данных позволит обосновать необходимость совершенствования баз данных, оптимизировать алгоритмы ранней диагностики, диспансерного наблюдения, а также актуализировать существующие клинические рекомендации с учетом эпидемиологических реалий.
Сведения об авторах:
Исаков Иван Николаевич — офтальмолог, заведующий офтальмологическим отделением ГАУЗ «НГКБ № 1»; 654041, Россия, г. Новокузнецк, пр-т Бардина, д. 28; ORCID iD 0000-0001-5930-420X
Селезнев Алексей Владимирович — к.м.н., доцент кафедры оториноларингологии и офтальмологии ФГБОУ ВО ИвГМА Минздрава России; 153012, Россия, г. Иваново, пр-т Шереметевский, д. 8; ORCID iD 0000-0002-6321-8109
Корелина Виктория Евгеньевна — к.м.н., офтальмолог, доцент кафедры семейной медицины ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; доцент отдела образовательных программ ФГБУН ИМЧ РАН им. Н.П. Бехтеревой; 197022, Россия, г. Санкт-Петербург, ул. Академика Павлова, д. 12А; ORCID iD 0000-0003-2022-5912
Галимова Айсылу Булатовна — к.м.н., офтальмолог, заведующая офтальмологическим отделением № 2 Всероссийского центра глазной и пластической хирургии ФГБОУ ВО БГМУ Минздрава России; 450075, Россия, г. Уфа, ул. Рихарда Зорге, д. 67/1; ORCID iD 0000-0001-7311-0954
Куроедов Александр Владимирович — д.м.н., заведующий кафедрой офтальмологии им. акад. А.П. Нестерова Института клинической медицины ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; начальник офтальмологического центра (с дневным стационаром) ФКУ «ЦВКГ им. П.В. Мандрыка» Минобороны России; 107014, Россия, г. Москва, ул. Б. Оленья, д. 8А; ORCID iD 0000-0001-9606-0566
Онуфрийчук Олег Николаевич — к.м.н., офтальмолог, нейроофтальмолог ФГБУ НМИЦ детской травматологии и ортопедии им. Г.И. Турнера Минздрава России; 196603, Россия, г. Санкт-Петербург, ул. Парковая, д. 64; ORCID iD 0000-0001-6841-3547
Контактная информация: Исаков Иван Николаевич, е-mail: eyezz@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 13.07.2025.
Поступила после рецензирования 05.08.2025.
Принята в печать 28.08.2025.
About the authors:
Ivan N. Isakov — Ophthalmologist, Head of the Ophthalmological Department of Novokuznetsk Clinical City Hospital No. 1; 28, Bardin ave., Novokuznetsk, 654041, Russian Federation; ORCID iD 0000-0001-5930-420X
Alexey V. Seleznev — C. Sc. (Med.), Assistant Professor of the Department of Otorhinolaryngology and Ophthalmology, Ivanovo State Medical Academy; 8, Sheremetevskiy pass., Ivanovo, 153012, Russian Federation; ORCID iD 0000-0002-6321-8109
Victoria E. Korelina — C. Sc. (Med.), Ophthalmologist, Assistant Professor of the Department of Family Medicine, North-Western State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; Assistant Professor, Department of Educational Programs, N.P. Bekhtereva Institute of the Human Brain; 12а, Academician Pavlov str., St. Petersburg, 197376, Russian Federation; ORCID iD 0000-0003-2022-5912
Aisylu B. Galimova — C. Sc. (Med.), Ophthalmologist, Head of Ophthalmology Department No. 2, Russian Center for Eye and Plastic Surgery, Bashkir State Medical University; 67/1, Sorge str., Ufa, 450075, Russian Federation; ORCID iD 0000-0001-7311-0954
Alexander V. Kuroedov — Dr. Sc. (Med.), Head of the Academician A.P. Nesterov Department of Ophthalmology of the Clinical Medicine Institute, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; Head of the Ophthalmological Center (with a Day Hospital), P.V. Mandryka Military Clinical Hospital; 8A, Bolshaya Olenya str., Moscow, 107014, Russian Federation; ORCID iD 0000-0001-9606-0566
Oleg N. Onufriychuk — C. Sc. (Med.), Ophthalmologist, Neuro-Ophthalmologist of the G.I. Turner National Medical Research Center of Сhildren’s Orthopedics and Trauma Surgery; 64, Parkovaya str., St. Petersburg, 196603, Russian Federation; ORCID iD 0000-0001-6841-3547
Contact information: Ivan N. Isakov, e-mail: eyezz@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 13.07.2025.
Revised 05.08.2025.
Accepted 28.08.2025.
материал rmj.ru
