Введение
В настоящее время глобальные тенденции, характеризующие состояние здоровья человечества, имеют разную направленность. Наряду с увеличением ожидаемой продолжительности жизни, снижением детской смертности неуклонно растет число лиц пожилого и старческого возраста, подверженных развитию множества заболеваний и возраст-ассоциированных состояний. Разработка новейших инновационных методов профилактики и лечения инфекционных заболеваний не только не приводит к снижению их числа, но и сопровождается глобальными пандемиями, уносящими миллионы жизней. Объединяющим распространенным симптомом многих заболеваний, имеющих различное происхождение и патогенез, является астенический синдром (АС). Его развитие связано с ухудшением здоровья, течения и прогноза заболевания, увеличением числа случаев госпитализации, падений в пожилом возрасте, снижением показателей качества жизни [1–4]. В то же время распространенность и выраженность АС можно ограничить, своевременно используя современные эффективные подходы к предупреждению и терапии этого состояния [5].
Единого определения АС (слабости) как патологического состояния не существует. В значительной степени это обусловлено тем, что АС может представлять собой одно из проявлений имеющегося у пациента заболевания, при этом клиническая картина будет определяться сложным комплексом клинических проявлений, меняющихся с течением времени. Нередко АС возникает как ответ организма на повышенные требования внешней среды, не в полной мере соответствующие индивидуальным возможностям. В частности, для лиц, имеющих сменный график работы, особенно связанный с ночными сменами, которые часто приводят к расстройству сна, применимо определение S. Ganesan: «чувство умственного или физического истощения, которое может привести к ухудшению работоспособности, вызванное хроническим или острым недосыпанием, ночной работой, высокой интенсивностью работы» [6, 7]. АС подробно определяется в случае ревматических заболеваний как разноплановое состояние, при котором ухудшается физическое, когнитивное, мотивационное и эмоциональное состояние индивидуума, что приводит к значительному снижению его способности функционировать в привычном режиме [8]. При неврологических заболеваниях, в частности рассеянном склерозе (РС), АС — это выраженное субъективное ощущение усталости, необходимость затрачивать больше усилий для выполнения привычных текущих задач, несоответствие между затраченными усилиями и фактическим результатом, ощущение более раннего наступления истощения. Важно, что указанные симптомы не связаны с приемом лекарственных препаратов, хронической болью, физическим состоянием, анемией, дыхательной недостаточностью, депрессией или нарушением сна [9].
Для диагностики АС у лиц пожилого и старческого возраста используют критерии Фрида (Fried L.P., 2001): низкая сила захвата кисти, быстрая утомляемость, медленная ходьба, низкая физическая активность, непреднамеренная потеря веса. Выявление трех из пяти критериев указывает на наличие АС как на состояние повышенной уязвимости, возникающее вследствие связанного с возрастом снижения резервов и функций многих физиологических систем, снижение или утрату способности справляться с повседневными ситуациями [10, 11]. Ценным диагностическим признаком АС является ограничение возможности осуществлять умственную или физическую деятельность вследствие более быстрого, чем раньше, наступления усталости.
Наряду с трудностями в выполнении повседневных задач усталость влияет на самооценку и поведение. Это могут быть неявные симптомы, но влияющие на адекватную оценку риска, скорость принятия решения, качество выполнения сложных задач, взаимодействие с окружающими, управление эмоциями. Астения влияет на многие аспекты человеческой деятельности. Страдают внимание, память, время реакции, координация, математические способности. Нарушения в когнитивных, поведенческих, физиологических и субъективных областях могут усиливать и профессиональные риски [7, 12]. Длительно существующий АС приводит к изменению эмоционального состояния с повышением риска развития тревожного и/или депрессивного расстройства, что еще в большей степени ограничивает повседневную и профессиональную активность. Следует, однако, принимать во внимание, что зачастую преморбидные особенности личности могут способствовать более быстрому развитию АС у пациентов с соматическими заболеваниями.
Содержание статьи
Основные механизмы патогенеза АС
На сегодняшний день признано, что развитие АС обусловлено нарушением нейроэндокринной регуляции, воспалительными и метаболическими расстройствами [13]. В то же время на развитие слабости и утомляемости значимо влияют психосоциальные факторы (например, психологическое благополучие). Известно, что пациенты с депрессией более подвержены риску развития АС [4, 14]. Слабость, очевидно, связана с когнитивными нарушениями. С одной стороны, слабость увеличивает риск развития когнитивных нарушений, которые, в свою очередь, повышают риск появления АС. Возможно, взаимосвязь снижения когнитивных функций и астении образует некий порочный круг, связанный с процессами старения [15]. В крупном итальянском исследовании, в ходе которого наблюдались более 2,5 тыс. пациентов со старческой астенией, слабость оказалась фактором риска развития сосудистой деменции [16]. В то же время когнитивный тренинг, направленный на улучшение кратковременной памяти и повышение концентрации внимания, приводил к уменьшению выраженности проявлений старческой астении, в частности, участники исследования отмечали повышение силы нижних конечностей. Это не первые доказательства эффективности когнитивной реабилитации в уменьшении слабости и улучшении подвижности пациентов [17]. Следует также отметить, что АС, эмоциональные расстройства и когнитивные нарушения у пожилого человека не всегда причинно связаны между собой, а могут быть следствием процессов естественного старения, изменения социального функционирования (выход на пенсию) или их сочетания с соматическими заболеваниями.
Слабость, усталость в рамках АС также являются основными и наиболее распространенными последствиями COVID-19 [18]. Метаанализ, включивший результаты динамического обследования 47 910 пациентов в возрасте от 17 до 87 лет с периодом наблюдения от 14 до 110 дней, показал, что после перенесенного заболевания симптомы сохраняются у 80% болевших COVID-19. Наиболее частыми из них оказались усталость (58%), головная боль (44%) и расстройство внимания (27%) [19]. По данным других исследований, распространенность усталости составила 53% через 4 нед. после госпитализации [20] или 69% через 3 мес. после выписки из стационара [21]. По данным метаанализа F. Ceban et al. [22], функциональные нарушения, включая трудности с выполнением повседневных задач, самообслуживанием и мобильностью, после перенесенного COVID-19 наблюдались у 21–63% пациентов. Было показано, что доля лиц, испытывающих усталость в течение 12 нед. или более после установления диагноза COVID-19, составила 0,32 (95% ДИ 0,27–0,37; p<0,001; n=25 268; I2=99,1%). Среди пациентов, результаты оценки когнитивных функций которых по Монреальской шкале оценки когнитивных функций (МоСА) составили менее 23 баллов, АС был выявлен у 49,3% (106/215), при значениях по шкале МоСА менее 18 баллов — у 22% (95% ДИ 0,17–0,28; p<0,001; n=13 232; I2=98,0). От 29,0 до 47,4% работающих до заболевания участников исследования не смогли вернуться к прежней деятельности, что, в том числе, было связано с развитием слабости и когнитивных нарушений [22].
В развитии постковидного синдрома и АС как его важного проявления ключевую роль играют нейротоксичность вируса SARS-CoV-2 и нейровоспаление [20]. Вирусная инвазия в нервную систему, которая наблюдается у ряда пациентов, приводит к целому каскаду последствий: дисбалансу дофамина и серотонина, снижению возбудимости нейронов, замедлению проводимости нервного импульса [23]. При обследовании пациентов с постковидным синдромом и АС было установлено поражение ГАМК-ергической системы [24]. Нарушения ГАМК-ергической нейротрансмиссии отмечаются и при других поражениях центральной нервной системы (ЦНС), связанных с развитием АС (РС, боковой амиотрофический склероз). Возможно, что воспалительные цитокины (С-реактивный белок, интерлейкин 6), проникая через гематоэнцефалический барьер, активируют микроглию и астроциты, вызывая высвобождение нейрональных цитокинов и приводя к нейровоспалению и дисбалансу нейротрансмиссии [24]. Дополнительными факторами поражения ЦНС являются замедление проведения нервного импульса при COVID-19 и торможение мотонейронов коры головного мозга, которые также могут усиливать выраженность АС. Поражение вирусом SARS-CoV-2 обонятельной луковицы, богатой дофамином, может ограничивать его поступление в ЦНС и влияние на ее вышележащие отделы, участвуя в развитии ангедонии, снижая мотивацию и провоцируя исполнительную дисфункцию. Дисбаланс медиаторов в ЦНС совместно с нарушением проводимости нервного импульса может вести к формированию астении, тревожного расстройства и депрессии [23]. Расстройства тревожно-депрессивного спектра усугубляют нейромедиаторный дисбаланс, запуская порочный круг, и поддерживают патологическое состояние, следствием которого являются АС и когнитивные нарушения после COVID-19.
Слабость как ведущий симптом в большинстве случаев сопровождает миалгический энцефаломиелит, или синдром хронической усталости (СХУ). Это хроническое неврологическое заболевание, которому часто предшествует инфекция. Патогномоничным симптомом СХУ является развитие усталости, слабости после физической активности, умственного напряжения или сенсорной перегрузки [25]. СХУ связан с поражением нервной и иммунной систем. По мере прогрессирования заболевания ухудшаются познавательные способности, сон, нарастают усталость, болевой синдром, вегетативные нарушения, что подтверждает дисфункцию ЦНС как основу нейропатологического механизма. Вероятно, вирусная инфекция и нарушения иммунного ответа вызывают хроническое системное воспаление, а также нейровоспаление, приводящее к поражению ЦНС [26]. Современные методы нейровизуализации позволяют выявлять структурные и функциональные изменения в головном мозге, подтверждая нейровоспалительную гипотезу заболевания [27].
Избыточная усталость является частой жалобой при сердечно-сосудистых заболеваниях (ССЗ) и нередко — их первым клиническим проявлением. Хотя физическая и умственная усталость при ССЗ часто тесно взаимосвязаны, патофизиологические механизмы этих типов усталости различаются. Физическая усталость может быть связана с нарушением гемодинамики: уменьшением сердечного выброса, затруднением микроциркуляции, а также нейроэндокринной дисфункцией и сопутствующими метаболическими расстройствами. Умственная утомляемость часто сопровождается расстройствами настроения (снижение, неустойчивость) и сниженной мотивацией. Персонализированное и таргетное воздействие на эти нарушения может способствовать купированию проявлений АС и, как следствие, увеличению независимости в повседневной жизни, повышению качества жизни и снижению смертности от ССЗ [28]. Продемонстрирована взаимосвязь между общей слабостью, физической и умственной усталостью, с одной стороны, и ухудшением функции сердечно-сосудистой системы в условиях индуцированного стресса — с другой. Выявленная корреляция не зависела от пола, возраста, образования, тяжести сердечной недостаточности, курения, использования нитратов, симптомов тревоги/депрессии [29]. Усталость, возможно, является предиктором неблагоприятных сердечно-сосудистых событий у пациентов с хронической почечной недостаточностью [30]. АС и депрессия могут быть связаны с системным воспалением и сердечно-сосудистым риском у пациентов с хронической болезнью почек, но патофизиология этого не до конца понятна [31].
Нарушения мозгового кровообращения являются частой причиной АС. Астения может сохраняться в течение многих лет после инсульта. Развитие постинсультного АС ухудшает течение восстановительного периода, ассоциировано со снижением приверженности лечебно-реабилитационным мероприятиям, способствуя развитию осложнений и замедляя восстановление двигательных функций [32]. Наличие АС после перенесенного инсульта нередко тесно связано с формированием когнитивных и депрессивных нарушений, обусловленных как непосредственным поражением головного мозга, так и реакцией на само заболевание.
На основе критериев слабости CHS (Cardiovascular Health Study) было определено, что общая распространенность АС у лиц в возрасте 60 лет и старше за рубежом достигает 12% и увеличивается до 25% среди лиц старше 85 лет. Женщины более подвержены развитию астении, чем мужчины [10].
В Российской Федерации распространенность АС среди пожилого населения составляет от 21,1 до 43,9%, а пре-астении — от 24,7 до 65,5% [33]. По другим данным, распространенность старческой астении составляет от 4,2 до 8,9%, преастении — от 45,8 до 61,3% [34]. До пандемии COVID-19 СХУ поражал до 9 из 1000 пациентов, перенесших инфекцию. В то же время большинство людей, перенесших постковидный синдром, соответствуют диагностическим критериям СХУ. Средняя распространенность СХУ в метаанализе E.J. Lim et al. [35] составила 1,40±1,57% (95% ДИ 0,98–1,82) [35].
Современные подходы к лечению пациентов с АС
Эффективное лечение пациентов с АС требует установления причины его развития, определения роли соматических и неврологических заболеваний в его формировании, исключения проявлений слабости и повышенной утомляемости как следствия истинных психических заболеваний. Сочетание ощущения отсутствия сил, апатии, расстройств аппетита, диссомнии требует исключения психического заболевания и ведения пациента с обязательным участием психиатра или психотерапевта.
Лечение АС направлено на коррекцию основного заболевания, улучшение работоспособности, профилактику недостаточности питания, когнитивного снижения. Достаточная физическая активность связана не только с уменьшением физической слабости, но и с повышением физической работоспособности у лиц с преастенией [36]. Консультирование по вопросам рационального питания необходимо всем пациентам со старческой астенией с акцентом на соблюдение водно-питьевого режима, достаточное потребление белка с пищей для профилактики саркопении, витамина D и его аналогов с целью коррекции его уровня, профилактики падений и переломов, улучшения прогноза жизни. С целью профилактики когнитивных расстройств у пациентов с АС может быть рекомендован когнитивный тренинг, обеспечение пребывания в насыщенной эмоциональными стимулами среде1.
Медикаментозная терапия АС, особенно у пожилых пациентов, имеет ряд ограничений, связанных с опасностью усугубления гериатрических синдромов, в том числе из-за недостаточной оценки антихолинергической нагрузки1. Дополнительный негативный аспект связан с полипрагмазией, что сопровождается более высоким риском возникновения различных проявлений АС у пожилых [37].
В лечении СХУ рекомендованы когнитивно-поведенческая терапия, медикаментозная поддержка [25]. Для лечения постковидной слабости нередко используют протоколы, разработанные для лечения пациентов с СХУ [38]. Препараты для лечения постинсультного АС практически не отражены в клинических руководствах по ведению пациентов с инсультом или имеют низкий уровень доказательности [32].
Появление новых безопасных препаратов, направленных на лечение АС, с учетом общих патогенетических механизмов развития во многом бы решило проблему ведения пациентов с АС при различных соматических и неврологических заболеваниях.
Анализ эффективности препарата Проспекта® при лечении пациентов с АС
Препарат Проспекта® (ООО «НПФ «МАТЕРИА МЕДИКА ХОЛДИНГ»), в состав которого входят аффинно очищенные модифицированные антитела к мозгоспецифическому белку S-100, полученные по градуальной технологии, обладает антиастеническим, ноотропным, мембраностабилизирующим, нейропротективным эффектами2,3.
Наличие значительного числа опубликованных результатов клинических исследований (КИ), посвященных, в том числе, оценке влияния препарата Проспекта® на выраженность различных проявлений АС, позволяет провести метаанализ полученных результатов.
В метаанализ включали исследования, в которых приняли участие пациенты обоих полов от 18 лет и старше с АС, которым был назначен препарат Проспекта® по схеме 1 таблетка 2 р/сут в течение 1 мес. или плацебо по схеме приема исследуемого препарата. Анализ выраженности астении до и после лечения должен был проводиться с помощью валидных методов оценки: шкалы оценки тяжести усталости (Fatigue Assessment Scale, FSS) и субъективной шкалы оценки астении (Multidimensional Fatigue Inventory, MFI-20). В качестве первичной конечной точки оценки эффективности принимали следующие показатели:
долю пациентов, у которых выраженность астении изменилась от тяжелой до легкой степени на фоне терапии препаратом Проспекта® по сравнению с плацебо. Пограничное значение перехода астении из тяжелой формы в легкую по FSS составило 36 баллов, по MFI-20 — 60 баллов;
отношение шансов уменьшения выраженности астении на фоне терапии препаратом Проспекта® по сравнению с плацебо.
Поиск релевантных КИ проводили в базах данных: PubMed (https://www.ncbi.nlm.nih.gov/pubmed), Medline (https://medlineplus.gov), eLIBRARY.ru (https://elibrary.ru/). Поисковые термины: «астения», «астенический синдром», а также синонимы АС: «усталость», «слабость», «утомляемость», «постинфекционная астения», «Проспекта®», «клиническое исследование», «Fatigue Assessment Scale», «FSS», «Multidimensional Fatigue Inventory», «MFI-20».
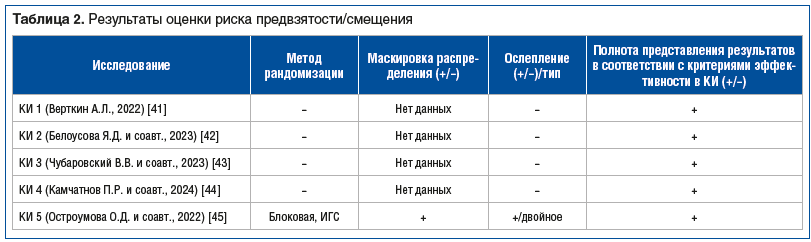
Методологическое качество включенных в метаанализ КИ оценивали с помощью инструмента оценки риска предвзятости/смещения в соответствии с Кокрейновским справочником 5.1 (RoB 2.0 tool) [39]. В соответствии с рекомендациями Кокрейновского сотрудничества рассматривали параметры: размер выборки, протокол вмешательства, результаты, риски предвзятости/смещения. С целью оценки рисков предвзятости/смещения каждого включенного КИ оценивали наличие и метод рандомизации, наличие и тип ослепления, соответствие результатов конечным точкам, полноту представленности результатов, риск предвзятости/смещения в КИ оценивали как низкий, средний, высокий и неопределенный [40].
Статистическая методология. Для представления данных использованы методы описательной статистики. Доли пациентов, у которых отмечено уменьшение выраженности АС, анализировали с помощью точного критерия Фишера. Качественные данные представлены в виде абсолютных и относительных (доля, %) показателей и 95% доверительных интервалов (ДИ) для долей, рассчитанных методом Вальда, отношения шансов и 95% ДИ для них. Непрерывные данные представлены в виде среднего значения, стандартного отклонения.
Результаты метаанализа
По результатам поиска найдено 5 многоцентровых проспективных КИ (табл. 1) [41–45]. Данные по оценке риска предвзятости/смещения в КИ представлены в таблице 2. В КИ 5 [45] были указаны метод рандомизации с помощью интерактивной голосовой системы (ИГС) и маскировка распределения препарата Проспекта® и плацебо. КИ 1–4 [41–44] были открытыми. Во всех КИ результаты представлены в соответствии с заявленной конечной точкой. Риск предвзятости/смещения по рассмотренным критериям оценен как низкий для КИ 5, как неопределенный — для КИ 1–4 в связи с отсутствием детальной информации о рандомизации, маскировке распределения и методе ослепления (см. табл. 2).
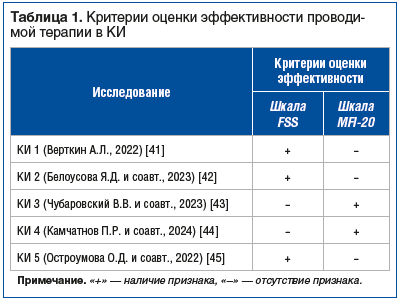
В метаанализ включены сведения 5 КИ с участием 1016 пациентов в возрасте от 18 до 85 лет, из них 670 участников принимали препарат Проспекта® (средний возраст 46,2±12,2 года, 60,4% женщин), 346 — плацебо (средний возраст 42,8±12,6 года, 68,2% женщин). 484 пациента участвовали в исследовании по оценке эффективности препарата в терапии постковидной астении (КИ 1, 5) [41, 45], 54 пациента — в терапии астении на фоне соматических заболеваний (КИ 2) [42], 69 пациентов — в терапии постпсихотической астении (КИ 3) [43], 50 пациентов — в терапии посттравматической астении (КИ 4) [44]. Среди всех пациентов болезни сердечно-сосудистой системы, включая артериальную гипертензию, мерцательную аритмию, атеросклероз и т.д., встречались у 17,8% респондентов, заболевания желудочно-кишечного тракта, включая гастрит, язвенную болезнь желудка и двенадцатиперстной кишки, желчнокаменную болезнь, панкреатит, энтерит и т.д., — у 5,7%, болезни органов дыхания, в том числе бронхиальная астма, бронхит, ларингит и т.д., — у 4,8%. Все исследования были проспективными и многоцентровыми, проведены на территории Российской Федерации. Режим дозирования препарата соответствовал актуальной на момент проведения КИ инструкции по медицинскому применению. Длительность терапии АС препаратом Проспекта® составила 1 мес. в КИ 1–5.
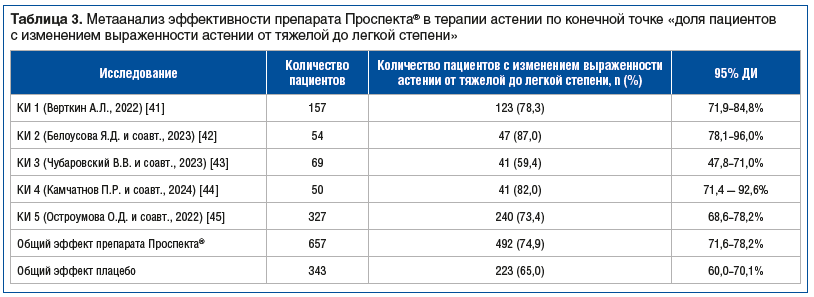
Терапия препаратом Проспекта® способствовала изменению выраженности астении от тяжелой до легкой степени у 74,9% пациентов (против 65,0% пациентов в группе плацебо, р<0,001) (табл. 3). Препарат Проспекта® в 1,6 раза повышает вероятность уменьшения выраженности астении (отношение шансов 1,6232 (95% ДИ 0,4694–0,8274, р=0,0012)). Анализ безопасности препарата Проспекта® при лечении АС у пациентов молодого и среднего возраста продемонстрировал отсутствие влияния препарата на артериальное давление. Не было различий в количестве нежелательных явлений (НЯ) среди пациентов, принимавших препарат Проспекта® (n=52) или плацебо (n=28) (p=0,59). Случаи серьезных НЯ не имели достоверной причинно-следственной связи с применением препарата Проспекта®.
Обсуждение
Лечение астении — важная составляющая терапии различных заболеваний. Широкая распространенность старческой и постинфекционной астении, астении при соматических заболеваниях, ее влияние на их течение и прогноз требуют активного поведенческого и фармакологического вмешательства в тактику ведения таких пациентов.
Применение препарата Проспекта® в 1,6 раза повышало вероятность уменьшения выраженности астении (р=0,0012). В реальной клинической практике это означает, что количество благоприятных исходов лечения астении при приеме препарата Проспекта® будет дополнительно увеличиваться более чем на 60% от результатов базовой терапии.
Антиастенический эффект препарата Проспекта® был доказан в рандомизированном КИ купирования астении у пациентов после COVID-19. У 99% пациентов на фоне приема препарата Проспекта® произошло статистически значимое уменьшение выраженности астении по сравнению с плацебо (р=0,04) [45]. В представленном метаанализе использованы более строгие критерии оценки эффективности — переход в легкую степень тяжести астении. Вместе с тем большинство (74,9%) пациентов при различных психических, соматических и инфекционных заболеваниях смогли достигнуть значимого регресса симптомов астении. Полученные результаты подтверждают общность патогенеза астении при различных заболеваниях, в первую очередь обусловленную активным вовлечением ЦНС в развитие данного патологического состояния. Это также подтверждает преимущество препаратов, влияющих на ЦНС, перед препаратами исключительно нейрометаболического действия, используемыми для лечения пациентов с АС. Так, предположение о связи между низким уровнем карнитина в крови и повышенной утомляемостью не получило достаточных подтверждений того, что применение карнитина приводит к уменьшению выраженности проявлений усталости в различных клинических ситуациях. В Кокрейновском обзоре использования карнитина при РС было отмечено невысокое методологическое качество проведенных исследований. Из отчета неясно, снижает ли добавление карнитина у пациентов с РС усталость [46].
В ранее проведенном анализе безопасности препарата Проспекта® при лечении пациентов в возрасте 60 лет и старше с сосудистыми когнитивными нарушениями было показано отсутствие влияния препарата на витальные функции, в первую очередь на уровень артериального давления. Не было выявлено различий в количестве НЯ среди пациентов, принимавших препарат Проспекта® или плацебо. Случаи серьезных НЯ не имели достоверной причинно-следственной связи с применением препарата Проспекта®. Анализ случаев совместного назначения препарата с лекарственными средствами сопутствующей терапии не выявил неблагоприятных взаимодействий [47]. В исследованиях, вошедших в настоящий метаанализ, безопасность препарата Проспекта® была подтверждена на более широкой популяции, включая молодых больных, пациентов с инфекционными и психическими заболеваниями. Полученные данные по безопасности выгодно отличают препарат Проспекта® от других препаратов, направленных на лечение АС, прием которых сопровождается большим количеством случаев развития НЯ, в том числе с высокой степенью связи с проводимым лечением [48]. В то же время использование ноотропных препаратов у пожилых людей, пациентов с психическими нарушениями может усугублять тревожные расстройства, вызывать нарушения сна, что накладывает ограничения на их назначение данной категории пациентов. Препарат Проспекта® был дополнительно изучен у таких пациентов и показал благоприятный профиль безопасности, что делает его препаратом выбора для лечения астении при различных заболеваниях, ее вызывающих. Присоединение препарата Проспекта® к терапии артериальной гипертензии способствует быстрому достижению гипотензивного эффекта — уже на 2-й неделе лечения за счет благоприятного воздействия препарата на психоэмоциональное состояние.
Обработка данных для метаанализа проводилась с использованием общего критерия, но разных шкал. В части исследований, вошедших в метаанализ, отсутствовала рандомизация. Указанные отклонения вносят определенные ограничения в результаты проведенного анализа и требуют выполнения дополнительных спланированных рандомизированных КИ для их последующего включения в метаанализ.
Заключение
Широкая распространенность АС диктует необходимость использования эффективных терапевтических стратегий с убедительной доказательной базой. В связи с этим препарат Проспекта® вызывает значительный интерес, поскольку его доказательная база сочетает высокий уровень значимости данных с максимальным приближением к условиям реальной практики. Применение препарата Проспекта® приводит к регрессу слабости, восстановлению сил и повышению работоспособности у пациентов с различными заболеваниями, которые не сопровождаются повышением риска развития НЯ.
Источники финансирования: работа выполнена при поддержке ООО «НПФ «МАТЕРИА МЕДИКА ХОЛДИНГ».
Конфликт интересов: авторы заявили о следующих конфликтах интересов в связи с публикацией статьи. Авторы публикации получили грант от ООО «НПФ «МАТЕРИА МЕДИКА ХОЛДИНГ». ООО «НПФ «МАТЕРИА МЕДИКА ХОЛДИНГ» покрыло расходы, связанные с публикацией статьи. Препарат Проспекта® производится ООО «НПФ «МАТЕРИА МЕДИКА ХОЛДИНГ». Патенты на технологию, которая использована для приготовления препарата Проспекта®, принадлежат основателю ООО «НПФ «МАТЕРИА МЕДИКА ХОЛДИНГ».
1Клинические рекомендации. Старческая астения. 2021. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/recomend/613_2 (дата обращения: 12.09.2024).
2Инструкция по медицинскому применению лекарственного препарата Проспекта® (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=13b7d400-1129-44a7-b96a-26dc2e9c2fe0 (дата обращения: 03.12.2024).
3Общая фармакопейная статья Государственной фармакопеи Российской Федерации XV издания ОФС. 1.7.0001. Биологические лекарственные препараты, полученные на основе градуальной технологии. (Электронный ресурс.) URL: https://pharmacopoeia.regmed.ru/pharmacopoeia/izdanie-15/1/1-9/biologicheskie-lekarstvennye-preparat… (дата обращения: 03.12.2024).
Информация с rmj.ru
