Введение
Самая частая причина метастазирования в печень — первичный рак органов бассейна воротной вены [1]. При этом такие метастазы сами по себе могут иметь выраженную васкуляризацию (67% случаев) или же тесно прилежать к крупному сосуду [2, 3]. В обоих случаях эффективность радиочастотной термической абляции (РЧТА) снижается из-за эффекта теплоотведения, что повышает риск сохранения остаточной опухоли в зоне, пограничной РЧТА [4–7]. Эффект теплоотведения начинает проявляться при наличии рядом с опухолью сосудов, в частности вен, диаметром ≥3 мм [3]. Этот факт служит обоснованием проведения окклюзии крупных сосудов, прилежащих к опухолевой ткани, перед процедурой РЧТА. Было показано, что серьезные осложнения, в том числе локальные ишемические события, системная воспалительная реакция, печеночная недостаточность, в исходе подобных вмешательств не возникают [8].
Наиболее распространенным методом минимизации теплоотведения при РЧТА и повышения радикальности процедуры является предварительная химиоэмболизация сосудов, питающих опухоль [4–6]. Однако применение химиоэмболизации оказалось проблематичным у пациентов с сердечной недостаточностью при фракции выброса левого желудочка <50%, у пациентов с почечной недостаточностью при уровне креатинина сыворотки крови >177 ммоль/л и при некоторых других патологических состояниях [7, 9–11]. Естественно, что для таких случаев требуется найти другой способ ограничения эффекта теплоотведения и повышения эффективности РЧТА. Цель исследования: оценить эффективность и безопасность метода предварительной коагуляции вены, прилежащей к опухолевому узлу, при УЗ-контролируемой чрескожной локорегионарной РЧТА периваскулярных метастазов колоректального рака (КРР) в печени.
Материал и методы
Проанализированы данные историй болезни 51 пациента до и после УЗ-контролируемой РЧТА солитарных метастазов КРР в печени. Обследование, интервенционные хирургические вмешательства и наблюдение пациентов проводились в Гомельском областном клиническом онкологическом диспансере (Республика Беларусь) в период 2014–2020 гг. включительно.
Обследование пациентов проводилось в соответствии с принятыми в Белоруссии стандартами лечения КРР. Из основных инструментальных методов диагностики применялись УЗИ и КТ-ангиография. Образцы опухоли для последующей морфологической верификации получали методом трепан-биопсии под УЗ-контролем.
Для визуализации метастатических очагов в печени УЗИ проводили на ультразвуковом сканере среднего класса Hitachi Aloka Prosound Alpha 6 с использованием конвексного электронного датчика с диапазоном рабочих частот 3,5–5 МГц. Идентификация прилежащего к опухоли сосуда осуществлялась с помощью цветового допплеровского картирования (ЦДК).
Для процедуры РЧТА использовали одноразовый отводящий электрод системы Cool-tip RF Ablation System (длина 15–25 см, рабочая часть 2,0–3,0 см) производства компании Medtronic и генератор. Под УЗ-контролем одноразовый отводящий электрод направлялся в область интереса с прямым проколом прилежащего кровеносного сосуда. Далее в режиме «коагуляция» сосуд запаивался до прекращения визуализации кровотока по данным ЦДК. Затем электрод размещали в центр метастаза и проводили абляцию опухолевого очага (время экспозиции на один очаг 14,0±2,2 мин) в режиме «коагуляция» с последующим извлечением электрода. В случае, когда зона некроза после однократного воздействия не охватывала опухоль целиком вместе с 10 мм прилежащей ткани, проводилась дополнительная аппликация электрода. В контрольной группе предварительная коагуляция вены не проводилась — сразу осуществлялась РЧТА метастатического очага. Послеоперационные осложнения оценивались по пяти степеням тяжести согласно усовершенствованной классификации Clavien — Dindo [12].
В качестве конечных точек исследования оценивались: объем зоны постабляционного фиброза, полнота некроза и показатели безрецидивной выживаемости (БРВ) через 6 и 12 мес. после процедуры РЧТА. Также были проанализированы характер метастазов в печени, количество койко-дней, частота и тип периоперационных осложнений, ключевые показатели биохимического анализа крови (альбумин, АСТ, АЛТ, общий билирубин).
Статистический анализ полученных данных проводился с использованием компьютерного программного обеспечения: R версия 3.2 и MedCalc 15.6.1 (trialversion).
Для оценки нормальности распределения признаков использовался критерий Шапиро — Уилка. Если распределение количественных показателей отличалось от нормального, данные представлялись в виде медианы, минимального и максимального значений, при нормальном распределении признаков — в виде среднего арифметического и стандартного отклонения среднего арифметического (M±SD). Для сравнения двух независимых выборок использовались U-критерий Манна — Уитни и двусторонний критерий Фишера. За уровень статистической значимости принималась величина p<0,05. Для оценки силы взаимосвязи признаков использовался метод Спирмена (r) [13]. Показатель БРВ рассчитывался с помощью процедуры Каплана — Мейера [14].
Результаты исследования
В ретроспективное исследование вошли пациенты, у которых был выявлен один солитарный метастатический очаг в печени. В соответствии с целью исследования пациенты открытым способом были распределены в две группы. Экспериментальную группу составили 23 (45,1%) пациента, которым проводилась предварительная коагуляция сосуда, прилежащего к опухоли. В контрольную группу вошли 28 (54,9%) пациентов, которым перед процедурой РЧТА не проводилась коагуляция прилежащего сосуда. Группы были сопоставимы по полу, возрасту и основным клиническим характеристикам пациентов (табл. 1).
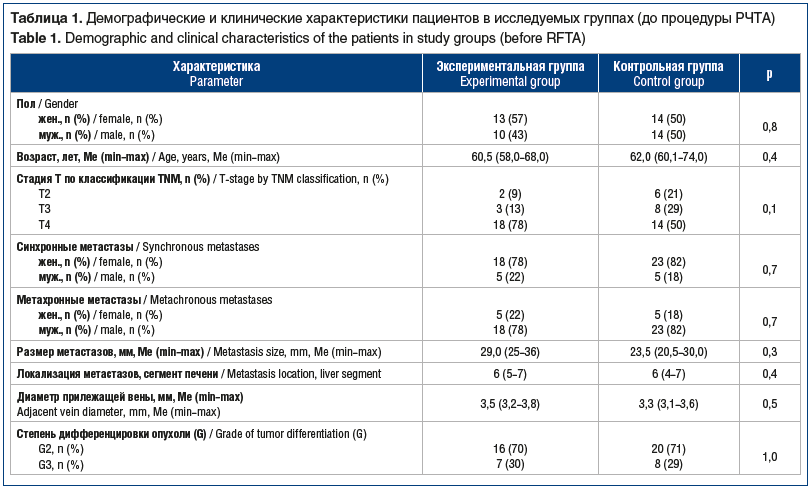
Как видно из таблицы 1, до проведения интервенционной процедуры не отмечено статистически значимых различий между характеристиками пациентов и метастатических очагов в группах сравнения. Анализ ключевых показателей функционального состояния печени до и после РЧТА также не выявил статически значимых различий и между исследуемыми группами (табл. 2).
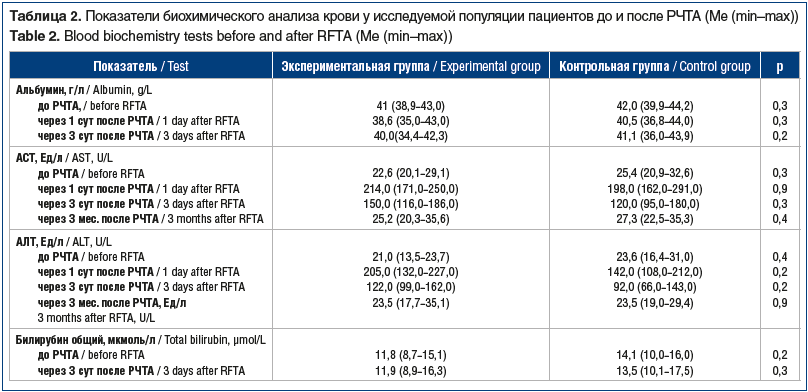
В обеих группах повышение уровней печеночных ферментов имело преходящий характер. Постепенное снижение биохимических показателей отмечалось на 3-и сутки после РЧТА, а возврат к исходному значению происходил через 3 мес. после процедуры. Важно отметить, что показатель общего билирубина у всех пациентов оставался в пределах нормы в течение всего периода наблюдения.
В раннем послеоперационном периоде в обеих группах были отмечены незначительные осложнения, носившие, как правило, сочетанный характер. Осложнения в основном были представлены вагусными реакциями в сочетании с болевым синдромом продолжительностью до 6 ч. Кроме того, в раннем послеоперационном периоде в обеих группах были зарегистрированы по одному случаю развития абсцесса печени IIIA степени тяжести по классификации Clavien — Dindo (табл. 3).
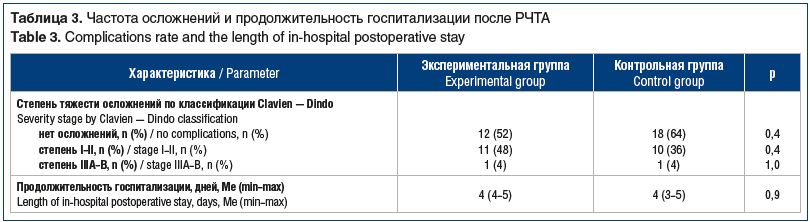
Не выявлены статистически значимые различия между группами по частоте и тяжести осложнений, а также по продолжительности госпитализации в послеоперационном периоде.
На фоне отсутствия значимых различий между двумя группами по основным параметрам безопасности особого внимания заслуживают результаты анализа постабляционного рентгенологического катамнеза и БРВ пациентов за период 6 и 12 мес.
После интервенционного вмешательства все пациенты проходили длительное наблюдение и контрольные обследования (КТ-ангиография) через 1 мес. после РЧТА и далее 1 раз в 3 мес. в течение года. Обследования проводились в соответствии с локальными стандартами медицинской помощи онкологическим пациентам, а также с учетом регулярно обновляемых клинических рекомендаций NCCN (США). Результаты представлены в таблице 4.
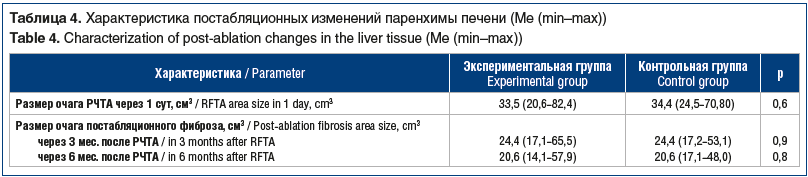
По данным КТ-ангиографии в послеоперационном периоде не было выявлено статистически значимых различий между группами в отношении размера очага постабляционного фиброза. Это значит, что предварительная коагуляция сосуда, прилежащего к метастазу, увеличивает радикальность воздействия РЧТА на опухоль и при этом не оказывает существенного влияния на объем поражения здоровой ткани. Другими словами, предварительная коагуляция как дополнительная процедура не приводит к атрофии целевого сегмента печени. В свою очередь, снижение инцидентности остаточной опухоли в зоне абляции (17,4% против 21,4%) свидетельствует о большей радикальности или эффективности РЧТА в экспериментальной группе по сравнению с контролем.
Показатель БРВ через 6 и 12 мес. после РЧТА был выше у пациентов с предварительной коагуляцией прилежащего сосуда по сравнению с группой контроля: 65,2% против 53,6% (95% ДИ 0,734–0,941; p=0,03; χ2) и 56,5% против 39,3% (95% ДИ 0,734–0,941; p=0,04; χ2) соответственно (см. рисунок).
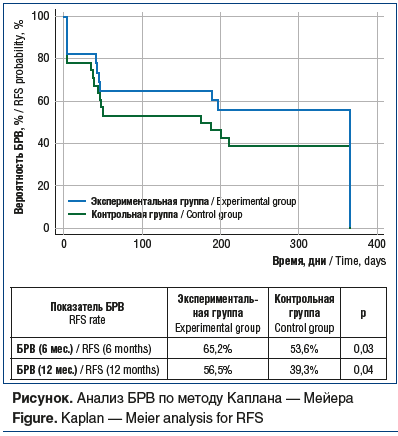
Заключение
Предварительная коагуляция сосуда, прилежащего к солитарному метастазу КРР в печени, позволяет уменьшить эффект теплоотведения из зоны РЧТА и, тем самым, повысить радикальность воздействия на опухоль без существенного влияния на здоровую паренхиму печени и без увеличения частоты серьезных осложнений. Предварительная коагуляция прилежащего сосуда приводит к снижению инцидентности остаточной опухоли в зоне абляции и увеличению показателей БРВ пациентов в течение 6 и 12 мес.
Исследуемый метод не требует дополнительных финансовых и технических затрат, не увеличивает продолжительность госпитализации и потенциально может рассматриваться в качестве альтернативы у пациентов с противопоказаниями или ограничениями для выполнения химиоэмболизации в рамках подготовки к РЧТА.
Сведения об авторах:
Мурашко Константин Леонидович — врач-рентгенолог, учреждение «Гомельский областной клинический онкологический диспансер»; 246027, Республика Беларусь, г. Гомель, ул. Медицинская, д. 2; ORCID iD 0000-0003-3997-7612.
Юрковский Алексей Михайлович — к.м.н., доцент кафед-ры внутренних болезней № 3 с курсом лучевой диагностики, УО «ГомГМУ»; 246050, Республика Беларусь, г. Гомель, ул. Ланге, д. 5; ORCID iD 0000-0003-0808-183X.
Сорокин Виталий Геннадьевич — ассистент кафедры рентгеноэндоваскулярных методов диагностики и лечения, РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-8402-4584.
Громов Дмитрий Геннадьевич — д.м.н., заведующий кафедрой рентгеноэндоваскулярных методов диагностики и лечения, РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; заведующий отделением рентгеноэдоваскулярной диагностики и лечения, ГБУЗ «ГКБ им. Ф.И. Иноземцева ДЗМ»; 105187, Россия, г. Москва, ул. Фортунатовская, д. 1; ORCID iD 0000-0001-7500-4987.
Тавлуева Евгения Валерьевна — д.м.н., заведующая региональным сосудистым центром ГБУЗ «ГКБ им. Ф.И. Иноземцева ДЗМ»; 105187, Россия, г. Москва, ул. Фортунатовская, д. 1; ORCID iD 0000-0002-6796-212X.
Контактная информация: Мурашко Константин Леонидович, e-mail: kostya199172@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 27.05.2022.
Поступила после рецензирования 22.06.2022.
Принята в печать 15.07.2022.
About the authors:
Konstantin L. Murashko — Radiologist, Gomel Regional Clinical Oncological Dispensary; 2, Medysynskaya str., Gomel, 246027, Republic of Belarus; ORCID iD 0000-0003-3997-7612.
Alexei M. Yurkovskiy — Dr. Sc. (Med.), Associate Professor of the Department of Internal Diseases with a course of radiology No. 3, Gomel State Medical University; 5, Lange str., Gomel, 246050, Republic of Belarus; ORCID iD 0000-0003-0808-183X.
Vitalii G. Sorokin — Research Associate of the Department of Interventional Radiology, N.I. Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0001-8402-4584.
Dmitry G. Gromov — Dr. Sc. (Med.), Head of the Department of Interventional Radiology, N.I. Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; Head of the Department of Interventional Radiology, F.I. Inozemtsev City Clinical Hospital; 1, Fortunatovskaya str., Moscow, 105187, Russian Federation; ORCID iD 0000-0001-7500-4987.
Evgenia V. Tavlueva — Dr. Sc. (Med.), Head of the Regional Vascular Center, F.I. Inozemtsev City Clinical Hospital; 1, Fortunatovskaya str., Moscow, 105187, Russian Federation; ORCID iD 0000-0002-6796-212X.
Contact information: Konstantin L. Murashko, e-mail: kostya199172@gmail.com.
Financial Disclosure: no authors have no a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 27.05.2022.
Revised 22.06.2022.
Accepted 15.07.2022.
Информация с rmj.ru
