Механизмы развития и пути коррекции антибиотик-ассоциированной диареи
Т. В. Гасилина, кандидат медицинских наук
С. В. Бельмер, доктор медицинских наук, профессор
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Широкое применение антибиотиков, эпоха которых началась в середине XX века, принесло не только спасение жизней миллионов людей, исцеление от ранее, казалось бы, некурабельных заболеваний, но также побочные эффекты, которых не избежало ни одно лекарственное средство. Одним из таких нежелательных эффектов применения антибиотиков является развитие диареи различной степени выраженности. Состояние, которое в зарубежной литературе обозначается как антибиотик-ассоциированная диарея (ААД), обусловлено широким спектром причин, однако во многих случаях оно опосредовано через изменение состояния кишечного микробиоценоза. В связи с этим существующий в отечественной литературе термин «антибиотик-ассоциированный дисбактериоз кишечника» может рассматриваться практически как синоним ААД.
Развитие ААД может быть опосредовано прямым нарушением кишечного микробиоценоза и его неспецифическими последствиями, включая изменения спектра продукции короткоцепочечных жирных кислот (КЖК), нарушение микробного метаболизма углеводов и желчных кислот. Крайним последствием ассоциированного с приемом антибиотиков дисбактериоза является развитие антибиотик-ассоциированного колита, а наиболее тяжелым — развитие псевдомембранозного колита (ПМК), связанного с активацией Clostridium difficile. Описана также активация и других микроорганизмов с появлением соответствующей симптоматики: Clostridium perfringens, Staphylococcus aureus, Klebsiella oxytoca, Candida spp. и Salmonella spp. [1].
Эффекты со стороны антибиотиков на кишечную микрофлору дополняются прокинетическими механизмами, характерными для некоторых препаратов рассматриваемой группы. Так, эритромицин оказывает прямое действие на рецепторы мотилина, стимулируя моторику ЖКТ [2]. Наиболее выражен эффект эритромицина в отношении верхних отделов ЖКТ, в частности, наблюдается ускорение опорожнения желудка, однако развитие и диареи также описано [3]. Клавулановая кислота также стимулирует кишечную моторику. Этот эффект проявляется при приеме амоксициллина/клавуланата. Также известно прямое токсическое действие на слизистую оболочку кишечника при применении тетрациклина и неомицина [4].
И все же в большинстве случаев развитие ААД связано с изменением кишечной микробиоты, наиболее тяжелым из которых является C. difficile-ассоциированный ПМК.
На долю токсигенных штаммов C. difficile как причины ААД приходится всего 10–20% случаев [5, 6]. При этом C. difficile выявляется примерно у 5% здоровых взрослых лиц [7, 8], а также у 2–65% новорожденных [9, 10], несмотря на отсутствие клинической симптоматики в подавляющем большинстве случаев. Аминопенициллины, цефалоспорины, клиндамицин нарушают состав кишечной микрофлоры, создавая благоприятные условия для активности C. difficile [9, 11].
Повреждающее действие C. difficile обусловлено энтеротоксином (токсин A) и цитотоксином (токсин B), вызывающими воспалительный процесс в слизистой оболочке кишечника. Токсины C. difficile оказывают многоплановое действие. Прямые эффекты на энтероциты определяются взаимодействием с соответствующими рецепторами, что приводит к дезагрегации внутриклеточного F-актина и нарушению состояния плотных контактов между энтероцитами, определяющими проницаемость эпителиального барьера. Следствием перечисленных изменений и является развитие диареи.
Ряд эффектов токсины C. difficile оказывают на уровне lamina propria, способствуя высвобождению цитокинов, активации тучных клеток, афферентных нейронов, экспрессии молекул адгезии на эндотелии сосудов и привлечению в очаг патологического процесса нейтрофилов с развитием воспаления [12].
Однако в подавляющем большинстве случаев ААД нарушение состава микрофлоры носит неспецифический характер, приводя к нарушению ее метаболических и защитных функций, в частности, в связи с нарушением синтеза КЖК. В экспериментальных работах было показано, в частности, что клиндамицин вызывает снижение активности Clostridium и Bacteroides spp., активно участвующих в синтезе КЖК, сопровождающемся нарушением продукции масляной кислоты [13]. Аналогичный эффект был показан и для ампициллина и метронидазола [14, 15]. Нарушение состава микрофлоры толстой кишки под воздействием антибиотиков может привести и к нарушению метаболизма углеводов [16, 17] с развитием классической осмотической диареи.
Согласно существующему определению под ААД понимают 2 или более эпизодов жидкого стула в течение 2 или более последовательных дней, развивающихся на фоне начавшейся антибактериальной терапии (через 2 дня от ее начала) и вплоть до 2 месяцев после отмены антибиотиков [18].
Другими словами, ААД — комплекс патологических сдвигов в составе кишечной микрофлоры с соответствующими клиническими проявлениями, связанный с дисбактериозом, развившихся вследствие применения антибиотиков.
По данным различных авторов частота развития ААД составляет 6–80% среди пациентов, получавших терапию антибиотиками [19]. По данным D. Turke и соавт. она наблюдается у 11% среди детей, получающих антибактериальную терапию. Причем у 2/3 из них она развивается во время терапии, а у 1/3 — в течение недели после завершения. Манифестация наблюдается в среднем на 5,3 ± 3,5 дня при средней продолжительности — 4 ± 3 дня. По наблюдениям автора в подавляющем большинстве случаев наблюдается нетяжелое течение, как правило, даже не требующее госпитализации [20].
По данным J. A. Vanderhoof и соавт. чаще всего развитие ААД связано с приемом амоксициллина/клавуланата, эритромицина и других макролидов, цефалоспоринов и пенициллинов [21] (рис.). Причем риск развития ААД при парентеральном введении аналогичен таковому при пероральном. Особой группой риска являются дети в возрасте от 2 месяцев до 2 лет. Так, относительный риск диареи при приеме амоксициллина/клавуланата составляет 2,43 (1,4–4,21), но для детей младше 2 лет он увеличивается до 3,5 (1,89–6,46) [22].
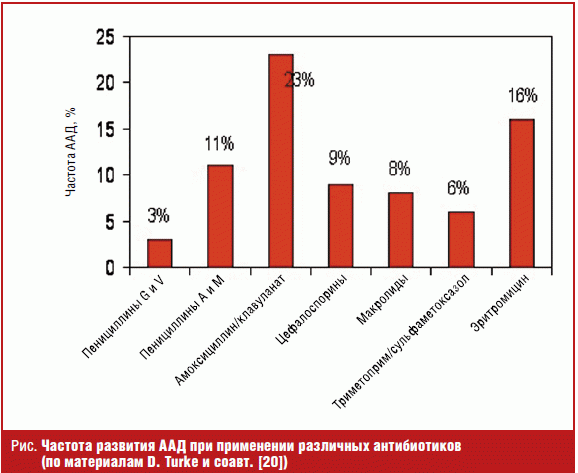
В основном неспецифическое воздействие на кишечную микрофлору оказывают т. н. «старые пенициллины». Так, ампициллин подавляет рост аэробной и анаэробной микрофлоры, в то время как амоксициллин минимально подавляет флору, но способствует увеличению популяции Enterobacteriacaea spp. Следует отметить, что большинство современных пенициллинов не способствуют размножению грибов и C. difficile.
Пероральные цефалоспорины цефподоксим, цефпрозил и цефтибутен способствуют росту Enterobacteriaceae spp., а цефаклор и цефрадин — практически не влияют на кишечную микрофлору. Цефиксим вызывает снижение численности анаэробных микроорганизмов. Однако большинство цефалоспоринов способствует росту численности энтерококков и C. difficile.
Фторхинолоны в значительной степени угнетают рост микробов рода Enterobacteriaceae и в меньшей степени — энтерококков и анаэробных микроорганизмов, не способствуют росту C. difficile.
Факторами риска развития ААД являются [18, 20, 23, 24]:
- возраст (младше 6 лет и старше 65 лет);
- сопутствующие болезни, в первую очередь заболевания органов пищеварения, оперативные вмешательства, противоязвенная терапия;
- пребывание в отделении интенсивной терапии;
- иммунодефицитные состояния;
- длительная госпитализация;
- длительный курс антибиотиков (более 3 дней, особенно более 20 дней);
- большое число назначенных антибиотиков.
Клинические проявления ААД варьируют в широких пределах от минимальных до тяжелых жизнеугрожающих. Типичным является послабление стула, возникающее в течение нескольких дней от начала приема антибиотиков без патологических примесей, нередко купирующееся самостоятельно в течение 3–4 дней. Возможны схваткообразные боли в животе. Заболевание обычно протекает без признаков интоксикации, лихорадки, лейкоцитоза.
Тяжелое течение с развитием колита, особенно ПМК, связанного с активацией C. difficile, характеризуется яркой клинической картиной, учащением стула до 10–20 раз в сутки, выраженной интоксикацией, лихорадкой, дегидратацией, абдоминальным болевым синдромом, лейкоцитозом. Этот вариант развития ААД может закончиться летально при отсутствии немедленной интенсивной терапии.
Профилактика и коррекция ААД в первую очередь связаны с применением пробиотиков. Доказано, что применение пробиотиков одновременно с антибактериальными средствами у детей снижает риск развития ААД примерно на 28% [25–27]. При легких формах ААД пробиотики составляют основу проводимой терапии.
Лечение ПМК требует проведения широкого комплекса мероприятий, включая дезинтоксикацию и восстановление водно-электролитного баланса, обязательным является применение антибактериальных препаратов, метронидазола (per os 400 мг 3 раза в день) или ванкомицина (125 мг 4 раза в день) до исчезновения симптомов [28]. Но и в этом случае назначение пробиотиков значительно повышает эффективность терапии, что было подтверждено в многочисленных клинических исследованиях и метаанализах [29].
Примером эффективного пробиотического средства может быть препарат РиоФлора, выпускающийся в двух вариантах. Так, в состав РиоФлора Иммуно Нео входит комплекс микроорганизмов, обладающий положительным действием на иммунную систему: Bifidobacterium lactis W51, Bifidobacterium lactis W52, Lactobacillus acidophilus, Lactobacillus plantarum, Lactococcus lactis, Bifidobacterium longum, Lactobacillus paracasei, Lactobacillus salivarius, Streptococcus thermophilus.
Для профилактики и лечения ААД был разработан РиоФлора Баланс Нео, в состав которого входят Bifidobacterium lactis, Lactobacillus plantarum, Bifidobacterium bifidum, Lactobacillus acidophilus W37, Lactobacillus acidophilus W55, Lactobacillus rhamnosus, Lactobacillus paracasei, Lactobacillus salivarius.
Важно, что в состав РиоФлора входят штаммы микроорганизмов с доказанной пробиотической активностью. Они устойчивы к воздействию соляной кислоты и желчи и обладают высокой адгезивной способностью к стенке кишечника. Штаммы в РиоФлоре подавляют рост патогенных микроорганизмов и грибов. Комплекс микроорганизмов, входящий в состав РиоФлора, модулирует иммунный ответ, выработку иммуноглобулинов и цитокинов. Все штаммы в пробиотиках РиоФлора имеют статус QPS (Qualified Presumption of Safety).
Убедительно доказано, что многокомпонентные пробиотики, по сравнению c монокомпонентными, обеспечивают более высокую эффективность и оказывают положительный эффект при более широком спектре заболеваний и состояний [30].
Показана сахаролитическая активность включенных в РиоФлора штаммов, высокий уровень продукции КЖК, закисляющий эффект, антагонистическая активность в отношении протеолитической флоры, способность метаболизировать ксенобиотики, разрушать бактериальную β-глюкуронидазу, ферменты, вовлеченные в процессы карциногенеза, и многие токсины.
Применение препарата РиоФлора Баланс Нео на фоне антибиотикотерапии снижает риск развития кишечных расстройств на трех уровнях:
1) тормозит размножение патогенных бактерий;
2) нормализует баланс микрофлоры кишечника;
3) активирует иммунитет, увеличивает уровень иммуноглобулинов, в частности секреторного IgA в сыворотке крови.
Применение РиоФлора Баланс Нео оказывает широкий спектр положительных эффектов на организм человека, включая нормализацию состава микрофлоры кишечника, улучшение его функционального состояния при нарушениях стула, снижение риска развития ААД, нормализацию процессов пищеварения, а также повышение естественной защиты организма от инфекций и воздействия неблагоприятных факторов внешней среды [31].
С целью терапии ААД препарат РиоФлора Баланс Нео рекомендуется назначать по 2 капсулы 2 раза в сутки в течение 14 дней, с целью профилактики рецидива диареи — до 1 мес. Препарат разрешен к применению у взрослых и детей старше 3 лет.
Эффективность препарата РиоФлора доказана в многочисленных зарубежных отечественных исследованиях [32].
В работе И. А. Ли и соавт. было показано положительное влияние РиоФлора Баланс Нео на метаболическую активность кишечной микрофлоры у взрослых пациентов. Так, если средний исходный уровень КЖК в стуле у обследованных больных составлял 7,7 ± 4,4 мкг/г (при этом у 62,5% пациентов метаболическая активность была снижена), то прием пробиотика РиоФлора Баланс Нео привел к устойчивому росту метаболической активности микрофлоры кишечника, а средний общий уровень КЖК достиг 10,9 ± 4,8 мкг/г (число больных со сниженной метаболической активностью микрофлоры уменьшилось до 50%). При этом прием пробиотика РиоФлора Баланс Нео приводил к достоверному увеличению доли масляной кислоты в общем содержании КЖК с 13,3% до 20,9% (р < 0,05). Данное наблюдение имеет принципиально важное значение, т. к. при ААД происходит угнетение синтеза масляной кислоты в кишечнике, а его активация модулирует пролиферацию, дифференцировку и апоптоз эпителиальных клеток толстой кишки [33].
Доказано, что пробиотик РиоФлора Баланс Нео снижает риск развития ААД, инициирует восстановление кишечного микробиоценоза и других физиологических процессов после повреждения слизистой оболочки толстой кишки, улучшает полостное пищеварение и тем самым влияет на параметры физического развития [34]. В своей работе C. J. M. Koning и соавт. провели изучение кишечного микробиоценоза 40 больных, получавших амоксициллин по поводу инфекции респираторного тракта с пробиотиком или плацебо, и показали высокую эффективность многокомпонентных пробиотиков для профилактики ААД [35].
По данным С. М. Захаренко в исследовании, в которое вошли больные, получавшие 5–7-дневные курсы амоксициллина или кларитромицина по поводу бактериальных тонзиллитов и фарингитов одновременно с препаратом РиоФлора Баланс Нео в течение 7–10 дней, доля пациентов с нормальной микрофлорой кишечника возрастала, а частота возникновения ААД снижалась, по сравнению с терапией без пробиотика [36].
В ранее проведенных зарубежных исследованиях доказана и высокая безопасность препарата РиоФлора [34, 37, 38].
Таким образом, ААД представляет собой серьезную проблему современной медицины, решение которой лежит в рациональном применении антибактериальных средств и разработке новых безопасных в этом отношении антибиотиков. Избежать его развития в большинстве случаев можно применением параллельно с антибиотиками пробиотиков с доказанной эффективностью. Применение пробиотических препаратов является также основой лечения уже развившейся ААД.
Литература
- Christoph Högenauer, Heinz F. Hammer, Krejs G. J., Reisinger E. C. Mechanisms and Management of Antibiotic-Associated Diarrhea // Clinical Infectious Diseases. 1998; 27: 702–710.
- Peeters T. L., Matthijs G., Depoortere I., Cachet T., Hoogmartens J., Vantrappen G. Erythromycin is a motilin receptor agonist // Am J Physiol. 1989; 257: G470–474.
- Charles F., Phillips S. F., Camilleri M., Thomforde G. M. Rapid gastric emptying in patients with functional diarrhea // Mayo Clin Proc. 1997; 72: 323–328.
- Krejs G. J., Reisinger E. C. Mechanisms and Management of Antibiotic-Associated Diarrhea // Clinical Infectious Diseases. 1998; 27: 702–710.
- Katz D. A., Lynch M. E., Littenberg B. Clinical prediction rules to optimize cytotoxin testing for Clostridium difficile in hospitalized patients with diarrhea // Am J Med. 1996; 100: 487–495.
- Kelly C. P., Pothoulakis C., LaMont J. T. Clostridium difficile colitis // N Engl J Med. 1994; 330: 257–762.
- Fekety R. Guidelines for the diagnosis and management of Clostridium difficile — associated diarrhea andcolitis // Am J Gastroenterol. 1997; 92: 739–750.
- McFarland L. V., Mulligan M. E., Kwok R. Y., Stamm W. E. Nosocomial acqui sition of Clostridium difficile infection // N Engl J Med. 1989; 320: 204–210.
- Yamamoto-Osaki T., Kamiya S., Sawamura S., Kai M., Ozawa A. Growth inhibition of Clostridium difficile by intestinal flora of infant faeces in continuous flow culture // J Med Microbiol. 1994; 40: 179–187.
- Larson H. E., Barclay F. E., Honour P., Hill I. D. Epidemiology of Clostridium difficile in infants // J Infect Dis. 1982; 146: 727–733.
- Bartlett J. G. Management of Clostridium difficile infection and other antibi otic-associated diarrhoeas // Eur J Gastroenterol Hepatol. 1996; 8: 1054–1061.
- Thomas Lamont J. Theodore E. Woodward award. How bacterial enterotoxins work: insights from in vivo studies // Transactions Of The American Clinical And Climatological Association. 2002; 113: 167–181.
- Edwards C. A., Duerden B. I., Read N. W. Effect of clindamycin on the ability of colonic bacteria to ferment carbohydrate // Gut. 86; 27: 411–417.
- Kurpad A. V., Shetty P. S. Effects of antimicrobial therapy on faecal bulking // Gut. 1986; 27: 55–588.
- Bjorneklett A., Midtvedt T. Influence of three antimicrobial agents — penicillin, metronidazole and doxycyclin — on the intestinal microflora of healthy humans // Scand J Gastroenterol. 1981; 16: 473–480.
- Roediger W. E. Role of anaerobic bacteria in the metabolic welfare of the colonic mucosa in man. Gut 1980; 21:793–798.
- Roediger W. E. The colonic epithelium in ulcerative colitis: an energy deficiency disease? // Lancet. 1980; 2: 712–715.
- Wiström J., Norrby S. R., Myhre E. B., Eriksson S., Granström G., Lagergren L. et al. Frequency of antibiotic-associated diarrhoea in 2462 antibiotictreated hospitalized patients: a prospective study // J Antimicrob Chemother. 2001; 47: 43–50.
- Seema Alam, Mudasir Mushtaq. Antibiotic Associated Diarrhea in Children // Indian Pediatrics. 2009; 46: 491–496.
- Turke D., Bernet J. P., Marx J., Kemph H., Giard P., Welbaum O. et al. Incidence and risk factors of oral antibiotic-associated diarrhea in an outpatient pediatric population // J Pediatr Gastroenterol Nutr. 2003; 37: 22–26.
- Vanderhoof J. A., Whitney D. B., Antonson D. L., Hanner T. L., Lupo J. V., Young R. J. Lactobacillus GG in the prevention of antibiotic-associated diarrhea in children // J Pediatr 1999; 135: 564–568.
- Kramer M. S., Hutchinson T. A., Naimark L., Contardi R., Flegel K. M., Leduc D. G. Antibiotic-associated gastrointestinal symptoms in general pediatric outpatients // Pediatrics. 1985; 76: 365–370.
- Bignardi G. E. Risk factors for Clostridium difficile infection // J Hosp Infect. 1998; 40: 1–15.
- Бельмер С. В. Антибиотик-ассоциированный дисбактериоз кишечника // РМЖ. 2004; 12 (3): 148–151.
- Szajewska H., Ruszczynski M., Radzikowski A. Probiotics in the prevention of antibiotic-associated diarrhea in children: a metaanalysis of randomized controlled trials // J. Pediatr. 2006; 149 (3): 367–372.
- Kale-Pradhan P. B., Jassal H. K., Wilhelm S. M. Role of Lactobacillus in the prevention of antibiotic-associated diarrhea: a meta-analysis // Pharmacotherapy. 2010; 30 (2): 119–126.
- Johnston B. C., Supina A. L., Vohra S. Probiotics for pediatric antibiotic-associated diarrhea: a meta-analysis of randomized placebo-controlled trials // CMAJ. 2006; 175 (4): 377–383.
- Starr J. Clostridium difficile associated diarrhoea: diagnosis and treatment // BMJ. 2005; 331: 498–501.
- Aloysius L. D’Souza, Chakravarthi Rajkumar, Jonathan Cooke, Christopher J. Bulpitt. Probiotics in prevention of antibiotic associated diarrhoea: metaanalysis // BMJ. 2002; vol. 324, 8 June, 324: 1361.
- Timmerman H. M., Koning C. J. M., Mulder L., Rombouts F. M., Beynen A. C. Monostrain, multistrain and multispecies probiotics // International Journal of Food Microbiology. 2004; 96: 219–233.
- Успенский Ю. П., Фоминых Ю. А. Антибиотик-ассоциированная диарея — новая проблема цивилизации // Consilium Medicum. 2012; 14 (8): 3–7.
- Минушкин О. Н., Елизаветина Г. А., Ардатская М. Д. Нарушение баланса микрофлоры и ее коррекция // Эффективная фармакотерапия. 2013; 41: 4–8.
- Ли И. А., Сильвестрова С. Ю., Трейман Е. В., Дроздов В. Н. Влияние пробиотика РиоФлора Баланс Нео на метаболическую активность микрофлоры кишечника // Архив внутренней медицины. 2013; 4 (12): 61–67.
- Timmerman H. M., Koning C. J. M., Mulder L., Rombouts F. M., Beynen A. C. Monostrain, multistrain and multispecies probiotics. A comparison of functionality and efficacy // Int J Food Microbiol. 2004; 96: 219–233.
- Koning C. J. M., Jonkers Daisy M. A. E., Stobberingh E. E. et al. The effect of a multispecies probiotic on the intestinal microbiota and bowel movements in healthy volunteers taking the antibiotic amoxicillin // Am J Gastroenterol. 2007; 102: 1–12.
- Захаренко С. М. Инновационные подходы к лечению кислотозависимых заболеваний // Эффективная фармакотерапия // Гастроэнтерология. 2013; 17 (2): 32–38.
- Mulder L. A multispecies probiotic food supplement (Ecologic 825) for IBD // NUTRAfoods. 2008; 7: 89–91.
- Steyer G. E. Multispezies-Probiotika der dritten Generation fur zeitgemаbe Therapien. Chirurgenkongress // Universum. Innere. Medizin. 2009; 5: 117.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru





