Дефицит лизосомной кислой липазы (ДЛКЛ) — редкое наследственное прогрессирующее жизнеугрожающее метаболическое заболевание, которое может приводить к смерти в младенческом возрасте или тяжелому поражению внутренних органов в детском возрасте. Причиной заболевания является недостаточность фермента лизосомной кислой липазы, которая приводит к накоплению липидов в клетках различных органов, главным образом печени и селезенки, отложению холестерина на стенках сосудов и органах ЖКТ [1–3]. Предполагаемая распространенность заболевания ДЛКЛ в России 1:100 000 [4].
Длительное латентное течение заболевания и отсутствие специфических симптомов приводят к поздней постановке диагноза и несвоевременному началу патогенетической терапии. В результате развиваются практически необратимые состояния, такие как цирроз печени и атеросклероз в раннем возрасте. Этому способствуют низкая осведомленность медицинского сообщества о клинических проявлениях и диагностике ДЛКЛ, ошибки в оценке состояния пациента и интерпретации результатов обследования [1–3]. Поэтому крайне важно повышать информированность врачей о данном заболевании, разработать диагностический алгоритм, а также проводить тщательный мониторинг состояния пациентов в процессе терапии. Ферментозаместительная терапия ДЛКЛ, которая стала доступна в РФ с момента регистрации препарата себелипаза альфа (Канума) в 2017 г., является единственным методом лечения с доказанной эффективностью.
В настоящее время существует множество методов оценки и оцениваемых параметров состояния печени, ЖКТ и ССС. К сожалению, как показывает практика, зачастую знания врачей о системе оценки функции поврежденных органов и сроках проведения полного клинико-лабораторного обследования на фоне проводимой патогенетической терапии ДЛКЛ ограниченны.
Наиболее значимые критерии оценки безопасности и эффективности терапии ДЛКЛ были показаны в ходе клинических исследований себелипазы альфа. В результате клинического исследования II и III фазы, в которое включали только пациентов с задержкой роста и манифестацией заболевания длительностью до 6 мес., 6 из 9 пациентов оставались живыми до возраста 12 мес. В контрольной группе смертность пациентов уже к 7-му мес. жизни составила 100%. По этическим соображениям, а также ввиду высокой летальности, связанной с заболеванием, контрольную группу выбирали по историческим данным среди пациентов со сходными характеристиками [5]. В многоцентровом рандомизированном плацебо-контролируемом двойном слепом исследовании III фазы у детей и взрослых была достигнута первичная контрольная точка — нормализация уровня аланинаминотрансферазы (АЛТ) у 31% пациентов (при начальном уровне фермента выше нормы в 1,5 и более раз) уже через 20 нед. после начала терапии препаратом себелипаза альфа. Вторичные контрольные точки, связанные с развитием заболевания, такие как процент содержания жира в печени, регресс или стабилизация фиброза печени, устранение дислипидемии и др., также были достигнуты через 20 нед. терапии. Увеличение срока наблюдения до 52 нед. показало дальнейшее улучшение оцениваемых параметров. Особо было подчеркнуто, что нежелательные явления, зафиксированные во время клинических исследований, были в основном связаны с аллергической реакцией на препарат из-за высокого содержания белков и не носили тяжелого характера [6, 7].
Для адекватной оценки состояния пациента и дальнейшего мониторинга терапии или естественного течения заболевания после постановки диагноза ДЛКЛ пациенту показано обследование в следующем объеме:
Оценка антропометрических данных (рост, вес, индекс массы тела (ИМТ)) и уровня артериального давления. Вес пациента необходимо измерять перед каждой инфузией для расчета необходимой дозы препарата.
Размеры печени и селезенки (пальпаторно и перкуторно).
Лабораторные данные:
общий анализ крови;
биохимический анализ крови (включая АЛТ, аспартат-
аминотрансферазу (АСТ), гамма-глутамилтрансферазу (ГГТ), щелочную фосфатазу (ЩФ), билирубин, альбумин, глюкозу, креатинин, половые гормоны);
липидный профиль (общий холестерин, холестерин липопротеинов низкой плотности (Х- ЛПНП), холестерин липопротеинов высокой плотности (Х-ЛПВП), триглицериды (ТГ));
коагулограмма (включая протромбиновый индекс, международное нормализованное отношение, фибриноген);
иммунологическое исследование (включая IgA, IgE).
Инструментальные исследования:
УЗИ, МРТ и/или КТ брюшной полости (печень, селезенка, надпочечники) (по показаниям);
фиброскопия, денситометрия;
УЗИ, МРТ и/или КТ крупных сосудов (по показаниям);
гастроскопия (по показаниям).
Оценка состояния печени:
плотность печени;
оценка по Чайлд — Пью;
биопсия печени (по показаниям);
оценка по шкале МЕТАВИР.
Рекомендуются консультации следующих специалистов:
кардиолога;
эндокринолога;
невролога;
диетолога.
Оценка эффективности терапии
В результате клинических исследований эффективности препарата себелипаза альфа было показано, что при его использовании снижается или нормализуется уровень трансаминаз (АЛТ, АСТ), общего холестерина, Х-ЛПНП, ТГ, а также повышается концентрация Х-ЛПВП; уменьшаются размеры печени и селезенки и содержание жира в органах. У младенцев терапия себелипазой альфа приводила к значительному увеличению выживаемости (при абсолютной смертности без терапии) [5–7]. Для расчета терапевтической дозы препарата и ее коррекции с возрастом необходимо знать вес пациента, поэтому перед каждой инфузией рекомендуется взвешивание. Детям старше 6 мес. и взрослым препарат вводят из расчета 1 мг/кг каждые 2 нед. Для детей до 6 мес. рекомендуемая начальная доза составляет 1 мг/кг внутривенно 1 р./нед.; в зависимости от клинического ответа следует рассмотреть возможность постепенного увеличения дозировки до 3 мг/кг 1 р./нед. Перед каждой инфузией оценивают общее состояние больного, пальпаторно и перкуторно определяют размеры печени и селезенки. Измеряют антропометрические показатели. Один раз в месяц перед введением препарата рекомендуется контролировать уровень сывороточных трансаминаз (АЛТ, АСТ), липидный профиль (общий холестерин, Х-ЛПНП, Х-ЛПВП, ТГ) и коагулограмму (в составе общего и биохимического анализов крови).
Ежегодно в крупных клинических центрах рекомендуется проводить более детальное обследование пациента в соответствии с перечнем, представленным выше (см. «Оценка состояния пациента до терапии»). Таким образом, специалисты будут иметь возможность аккумулировать и анализировать информацию, позволяющую адекватно и своевременно оценивать состояние пациента, эффективность и безопасность терапии ДЛКЛ.
В связи с тем что диета в значительной степени влияет на баланс липидов, состояние печени и сосудов, пациентам с ДЛКЛ рекомендуется консультация диетолога по подбору питания для людей с заболеваниями печени и нарушением липидного обмена. Рекомендации по питанию осуществляются на основании показателей нутритивного статуса пациента (антропометрия, основной обмен и состав тела).
Более подробная информация по мониторингу эффекта ферментозаместительной терапии ДЛКЛ приведена в таблице 1.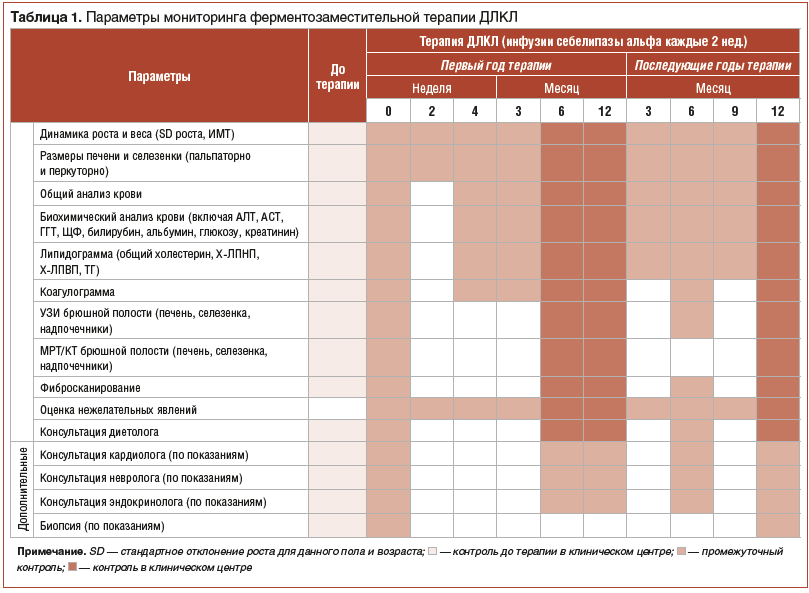
Таким образом, тщательный мониторинг с использованием предложенной схемы обследования, правильная интерпретация его результатов позволят своевременно проводить коррекцию выявленных отклонений и оптимизировать комплексное лечение.
Информация с rmj.ru





