Введение
Отсутствие статистики острых постаноксических состояний у детей в результате таких причин, как остановка сердца, утопление, механическая асфиксия и т. п., связано с относительной редкостью их развития. При этом продолжительность болезни у выживших в значительной степени зависит от сохранности неврологических функций [1, 2]. В литературе были определены паттерны реорганизации кортикоспинальных проекций, сопоставлены нейровизуализационные и нейрофункциональные данные в зависимости от клинических исходов для таких состояний, как детский церебральный паралич и перинатальное острое нарушение мозгового кровообращения [3, 4]. При этом аналогичных полномасштабных исследований постаноксических состояний не проводилось. Известно, что наиболее уязвимыми структурами головного мозга при постаноксических состояниях являются базальные ганглии [5, 6]. Дискутабельным остается вклад синаптогенеза и процесса изменения плотности проводящих путей белого вещества головного мозга в период реорганизации таламокортикальных связей после их острого повреждения, в том числе в части восстановления локомоторного акта [7]. В связи с малочисленностью публикаций вопрос прогнозирования исхода постаноксических состояний в части моторного контроля является актуальной задачей реабилитационного процесса, что послужило целью данного исследования.
Нами проведена оценка реорганизации кортикального моторного представительства (первичная моторная кора, премоторная кора, дополнительная моторная зона (ДМЗ)) и кортикоспинального тракта (КСТ) посредством морфометрии, диффузионно-взвешенной визуализации (МР-трактография) и диагностической транскраниальной магнитной стимуляции (ТМС), а также сопоставление полученных данных с клиническими исходами.
Собственные клинические наблюдения и обсуждение
Под наблюдением находились 4 ребенка с постаноксическими состояниями разного генеза, проходившие реабилитационное лечение на базе НИИ НДХиТ в период 2020–2023 гг. От законных представителей детей было получено согласие на публикацию обезличенных результатов исследований.
Пациент № 1, девочка, 3 года, постаноксическое состояние в результате утопления в пресной воде. Исследования выполнены при госпитализации в НИИ НДХиТ на 58-е сутки от развития острого постаноксического состояния и в динамике через 1 год. При поступлении: отсутствие произвольных движений, тонус по модифицированной шкале Ашфорт 5 баллов, уровень минимального сознания «–», оценка по шкале коммуникативной активности Быковой и Лукьянова (Scale Сommunication Аctivity, Bykova, Lukianov, SCABL) 26 баллов; в динамике отмечено снижение спастичности по шкале Ашфорт до 2 баллов в руках и 3 баллов в ногах с отсутствием произвольных движений; акинетический мутизм с частичным пониманием обращенной речи (оценка по SCABL 49 баллов) [8, 9].
Пациент № 2, мальчик, 9 лет, постаноксическое состояние в результате механической асфиксии, исследование выполнено через 1 мес. от развития болезни и в динамике через 1 год. Уровень сознания при поступлении — оглушение, оценка спастичности по шкале Ашфорт 4 балла в конечностях, акинетический мутизм с эмоциональными реакциями (по SCABL 45 баллов); в динамике снижение оценки по шкале Ашфорт до 2 баллов, выявлены особенности эмоционально-волевой сферы с ведущим компонентом произвольных движений и спастико-паретической дизартрией.
Пациент № 3, мальчик, 14 лет, постаноксическое состояние в результате механической асфиксии; исследование проведено через 2 года от начала болезни, в статусе: акинетический мутизм с эмоциональными реакциями и частичным пониманием обращенной речи (по SCABL 90 баллов), оценка по шкале Ашфорт 4 балла.
Пациент № 4, мальчик, 12 лет, постаноксическое состояние в результате механической асфиксии; исследование проведено через 6 мес. от начала болезни: состояние по шкале Ашфорт 4 балла, интеллектуально-мнестические нарушения и сенсомоторная афазия.
Всем детям выполнялась диагностическая ТМС с помощью монофазного магнитного стимулятора «Нейро-МС» и 2-канального миографа «нейро-МВП микро» («Нейрософт», Россия); использован кольцевой индуктор диаметром 9 см. Проекции F3 для левой и F4 для правой гемисферы стимулировались путем позиционирования койла над Cz и направлением тока в катушке против часовой стрелки для F4 и по часовой стрелке для F3 согласно международной схеме «10–20», интенсивностью от 50%, контралатерально стороне отведения моторного вызванного потенциала (МВП) [10].
Сегментарная стимуляция на уровне цервикального утолщения проводилась с предварительной оценкой минимальной латентности F-волны при чрескожной супрамаксимальной стимуляции 20 последовательными электрическими стимулами проекции хода срединного нерва на уровне запястья. Внешний диаметр нижней части койла позиционировался на уровне остистого отростка С7, интенсивность стимула от 30% с регистрацией не менее трех стабильно воспроизводимых МВП при максимально возможном мышечном расслаблении под контролем спонтанной миограммы [11].
Отведение МВП проводили накожными электродами с m. abductor pollicis brevis (m. APB) справа и слева в соответствии с контралатеральной схемой регистрации [12]. При ТМС смещение койла проводилось с шагом в 1 см, при наличии МВП определялась зона стимуляции, c дальнейшим определением моторного порога под электромиографическим онлайн-контролем спонтанной мышечной активности согласно алгоритму Rossini-Rothwell [10, 13]. Проводилась регистрация корковых МВП с интенсивностью 110–120% от моторного порога с оценкой латентности, амплитуды и площади ответа, времени центрального моторного проведения по кортикоцервикальному тракту. Порог МВП определяли по регистрации потенциала с установленной нами амплитудой не меньше 20 мкВ. Выбор более низкой амплитуды моторного ответа, чем общепринятая, обусловлен выраженным органическим поражением центральной нервной системы, сопровождавшимся при первичных исследованиях отсутствием произвольных движений со сниженным мышечным тонусом (в том числе фармакологически обусловленным; все исследуемые получали препараты с миорелаксирующим действием, учитывая оценку спастичности по шкале Ашфорт), в результате чего даже при стабильном воспроизведении МВП его амплитуда peak to peak была низкой [14].
Для морфометрии головного мозга применялась технология автоматического количественного объемного анализа головного мозга с использованием трехмерного изображения головного мозга в режиме изотропного T1-сканирования с разрешением по трем координатам — 1 мм. Сканирование выполнялось на магнитно-резонансном томографе Philips Achieva dStream 3T (Нидерланды) с применением 16-канальной головной катушки. Параметры сканирования: TFE (спин-эхо-импульсная последовательность, TR=8 мс, TE=3,7 мс, FA=8о, TI=1021 мс, FOV=240 мм, NSA=1). Количественный объемный анализ головного мозга проводился с использованием автоматизированного программного пакета vol2brain [15], позволяющего получить значения объемов серого и белого вещества головного мозга, спинномозговой жидкости, а также корковых и подкорковых структур. В данной работе анализировались объемы прецентральной извилины, ДМЗ и средней лобной извилины (верхние отделы которой анатомически соответствуют части премоторной коры головного мозга).
Для исследования КСТ первичной моторной коры и ДМЗ применялась методика диффузионно-тензорной трактографии (ДТТ). Параметры сканирования: EPI (эхо-планарная импульсная последовательность), TR=9431 мс; TE=70 мс, матрица 120/144 пикс., FOV=240 мм, размер вокселя 2×2×2 мм3, фактор ускорения EPI factor=63, gap=0, NSA=2. Диффузионные градиенты были приложены в 32 неколлинеарных направлениях. Обработку данных ДТТ проводили с помощью программного пакета MR Fiber Track в сервере программных приложений Philips Intellispace Portal. При анализе данных ДТТ оценивались следующие показатели диффузии:
измеряемый коэффициент диффузии (apparent diffusion coefficient, ADC), представляющий собой количественную оценку диффузионной способности молекулы воды в биологической ткани;
фракционная анизотропия (fractional anisotropy, FA), которая характеризует отличие диффузии в разных направлениях.
Кроме того, анализировались объем и протяженность кортикоспинальных трактов. Для полуавтоматического построения трактов проводился ручной выбор парных зон интереса в обоих полушариях:
субкортикальное белое вещество в области первичной моторной коры — латеральные отделы средней трети моста мозга;
субкортикальное белое вещество в области ДМЗ — латеральные отделы средней трети моста мозга.
Параметры МВП и времени центрального моторного проведения (ВЦМП) при ТМС с отведением с m. APB в динамике и в сравнении с нормативными показателями (по K. Muller et al. [16]), результаты морфометрического автоматического количественного объемного анализа головного мозга и МР-трактографии от ДМЗ и первичной моторной коры в динамике представлены в таблицах 1, 2 и 3.
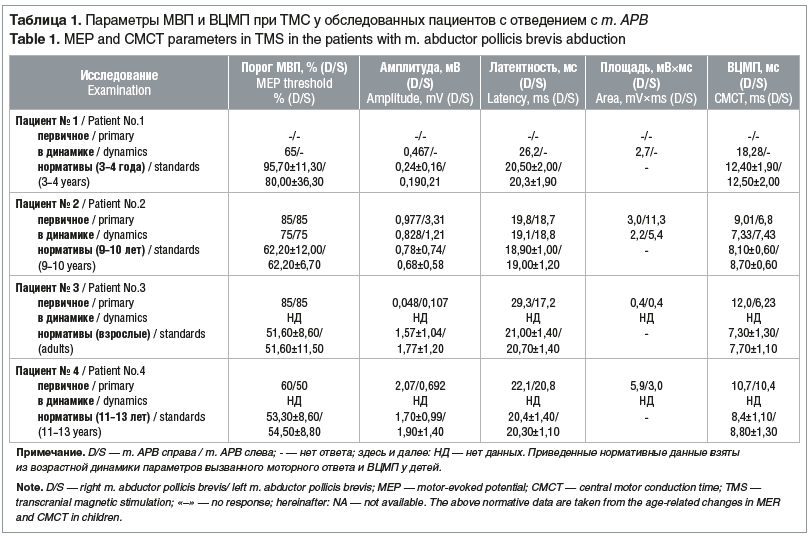
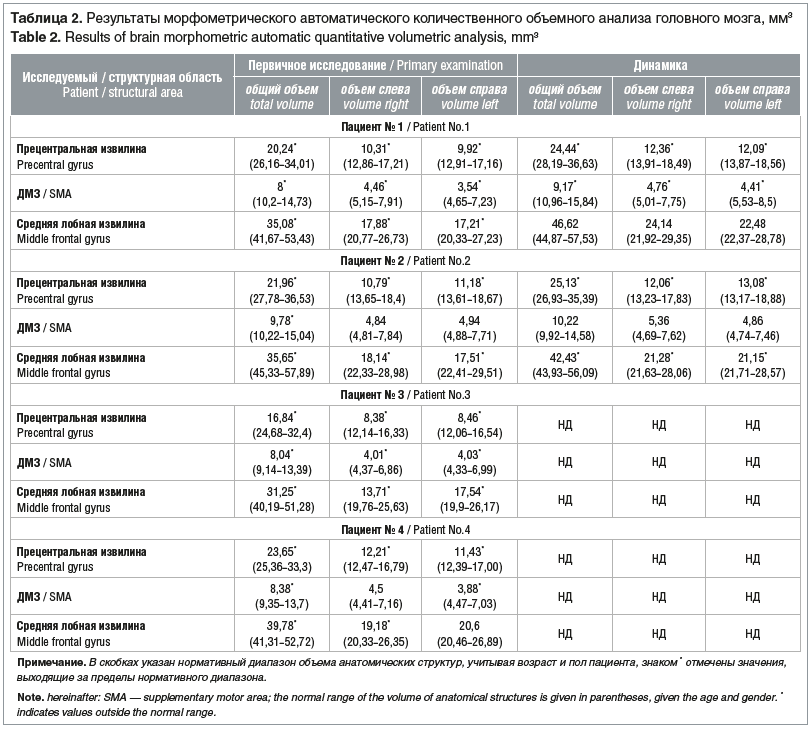
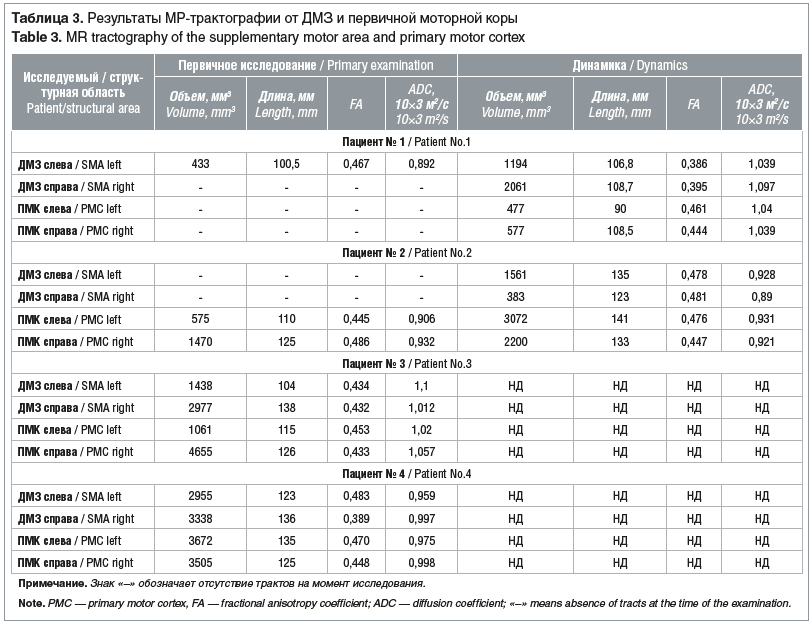
Пациент № 1 демонстрирует грубые изменения в виде атрофии кортикального моторного представительства, с постепенным восстановлением объема ДМЗ, премоторной коры и прецентральной извилины, с появлением единичных волокон КСТ через 1 год от дебюта болезни по данным МР-трактографии; также отмечена тенденция к восстановлению объема кортикоспинальных проекций от ДМЗ. При ТМС через 1 год зарегистрирован МВП с правой кисти, однако данный потенциал не отличался устойчивостью и при повторных исследованиях через 14 и 18 мес. не воспроизводился. Следует отметить, что клиническое состояние ребенка — отсутствие активных произвольных движений — было одинаковым как через 1 год от начала болезни, так и через последующие 14 и 18 мес. наблюдения, при этом отмечена положительная динамика в эмоциональных реакциях (динамика по SCABL +23 балла).
Пациент № 2 характеризуется наличием воспроизводимого в динамике МВП, с тенденцией к снижению порога МВП и асимметрией площади МВП, с преобладанием со стороны правой гемисферы. МР-трактография при первичном исследовании характеризовалась уменьшением объема КСТ от первичной моторной коры и отсутствием КСТ от ДМЗ, в динамике увеличением объема КСТ от первичной моторной коры и восстановлением тракта от ДМЗ преимущественно слева на фоне показателей морфометрии, соответствующих возрастной норме в части объема ДМЗ, и с тенденцией к восстановлению объема до показателей возрастной нормы в части первичной моторной и премоторной коры. Клинически пациент в течение первого года продемонстрировал положительную динамику в виде снижения уровня спастичности по шкале Ашфорт на 2 балла в конечностях, акинетический мутизм с эмоциональными реакциями трансформировался в особенности эмоционально-волевой сферы с ведущим компонентом произвольных движений и спастико-паретической дизартрией.
Пациент № 3 обследован однократно. По данным МР-трактографии: асимметрия КСТ с преобладанием объема и протяженности тракта справа, тракты от ДМЗ также доминируют по объему и протяженности со стороны правой гемисферы, асимметричная атрофия средних лобных извилин со значительным уменьшением объема слева и снижением показателей объема первичной моторной и премоторной коры, а также ДМЗ, что клинически соответствовало акинетическому мутизму с эмоциональными реакциями и частичным пониманием обращенной речи, спастическому тетрапарезу (по шкале Ашфорт 4 балла). Латентность МВП и ВЦМП увеличена по левому КСТ, однако клинически оценить сторонность пирамидной недостаточности невозможно в связи с выраженной спастикой и контрактурами.
Пациент № 4 обследовался однократно. По данным МР-трактографии на фоне перивентрикулярных глиозных изменений белого вещества отмечается асимметрия КСТ: тракты от ДМЗ доминируют со стороны правой гемисферы, при этом тракты от первичной моторной коры преобладают по объему и протяженности слева. По данным морфометрии: снижение общего объема первичной моторной и премоторной коры и ДМЗ; по данным ТМС: порог вызванного моторного ответа получен при наименьшей интенсивности стимула в сравнении с предыдущими двумя случаями, асимметрия площади МВП с преобладанием с левой гемисферы с симметричным увеличением ВЦМП по кортикоцервикальному тракту с обеих сторон. Клинически: оценка спастичности в конечностях по шкале Ашфорт 4 балла, интеллектуально-мнестические нарушения, сенсомоторная афазия.
Обсуждение
Мы предполагаем, что значимую роль в восстановлении КСТ играет не только объем повреждения, но и время его возникновения: в период формирования или в период совершенствования локомоторного акта, сопровождающихся процессом физиологического созревания синапсов и нейромедиаторной системы, доказанных в экспериментальных работах [7]. Кроме того, процесс реорганизации сопровождается клинико-нейрофизиологической и нейрорадиологической диссоциацией: в представленных клинических наблюдениях отмечены отсутствие восстановления произвольных движений при нормализации объемов премоторной коры в динамике с формированием единичных проекций КСТ от первичной моторной коры и восстановлением тракта от ДМЗ — пациент № 1, а также несоответствие преобладания объемов субкортикального отдела КСТ клиническим проявлениям латерализации спастического пареза — пациенты № 2 и 4.
Нейровизуализационный анализ 10 случаев постгипоксического состояния у детей после утопления продемонстрировал преимущественно поражение бассейна лентикуло-стриарной кровеносной системы и вторичные дегенеративные изменения проводящих путей головного мозга в области базальных ганглиев и задних ножек внутренней капсулы (posterior limb of internal capsule, PLIC) [6]. Ядра базальных ганглиев участвуют в передаче моторной информации и произвольных движениях, PLIC в основном состоят из волокон КСТ, несущих двигательную информацию от первичной моторной коры к спинному мозгу, что клинически коррелировало с моторными исходами у пациентов [6]. Считается, что созревание областей, обслуживающих моторные (и сенсорные) функции, предшествует созреванию областей мозга, лежащих в основе высших когнитивных функций [17]. Таким образом, дети младшего возраста могут выдержать меньшее прямое повреждение мозговых сетей высшего порядка, которые остаются относительно незрелыми, и больший ущерб более «примитивным» и развитым двигательным сетям. В серии наших клинических наблюдений отмечено, что сохранение интеллектуально-мнестической недостаточности превалирует у детей в динамике даже при тенденции к восстановлению моторного контроля (пациенты № 2 и 4). Тем не менее относительная сохранность других мозговых сетей повышает вероятность того, что эти дети сохранят существенные когнитивные, перцептивные и эмоциональные способности и не смогут эффективно передать эту функциональную целостность из-за повреждения двигательной системы, что мы могли наблюдать у пациента № 1 [6]. Наличие когнитивного дефицита как последствия постаноксических состояний является значимой медицинской проблемой не только в детской, но и во взрослой популяции, сказываясь на сроках и качестве реабилитационных мероприятий [18, 19].
Несмотря на то, что анализ значений FA позволил выявить преобладание повреждения глубокого центрального белого вещества преимущественно в зоне прохождения КСТ, оценка данного параметра должна быть взвешенной в связи с возможной погрешностью, обусловленной значительным количеством перекрещивающихся волокон, влияющих на математический анализ сигнала. Данная погрешность может отражаться в клинико-нейровизуализационной диссоциации, что было отмечено и нашем исследовании. Применение вероятностных алгоритмов трактографии для оценки организации проводящих путей является одним из потенциальных способов решения данной проблемы. Еще одним перспективным методом обследования пациентов с постанокcическим характером поражения головного мозга после утопления является МР-спектроскопия лентикулостриарной системы [6]. В серии наших клинических наблюдений отмечается лучший прогноз восстановления моторной функции при регистрации МВП большей площади и с меньшим значением порога МВП (пациенты № 2 и 4). Также мы должны констатировать, что тенденция к восстановлению объемов премоторной зоны у ребенка, утратившего моторный навык в результате асфиксии в возрасте становления и закрепления локомоторного акта, не привела в последующем к восстановлению объема КСТ и функции произвольных движений (пациент № 1).
Заключение
Представленные клинические наблюдения демонстрируют способность к восстановлению объема кортикоспинальных моторных проекций у пациентов, имевших меньший объем атрофических изменений первичной моторной, премоторной коры и ДМЗ, а также стабильно воспроизводимый МВП большей площади при меньших значениях порога МВП. Пациенты с выраженными атрофическими изменениями первичной моторной коры имели худший прогноз восстановления даже при сохранности и увеличении объема пирамидных трактов в динамике. Период реорганизации КСТ сопровождается клинико-нейровизуализационной и нейрофизиологической диссоциацией, в связи с чем прогноз восстановления на основании функциональных методов исследования должен быть взвешенным. Представленные наблюдения, скорее, подтверждают ведущую роль сохранности синаптогенеза вне атрофических изменений структур головного мозга в восстановлении двигательной функции у пациентов со сформированным локомоторным актом относительно плотности пирамидных трактов в период реорганизации.
Сведения об авторах:
Каньшина Дарья Сергеевна — к.м.н., ведущий научный сотрудник отдела функциональной диагностики НИИ НДХиТ; 119180, Россия, г. Москва, ул. Большая Полянка, д. 22; ORCID iD 0000-0002-5142-9400.
Ублинский Максим Вадимович — к.б.н., научный сотрудник НИИ НДХиТ; 119180, Россия, г. Москва, ул. Большая Полянка, д. 22; ORCID iD 0000-0002-4627-9874.
Мельников Илья Андреевич — к.м.н., старший научный сотрудник, заведующий отделением магнитно-резонансной и компьютерной томографии НИИ НДХиТ; 119180, Россия, г. Москва, ул. Большая Полянка, д. 22; ORCID iD 0000-0002-2910-3711.
Валлиулина Светлана Альбертовна — д.м.н., профессор, руководитель отдела реабилитации НИИ НДХиТ; 119180, Россия, г. Москва, ул. Большая Полянка, д. 22; ORCID iD 0000-0002-1622-0169.
Ахадов Толибджон Абдуллаевич — д.м.н., профессор, руководитель отдела лучевых методов диагностики НИИ НДХиТ; 119180, Россия, г. Москва, ул. Большая Полянка, д. 22; ORCID iD 0000-0002-3235-8854.
Никитин Сергей Сергеевич — профессор, д.м.н., заведующий кафедрой генетики неврологических болезней ИВДПО ФГБНУ «МГНЦ»; 115522, Россия, г. Москва, ул. Москворечье, д. 1; ORCID iD 0000-0003-3292-2758.
Зыков Валерий Петрович — д.м.н., профессор, заведующий кафедрой неврологии детского возраста ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1; ORCID iD 0000-0002-1401-5479.
Дрожевская Екатерина Евгеньевна — врач-консультант по клинической нейрофизиологии отделения неврологии NNUH NHS Foundation Trust; NR4 7UY UK, Colney Lane, Norwich, UK; ORCID iD 0009-0005-3851-4263.
Контактная информация: Каньшина Дарья Сергеевна, e-mail: dr.d.kanshina@gmail.com.
Прозрачность финансовой деятельности: исследование поддержано грантом Департамента здравоохранения Москвы № 2112-9.
Конфликт интересов отсутствует.
Статья поступила 17.06.2024.
Поступила после рецензирования 10.07.2024.
Принята в печать 02.08.2024.
About the authors:
Darya S. Kan’shina — C. Sc. (Med.), leading researcher of the Division of Functional Diagnostics, Research Institute of Emergency Pediatric Surgery and Traumatology; 22, Bolshaya Polyanka str., Moscow, 119180, Russian Federation; ORCID iD 0000-0002-5142-9400.
Maksim V. Ublinskiy — C. Sc. (Biol.), leading researcher, Research Institute of Emergency Pediatric Surgery and Traumatology; 22, Bolshaya Polyanka str., Moscow, 119180, Russian Federation; ORCID iD 0000-0002-4627-9874.
Ilya A. Mel’nikov — C. Sc. (Med.), senior researcher, Head of the Department of MRI and CT, Research Institute of Emergency Pediatric Surgery and Traumatology; 22, Bolshaya Polyanka str., Moscow, 119180, Russian Federation; ORCID iD 0000-0002-2910-3711.
Svetlana A. Valliulina — Dr. Sc. (Med.), Professor, Head of the Division of Rehabilitation, Research Institute of Emergency Pediatric Surgery and Traumatology; 22, Bolshaya Polyanka str., Moscow, 119180, Russian Federation; ORCID iD 0000-0002-1622-0169.
Tolibdzhon A. Akhadov — Dr. Sc. (Med.), Professor, Head of the Division of Radiation Diagnostics, Research Institute of Emergency Pediatric Surgery and Traumatology; 22, Bolshaya Polyanka str., Moscow, 119180, Russian Federation; ORCID iD 0000-0002-3235-8854.
Sergey S. Nikitin — Dr. Sc. (Med.), Professor, Head of the Department of the Genetics of Neurological Diseases, Research Center for Medical Genetics; 1, Moskvorechye str., Moscow, 115522, Russian Federation; ORCID iD 0000-0003-3292-2758.
Valeriy P. Zykov — Dr. Sc. (Med.), Professor, Head of the Department of Pediatric Neurology, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002-1401-5479.
Ekaterina E. Drozhevskaya — consultant physician in clinical neurophysiology at the Department of Neurology, NNUH NHS Foundation Trust; NR4 7UY UK, Colney Lane, Norwich, UK; ORCID iD 0009-0005-3851-4263.
Contact information: Darya S. Kan’shina, e-mail: dr.d.kanshina@gmail.com.
Financial Disclosure: the study was supported by the Moscow Department of Health Grant number 2112-9.
There is no conflict of interest.
Received 17.06.2024.
Revised 10.07.2024.
Accepted 02.08.2024.
Информация с rmj.ru






