Введение
Наследственная оптическая нейропатия Лебера (НОНЛ) — наследственное митохондриальное заболевание, которое приводит к поражению, главным образом, ганглиозных клеток сетчатки, снижая их способность генерировать достаточное количество энергии для нормальной жизнедеятельности клетки. Частота встречаемости составляет от 1:27 000 до 1:45 000. Обычно заболевание приводит к двусторонней безболезненной утрате зрения. НОНЛ начинает развиваться в возрасте 20–40 лет, у 90% людей, теряющих зрение, это происходит до 50 лет. Острое или подострое двустороннее снижение зрения происходит одновременно на обоих глазах или поочередно с интервалом 2–6 мес. Безболезненное течение заболевания усложняет его быструю диагностику. У мужчин НОНЛ встречается в 4–5 раз чаще, чем у женщин, хотя пол и мутационный статус не оказывают значительного влияния на сроки и степень первоначальной потери зрения.
К развитию НОНЛ приводят патогенные мутации в митохондриальной ДНК, заболевание передается исключительно по материнской линии [1–3]. Более чем в 90% случаев причиной заболевания является одна из трех первичных митохондриальных мутаций: m.3460G>A (MTND1), m.11778G>A (MTND4) и m.14484T>C (MTND6) [4–6]. В последние годы были описаны рецессивные формы НОНЛ, вызванные мутациями в генах DNAJC30, MCAT, MECR и NDUFS2 [7–11]. Все вышеперечисленные мутации приводят к нарушению функции комплекса I дыхательной цепи митохондрий, вследствие чего снижается выработка АТФ, усиливается перекисное окисление липидов и избирательно поражаются ганглиозные клетки сетчатки. Однако симптомы проявляются не у всех носителей мутаций из-за вариабельной гетероплазмии тканей. Генетические факторы и условия окружающей среды, включая травмы, токсины, стресс и курение, а также иммунные аспекты влияют на клиническую картину и прогрессирование заболевания [12].
Содержание статьи
На сегодняшний день известно два основных подхода к лечению НОНЛ: разработка генной терапии и патогенетическая терапия.
В многоцентровом рандомизированном двойном слепом плацебо-контролируемом клиническом исследовании III фазы RESCUE оценивали эффективность применения в качестве генной терапии единственной интравитреальной инъекции rAAV2/2-ND4 в один глаз у пациентов с мутацией m.11778G>A в течение 6 мес. после начала потери зрения. В результате исследования было продемонстрировано неожиданное двустороннее частичное улучшение зрения у пациентов, получивших одностороннюю генную терапию НОНЛ. Это улучшение могло быть обусловлено как эффективностью лечения, так и естественным течением заболевания, эффектом обучения и другими факторами [13].
В качестве патогенетической терапии применяют препарат идебенон, одобренный Food and Drug Administration (FDA), представляющий собой мощный антиоксидант, стимулирующий функцию митохондрий минуя I дыхательную цепь и восстанавливающий выработку АТФ [14, 15]. Проводимое с 2016 по 2021 г. международное многоцентровое исследование LEROS (ClinicalTrials.gov NCT02774005) подтвердило долгосрочную эффективность идебенона в дозе 900 мг/сут в подострой/динамической и хронической фазах [16].
Недавнее исследование продемонстрировало улучшение зрительных функций, восприятия цветов и контрастной чувствительности при местном применении эламипретида у 12 пациентов с НОНЛ, при этом серьезные побочные эффекты не наблюдались [17]. Эламипретид — небольшой тетрапептид, который воздействует на митохондрии и проявляет терапевтический эффект, будучи безопасным для лечения ряда заболеваний, связанных с митохондриальной дисфункцией. В контексте нейродегенеративных заболеваний обширные исследования свидетельствуют о том, что эламипретид улучшает митохондриальное дыхание, активирует митохондриальный биогенез в нейронах благодаря регуляторам митохондриального биогенеза (peroxisome proliferator-activated receptor-gamma coactivator-1 alpha (PCG-1α) и mitochondrial transcription factor A (TFAM)) и факторам транслокации (белок внешней митохондриальной мембраны TOM-20), а также усиливает процессы слияния митохондрий (митохондриальный нуклеотидный фактор 1 (MNF-1), MNF-2 и динамин-подобная ГТФаза (OPA-1)), подавляет их деление (митохондриальный белок деления 1 (FIS-1) и связанный с динамином белок 1 (DRP-1)) и способствует митофагии, что делает этот препарат перспективным для лечения НОНЛ и требует дальнейших исследований [18].
Клиническое наблюдение
В Оренбургский филиал ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России в ноябре 2023 г. обратился пациент А. 32 лет с жалобами на снижение зрения левого глаза, «пятно в центре» в течение последних 3 мес. К офтальмологу ранее не обращался. Наследственный анамнез не отягощен: родители здоровы, по отцовской и материнской линии клинических проявлений заболевания не было. Комплексное клинико-функциональное обследование пациента включало визометрию, периметрию, компьютерную периметрию, авторефрактометрию, офтальмоскопию, фоторегистрацию глазного дна, оптическую когерентную томографию (ОКТ) макулярной зоны и диска зрительного нерва (ДЗН). В ФГБНУ «МГНЦ» выполнено молекулярно-генетическое тестирование методом мультиплексной лигазной цепной реакции (MLPA) на частые мутации НОНЛ.
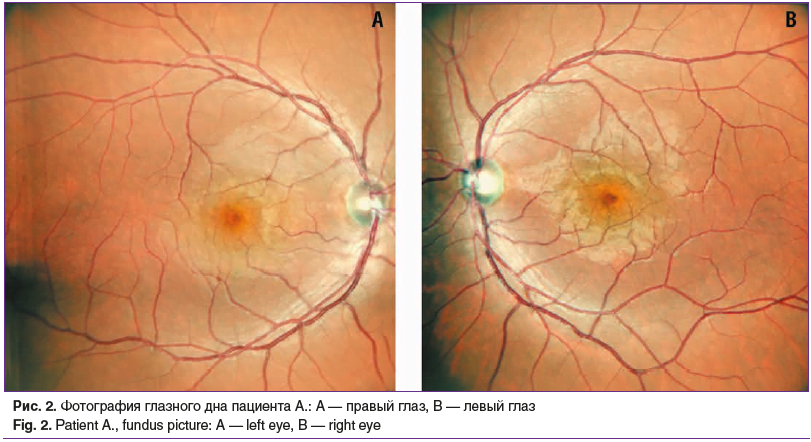
Острота зрения с максимально возможной коррекцией на момент обращения составила ОD=0,5, не корригирует, OS=0,05, не корригирует. Данные пневмотонометрии: внутриглазное давление (ВГД) правого глаза 17 мм рт. ст., левого глаза — 19 мм рт. ст. Проведена периметрия по Ферстеру, отмечалась центральная абсолютная скотома на правом глазу, жалоб на которую пациент не предъявлял (рис. 1). В результате проведения компьютерной периметрии (PTS 2000, Optopol Technology, Польша) получены следующие данные: OD — светочувствительность сетчатки (МS) снижена, локализация дефектов светочувствительности во всех секторах, множественные абсолютные скотомы в секторах 5–30°; ОS — светочувствительность сетчатки (МS) снижена, локализация дефектов светочувствительности в верхневисочном, верхненосовом, нижненосовом секторах, абсолютные скотомы в секторах 5–30°. Оптические среды прозрачные, при офтальмоскопии глазное дно правого глаза без особенностей: ДЗН бледно-розовый, контуры четкие, артерии, вены не изменены, макулярная область без особенностей; на левом глазу: ДЗН деколорирован, контуры четкие, артерии, вены не изменены, зона макулы в норме (рис. 2). По данным ОКТ (Optovue SOLIX, Optovue, США) правого глаза толщина перипапиллярных волокон в норме, отмечалось незначительное уменьшение толщины аксонов ганглиозных клеток; на левом глазу значительное истончение перипапиллярных волокон и уменьшение толщины клеток ганглиозного слоя сетчатки (рис. 3). В результате проведенных исследований был установлен предварительный диагноз: нисходящая частичная атрофия зрительного нерва(?). Рекомендовано обследование у невролога, магнитно-резонансная томография (МРТ) головного мозга и орбит.
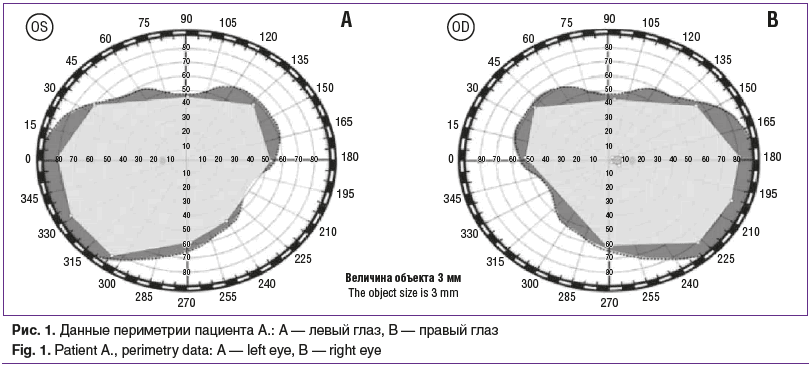
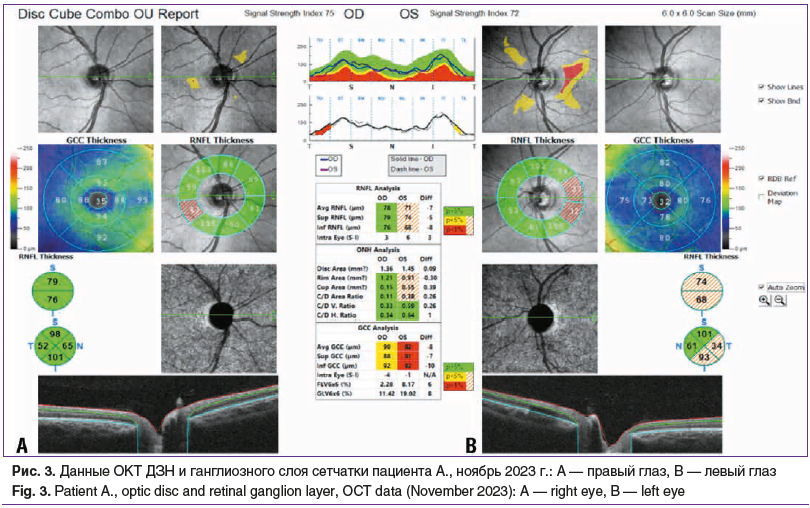
Повторно с результатами дополнительного обследования пациент обратился через 3 мес., в феврале 2024 г. По результатам МРТ головного мозга с контрастным усилением обнаружены признаки расширения периваскулярных пространств, отмечалась зона структурных изменений левой половины аденогипофиза, подозрительная на микроаденому. Неврологом рекомендовано динамическое наблюдение, контроль состояния гипофиза с помощью МРТ. К жалобам на снижение зрения левого глаза присоединились жалобы на ухудшение зрения правого глаза. Острота зрения при повторном обращении ОD=0,1, не корригирует, OS=0,05, не корригирует. При проверке цветового восприятия с помощью полихроматических таблиц Е.Б. Рабкина у пациента выявлена выраженная дисхроматопсия на обоих глазах. По данным ОКТ сетчатки и зрительного нерва на обоих глазах наблюдалось значительное истончение перипапиллярных волокон и уменьшение толщины клеток ганглиозного слоя сетчатки (рис. 4). Отмечалась отрицательная динамика. На основании анамнестических данных и данных дополнительных методов исследования пациенту установлен диагноз: OU — частичная атрофия зрительного нерва неясного генеза, наследственная оптическая нейропатия Лебера (?).

Назначена антиоксидантная, нейропротективная и метаболическая терапия. Рекомендовано генетическое исследование крови для исключения НОНЛ. Результат молекулярно-генетического исследования был получен в апреле 2024 г., спустя 6 мес. от первичного обращения пациента. Методом MLPA пациенту проведен тест на частые мутации, вызывающие НОНЛ. Мутаций m.3460G>A, m.14484T>C, m.11778G>A, m.3697 G>A, m.10197G>A, m.14459G>A, m.13513G>A, m.13051G>A, m.3472T>C, m.10663T>C, m.14482C>A/G, m.14495A>G, m.14502T>C, m.14568C>T, m.3376G>A, m.3635G>A, m.3700G>A, m.3733G>A не обнаружено. Дополнительно было проведено исследование частой мутации в гене DNAJC30: NM_032317:с.152 A>G (p.Y51C), вызывающей аутосомно-рецессивную форму НОНЛ (OMIM 619982). Данная мутация выявлена в гомозиготном состоянии [19].
Обсуждение
Клинические проявления НОНЛ разнообразны. В представленном клиническом наблюдении на этапе первичного обследования пациента было необходимо проведение дифференциальной диагностики между НОНЛ и другими возможными причинами нисходящей оптической атрофии. Среди возможных причин развившегося состояния рассматривали оптический неврит, ассоциированный с воспалительными процессами; токсико-метаболические нейропатии (например, алкогольную или медикаментозную); компрессионные процессы, обусловленные опухолевыми образованиями или сосудистыми аномалиями; аутоиммунные поражения зрительного нерва. Проведенное клинико-функциональное обследование, ОКТ и МРТ головного мозга исключили признаки воспалительного процесса или структурных изменений, свидетельствуя в пользу дегенеративной природы патологии. Отсутствие улучшения после коррекции состояния пациента, нарастание симптоматики и двустороннее ухудшение зрения подтвердили высокую вероятность наследственного характера заболевания. Кроме того, у пациента наблюдались специфические нарушения зрения, такие как центральная или центроцекальная скотомы, обусловленные повреждением папилломакулярного пучка, характерные для НОНЛ [20, 21]. Окончательно диагноз был подтвержден данными молекулярно-генетического тестирования методом MLPA, с помощью которого возможно выявление частых точечных мутаций в митохондриальной ДНК, ответственных за развитие НОНЛ.
Таким образом, клиническая картина НОНЛ может быть довольно разнообразной и схожей с симптомами других оптических невритов различного генеза. Это разнообразие проявлений может затруднить установление точного диагноза и, как следствие, отсрочить назначение корректного лечения. Н.Л. Шеремет и соавт. [22] разработали метод ранней диагностики НОНЛ с помощью ОКТ, позволяющий на ранних стадиях дифференцировать это заболевание от других видов оптической нейропатии в зависимости от толщины слоев нервных волокон и ганглиозных клеток сетчатки. Позже Н.Л. Шеремет и соавт. [23] предложили способ диагностики НОНЛ с использованием культуры фибробластов, в которую добавляли на определенное время паракват с последующей оценкой количества живых фибробластов по флуоресцентному сигналу. Если живых клеток оказывалось ≥50% по сравнению с нормальными значениями, диагностировали НОНЛ. Тем не менее на сегодняшний день самым точным методом диагностики НОНЛ остается молекулярно-генетическое тестирование.
Заключение
Представленное клиническое наблюдение демонстрирует сложность диагностики НОНЛ, основным и наиболее надежным методом которой на сегодняшний день остается молекулярно-генетическое тестирование. Однако этот метод, хотя и обладает высокой точностью в идентификации мутаций, вследствие которых развивается заболевание, характеризуется относительно высокой стоимостью и продолжительным временем выполнения анализа. Именно поэтому необходимо сосредоточить усилия на разработке более доступных и менее затратных методов диагностики НОНЛ. Перспективным направлением может стать поиск биомаркеров — например, идентификация специфических молекул или связей, присутствующих в крови или других биологических жидкостях, характерных именно для этого заболевания.
Сведения об авторах:
Чупров Александр Дмитриевич — д.м.н., профессор, директор Оренбургского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 460047, Россия, г. Оренбург, ул. Салмышская, д. 17; заведующий кафедрой медико-биологической
техники Оренбургского государственного университета; 460018, Россия, г. Оренбург, пр-т Победы, д. 13; ORCID iD 0000-0001-7011-4220
Пидодний Екатерина Александровна — заведующая отделением диагностики Оренбургского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 460047, Россия, г. Оренбург, ул. Салмышская, д. 17; ORCID iD 0000-0001-9945-3293
Контактная информация: Пидодний Екатерина Александровна; e-mail: nauka@ofmntk.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 20.12.2024.
Поступила после рецензирования 14.01.2025.
Принята в печать 06.02.2025.
About the authors:
Alexander D. Chuprov — Dr. Sc. (Med.), Professor, Director of the Orenburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 17, Salmyshskaya str., Orenburg, 460047, Russian Federation; Head of the Department of Biomedical Engineering, Orenburg State University; 13, Pobedy Ave., Orenburg, 460018, Russian Federation; ORCID iD 0000-0001-7011-4220
Ekaterina A. Pidodnii — Head of the Diagnostic Department, Orenburg Branch of the S. Fyodorov Eye Microsurgery Federal State Institution; 17, Salmyshskaya str., Orenburg, 460047, Russian Federation; ORCID iD 0000-0001-9945-3293
Contact information: Ekaterina A. Pidodnii; e-mail: nauka@ofmntk.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
Conflict of interest: no conflict of interest.
Received 20.12.2024.
Revised 14.01.2025.
Accepted 06.02.2025.
материал rmj.ru
