Введение
Детский церебральный паралич (ДЦП) — группа стабильных нарушений развития моторики и поддержания позы, которые формируют двигательные дефекты и обусловлены непрогрессирующим повреждением и/или аномалией развивающегося головного мозга у плода или новорожденного [1]. Одно из основных направлений помощи детям с ДЦП составляют реабилитационные мероприятия, призванные улучшить общее самочувствие, моторные навыки и качество жизни в целом. Их эффективность зависит от состояния пищевого статуса и обеспеченности организма ребенка макронутриентами и энергией. В связи с высокой встречаемостью трудностей при приеме пищи, стоматологических проблем (тугоподвижность челюстей, нарушения тонуса и движений губ, неправильный прикус), нарушения процесса глотания (дисфагия/орофарингеальная дисфункция) пациенты с ДЦП составляют группу риска по нутритивной недостаточности [2–4]. Этому также способствуют изменения мышечного тонуса и, как следствие, неправильное положение тела при кормлении, что повышает риск аэрофагии, нарушений работы желудочно-кишечного тракта (ЖКТ), которые встречаются у 92% пациентов и могут проявляться в виде гастроэзофагеального рефлюкса (до 70%) и нарушений характера стула (до 70%).
Доказано, что у детей с ДЦП, испытывающих трудности при кормлении, в первые 5 лет жизни регистрируется задержка роста [5]. Дети с оромоторной дисфункцией в 3–10 раз чаще имеют дефицит массы тела по сравнению с другими детьми с ДЦП [6, 7]. Данные из разных стран показывают, что длительный дефицит нутриентов у детей с ДЦП обусловливает повышение инфекционной заболеваемости, низкое качество жизни и преждевременный летальный исход [8, 9]. Пищевой статус влияет на самочувствие ребенка, формирование моторных навыков и эффективность реабилитационных мероприятий.
Таким образом, дети с ДЦП нуждаются в регулярном мониторинге пищевого статуса и его коррекции при выявлении нарушений. Подход к диетотерапии должен бы персонифицированным. Нутритивная поддержка в настоящее время рассматривается как приоритетный и обязательный компонент диетологической коррекции и лечения детей с ДЦП. При выборе энтерального продукта для нутритивной поддержки необходимо учитывать наличие задержки физического развития, дефицита пула белка (соматического, висцерального), степень дефицита массы тела, характер проводимых реабилитационных мероприятий, сопутствующую патологию со стороны ЖКТ и наличие дисфагии [10–12]. Адекватно подобранная нутритивная поддержка, являющаяся основой диетотерпии, — залог эффективного ведения пациентов данной группы.
Цель исследования: оценить эффективность использования полуэлементной смеси при нутритивной поддержке детей с ДЦП, имеющих дефицит массы тела и гастроинтестинальные симптомы.
Материал и методы
Проведено открытое проспективное исследование, одобренное локальным комитетом по этике ФГБУН «ФИЦ питания и биотехнологии». Исследование соответствует принципам, изложенным в декларации Хельсинкского соглашения. От всех родителей детей либо их опекунов получено информированное согласие на участие в исследовании.
В отделении педиатрической гастроэнтерологии, гепатологии и диетотерапии клиники ФГБУН «ФИЦ питания и биотехнологии» обследовано 27 детей, из них 19 (70,4%) девочек, с установленным диагнозом ДЦП в возрасте от 2 до 18 лет (медиана возраста 11,3 [2; 17,2] года).
Питание через гастростому получали 3 (11,1%) ребенка,
24 (88,9%) — питались через рот (per os).
Критерии включения в исследование: подтвержденный диагноз ДЦП; возраст от 2 до 18 лет; наличие дефицита массы тела различной степени; наличие гастроинтестинальных симптомов (абдоминальный болевой синдром, метеоризм, сниженный/избирательный аппетит, срыгивания/рвота, изменение характера и частоты стула).
Критерии невключения: наследственные заболевания, сопровождающиеся двигательными нарушениями, нарушениями мышечного тонуса, низкорослостью и низкой массой тела; целиакия; экзокринная недостаточность поджелудочной железы; заболевания эндокринной системы.
Учитывая наличие у пациентов дефицита массы тела различной степени и гастроинтестинальных симптомов, в качестве нутритивной поддержки была использована полуэлементная смесь на основе гидролизата белка молочной сыворотки с высоким содержанием среднецепочечных триглицеридов (Пептамен® Юниор, Nestle). Объем нутритивной поддержки рассчитывался индивидуально для каждого пациента с учетом выраженности дефицита массы тела. При дефиците массы тела легкой степени объем лечебной смеси составлял 400 мл/сут, при дефиците массы тела средней и тяжелой степени — 600 мл/сут. Продукт использовали в качестве обогащения основного рациона в дополнительные приемы пищи. Расчет необходимой энергетической ценности рациона у пациентов I–III классов по GMFCS (Gross Motor Function Classification System) осуществляли с учетом рекомендованных возрастных потребностей в пищевых веществах и энергии [13]. При IV–V классе моторных нарушений по GMFCS расчет энергетической ценности рациона проводили по методу Крика с учетом состояния мышечного тонуса, двигательной активности и желаемой прибавки массы тела за сутки.
Эффективность диетотерапии оценивали через 6 мес. по антропометрическим показателям и наличию гастроинтестинальных симптомов.
Всем детям проведены: антропометрия (измерение массы тела и линейного роста), измерение окружности плеча, толщины кожной складки над трицепсом (ТКСТ) и бицепсом (ТКСБ).
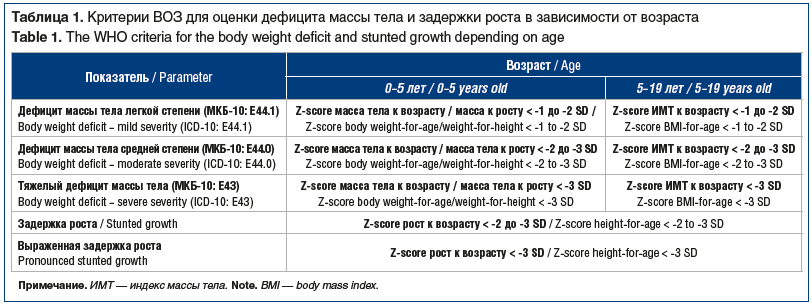
Оценку антропометрических данных осуществляли с использованием центильных таблиц, разработанных для пациентов с ДЦП с учетом пола, класса моторной активности по GMFCS и способа питания — через рот (per os) или через назогастральный зонд/стому (tube feed) [14]. Полученные центильные показатели конвертированы в сигмальные отклонения Z-score для определения нарушений физического развития согласно рекомендациям ВОЗ (табл. 1) [15].
Измерение ТКСТ и ТКСБ проводили методом калиперометрии.
Изучение состава тела выполняли методом биоимпедансометрии на портативном анализаторе компонентного состава тела InBody S10 (Biospace Co. Ltd., Корея) в утренние часы после 2-часового голодания. По техническим причинам исследование было проведено только 19 детям. Определяли количество тощей массы (ТМ), активной клеточной массы (АКМ), жировой массы (ЖМ), относительное количество жировой массы (ЖМ%), показатели общей воды организма (ОВО), вне- и внутриклеточной жидкости.
Уровень базовой энергетической потребности (БЭП) рассчитывали по формулам Schofield (WH) и Harris — Benedict, разработанным для детского возраста.
Статистическую обработку результатов исследования проводили с использованием программы Statistica 10.0 for Windows. Количественные результаты представлены в виде медианы (Ме) и интерквартильного размаха [LQ25; UQ75]. Качественные признаки описывали с помощью абсолютных и относительных показателей. Для анализа количественных показателей зависимых групп использовали критерий знаковых рангов Вилкоксона, для анализа качественных показателей — точный тест Фишера для небольших выборок. Уровень значимости считался достоверным при p<0,05.
Результаты
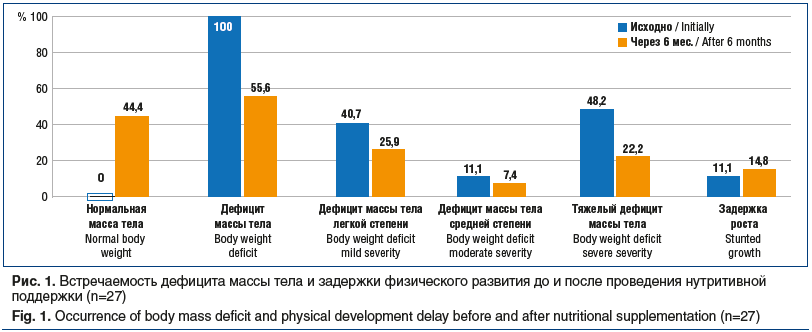
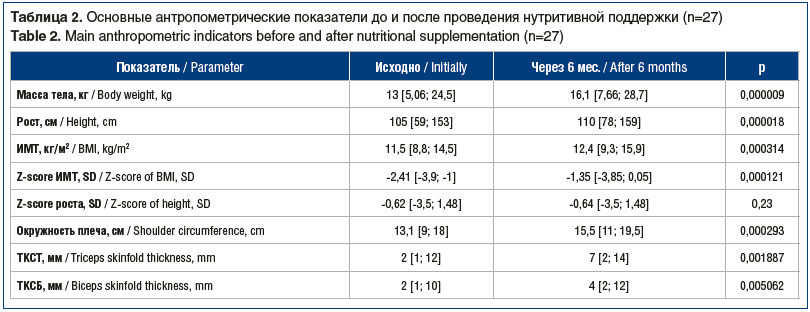
Все дети, включенные в исследование, имели дефицит массы тела. Медиана массы тела составила 13 [5,06; 24,5] кг, ИМТ — 11,5 [8,8; 14,5] кг/м2, Z-score ИМТ — -2,41 [-3,9; -1], расчетного показателя окружности мышц плеча — 13,1 [9; 18] см. Дефицит массы тела легкой, средней и тяжелой степени зарегистрирован у 11 (40,7%), 3 (11,1%) и 13 (48,2%) детей соответственно (рис. 1). При этом задержка роста (Z-score рост к возрасту <-2) диагностирована у 3 (11,1%) пациентов. Медиана роста составила 105 [59; 153] см, медиана Z-score роста — -0,62 [-3,5;1,48] (табл. 2).
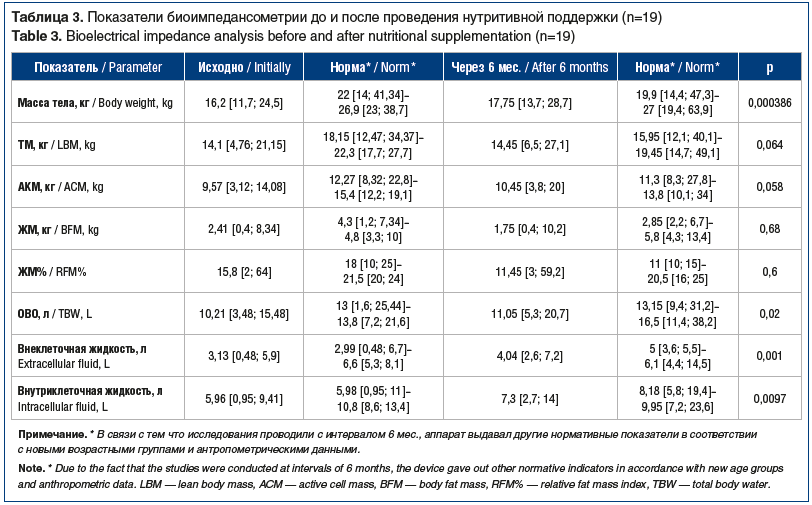
При исследовании компонентного состава тела методом биоимпедансометрии (n=19) отмечалось снижение относительно индивидуальной нормы практически всех показателей: массы тела, ТМ, АКМ, ЖМ, ЖМ%, ОВО и внутриклеточной жидкости (табл. 3).
Выявленное различие в показателях БЭП, рассчитанных по формулам Schofield (WH) и Harris — Benedict, связано с отличиями возрастных групп, применяемых в формуле Schofield (WH), и было статистически незначимым (табл. 4), что свидетельствует о возможности использования любой формулы при расчете показателей основного обмена.

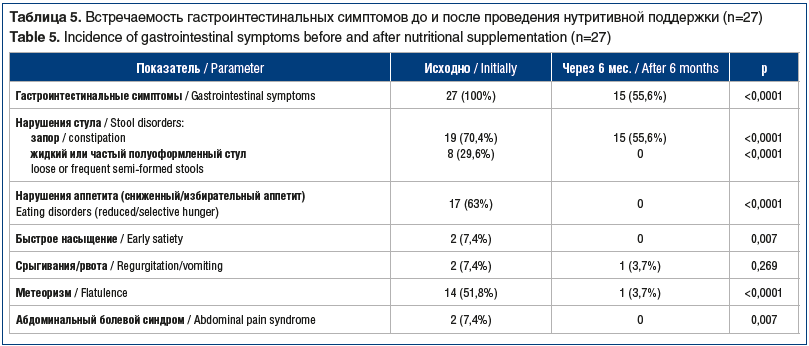
При первом осмотре различные гастроинтестинальные симптомы выявлены у всех детей. Чаще всего имели место нарушения характера стула: запор (задержка стула более 48 ч), жидкий или частый полуоформленный стул. Дискомфорт в животе, связанный с метеоризмом, и сниженный/избирательный аппетит наблюдались в 51,8% и 63% случаев. Быстрое насыщение, срыгивания или рвота и абдоминальный болевой синдром отмечались реже (табл. 5).
При повторном осмотре через 6 мес. нутритивной поддержки полуэлементной смесью у 12 (44,4%) детей показатели массы тела соответствовали возрастной норме. Дефицит массы тела различной степени сохранялся у 15 (55,6%) пациентов, при этом тяжелый дефицит массы тела регистрировался только у 6 (22,2%) детей (см. рис. 1). Диапазон прибавки массы тела составил от 0,5 до 8,4 кг (медиана 2,5 [0,5; 8,4] кг). У детей с легким дефицитом массы тела прибавка массы тела составила 0,5–5,2 кг (медиана 2,25 [0,5; 5,2] кг), со средним дефицитом массы тела —
2,5–7,7 кг (медиана 3,2 [2,5; 7,7] кг), с тяжелым дефицитом массы тела — 0,5–8,4 кг (медиана 2,2 [0,5; 8,4] кг). Задержка роста по Z-score диагностирована у 4 (14,8%) пациентов. Увеличение числа детей с задержкой роста связано с переходом в другую возрастную категорию пациента
V класса моторной активности по GMFCS.
На фоне нутритивной поддержки отмечено статистически значимое (p<0,05) увеличение показателей массы тела, ИМТ, Z-score ИМТ, ТСКТ и ТКСБ (см. табл. 2). Увеличение показателей окружности мышц плеча от 13,1 до 15,5 см (р=0,000293) свидетельствует об увеличении соматического пула белка. Показатели биоимпедансометрии также продемонстрировали статистически значимую положительную динамику композиционного состава тела (p<0,05). На фоне увеличения мышечной массы отмечена редукция ЖМ (p>0,05) (см. табл. 3).
Увеличение массы тела за счет АКМ сопровождалось статистически значимым (р=0,000006) повышением расчетных величин БЭП, полученных как по формуле Schofield (WH), так и по формуле Harris — Benedict
(см. табл. 4).
У 12 (44,4%) детей гастроинтестинальные симптомы были купированы, у 15 (55,6%) — сохранялась задержка стула (запор). У одного (3,7%) ребенка, относившегося
к V классу по GMFCS, задержка стула сочеталась с метеоризмом и срыгиваниями (см. табл. 5).
Обсуждение
Пациенты с ДЦП составляют группу риска по нутритивной недостаточности в связи с высокой встречаемостью трудностей в процессе приема пищи, связанных с нарушением жевания, глотания, а также из-за употребления однообразной пищи определенной текстуры и консистенции. Несоответствие энергетической ценности рациона энерготратам и дефицит макронутриентов, в первую очередь белка, приводят к задержке физического развития, недостаточной прибавке массы тела, саркопении, снижению эффективности реабилитационных мероприятий и низкому качеству жизни. Среди детей с ДЦП распространенность дефицита массы тела, по разным данным, составляет от 40 до 70% [2, 16]. В связи с этим нутритивная поддержка является обязательным компонентом комплекса реабилитационных мероприятий у таких детей.
Исходно у 48,2% детей, включенных в исследование, был зарегистрирован дефицит массы тела тяжелой степени. Анализ компонентов состава тела показал, что дефицит массы тела был обусловлен дефицитом ТМ, АКМ, абсолютного и относительного количества ЖМ, снижением ОВО и внутриклеточной жидкости. Полученные данные не противоречат многочисленным исследованиям, подтверждающим негативное влияние алиментарного дефицита на процессы роста и развития детей [17–21]. В исследовании A.R. Almuneef et al. [21] при анализе антропометрических данных 74 детей с ДЦП дефицит массы тела отмечен более чем в 50% случаев. В ряде исследований продемонстрировано снижение уровня основного обмена по сравнению с возрастными нормами у детей с ДЦП на фоне нутритивного дефицита, особенно при тяжелом дефиците массы тела [22, 23].
Среди детей с ДЦП часто выявляются изменения в работе ЖКТ: оральная, фарингеальная или эзофагеальная дисфагия, гастроэзофагеальная рефлюксная болезнь, гастроинтестинальная пищевая аллергия, срыгивания, рвота, запоры и др. По данным зарубежных авторов, встречаемость дисфагии составляет 99%, запоров — 26%, рвоты — 22% [16]. При первичном осмотре детей, включенных в наше исследование, гастроинтестинальные симптомы были преимущественно представлены нарушениями характера и частоты стула в виде запоров (70,4%), изменением аппетита (сниженный/избирательный аппетит; 63%) и явлениями метеоризма (51,8%). В связи с наличием гастроинтестинальных симптомов, а также тяжелой недостаточности питания в 48,2% случаев, на фоне которой снижаются функциональные возможности ЖКТ, в качестве нутритивной поддержки был использован полуэлементный продукт на основе гидролизата сывороточного белка коровьего молока, содержащий в своем составе среднецепочечные триглицериды, без лактозы [24].
При повторном осмотре через 6 мес. на фоне нутритивной поддержки полуэлементной смесью у 12 (44,4%) детей показатели массы тела соответствовали возрастной норме. Дефицит массы тела различной степени сохранялся у 15 (55,6%) пациентов, при этом тяжелый дефицит массы тела регистрировался только у 6 (22,2%) детей. Полученное увеличение показателей окружности мышц плеча свидетельствует об увеличении соматического пула белка, что было подтверждено результатами биоимпедансометрии. Проведенная нутритивная поддержка обеспечила достоверное увеличение массы тела за счет ТМ, АКМ и способствовала росту БЭП. Повышение показателей массы тела, окружности мышц плеча, АКМ и БЭП говорит об адекватности проводимой нутритивной поддержки и достаточном обеспечении организма белком и энергией [15, 22].
Полученные данные подтверждают данные A.A. García-Contreras et al. [23], которые показали, что увеличение ТМ благоприятно влияет на уровень БЭП и является критерием эффективности проводимой диетотерапии.
Гастроинтестинальные симптомы были купированы у 12 (44,4%) детей, у 15 (55,6%) — сохранялась задержка стула (запор). У одного (3,7%) ребенка запор сочетался с метеоризмом и срыгиваниями. K. Savage et al. [24] также описали эффективность использования полуэлементной смеси на основе гидролизата сывороточного белка коровьего молока в сочетании с коррекцией рациона у пациентов с ДЦП. На фоне проводимой диетотерапии отмечались снижение частоты гастроинтестинальных проявлений и положительная динамика антропометрических показателей. Также в ряде исследований подтверждено положительное влияние белкового компонента пищи, представленного гидролизатом белка молочной сыворотки, на скорость эвакуации содержимого из желудка, что является благоприятным фактором при лечении гастроэзофагеального рефлюкса [25–28].
Заключение
Пациенты с ДЦП относятся к группе риска по нарушениям нутритивного статуса, главным образом, недостаточности питания. Профилактика и коррекция нарушений нутритивного статуса у детей с ДЦП требует дифференцированного подхода с учетом физического развития, степени дефицита массы тела и состояния ЖКТ. Результаты проведенного исследования демонстрируют высокую эффективность нутритивной поддержки полуэлементной смесью у детей с ДЦП, имеющих дефицит массы тела и гастроинтестинальные симптомы, что подтверждается положительной динамикой антропометрических показателей за счет ТМ, АКМ, увеличением БЭП и снижением частоты гастроинтестинальных проявлений. Таким образом, диетологические мероприятия являются важной составной частью комплексного лечения и реабилитации детей с ДЦП.
Благодарность
Редакция благодарит компанию Nestle за оказанную помощь в технической редактуре настоящей публикации.
Acknowledgment
Editorial Board is grateful to Nestle for the assistance in technical edition of this publication.
Сведения об авторах:
Титова Ольга Николаевна — аспирант отделения педиатрической гастроэнтерологии, гепатологии и диетотерапии, ФГБУН «ФИЦ питания и биотехнологии», 115446, Россия, г. Москва, Каширское шоссе, д. 21, ORCID iD 0000-0002-5876-8472.
Таран Наталия Николаевна — к.м.н., старший научный сотрудник отделения педиатрической гастроэнтерологии, гепатологии и диетотерапии, ФГБУН «ФИЦ питания и биотехнологии», 115446, Россия, г. Москва, Каширское шоссе, д. 21; ассистент кафедры гастроэнтерологии и диетологии ФДПО, ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, 117997, Россия, г. Москва, ул. Островитянова, д. 1, ORCID iD 0000-0001-9557-387Х.
Строкова Татьяна Викторовна — д.м.н., профессор РАН, заведующая отделением педиатрической гастроэнтерологии, гепатологии и диетотерапии, ФГБУН «ФИЦ питания и биотехнологии», 115446, Россия, г. Москва, Каширское шоссе, д. 21; заведующая кафедрой гастроэнтерологии и диетологии ФДПО, ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, 117997, Россия, г. Москва, ул. Островитянова, д. 1, ORCID iD 0000-0002-0762-0873.
Павловская Елена Вячеславовна — к.м.н., ведущий научный сотрудник отделения педиатрической гастроэнтерологии, гепатологии и диетотерапии, ФГБУН «ФИЦ питания и биотехнологии», 115446, Россия, г. Москва,
Каширское шоссе д. 21, ORCID iD 0000-0002-4505-397Х.
Келейникова Антонина Вячеславовна — аспирант отделения педиатрической гастроэнтерологии, гепатологии и диетотерапии, ФГБУН «ФИЦ питания и биотехнологии», 115446, Россия, г. Москва, Каширское шоссе, д. 21, ORCID iD 0000-0003-0567-6643.
Матинян Ирина Александровна — к.м.н., научный сотрудник отделения педиатрической гастроэнтерологии, гепатологии и диетотерапии, ФГБУН «ФИЦ питания
и биотехнологии», 115446, Россия, г. Москва, Каширское шоссе, д. 21, ORCID iD 0000-0002-58768472.
Контактная информация: Таран Наталия Николаевна, e-mail: pknt@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 14.08.2020, поступила после рецензирования 28.08.2020, принята в печать 11.09.2020.
About the authors:
Olga N. Titova — post-graduate student of the Department of Pediatric Gastroenterology, Hepatology and Nutrition, Federal Research Centre of Nutrition, Biotechnology and Food Safety: 21, Kashirskoe road, Moscow, 115446, Russian Federation, ORCID iD 0000-0002-5876-8472.
Natalia N. Taran — Cand. of Sci. (Med), Senior Researcher of the Department of Pediatric Gastroenterology, Hepatology and Nutrition, Federal Research Centre of Nutrition, Biotechnology and Food Safety: 21, Kashirskoe road, Moscow, 115446, Russian Federation; Assistant Professor of the Department of Gastroenterology and Nutrition, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation, ORCID iD 0000-0001-9557-387Х.
Tatiana V. Strokova — Dr. of Sci. (Med), Professor of the Russian Academy of Sciences, Head of the Department of Pediatric Gastroenterology, Hepatology and Nutrition, Federal Research Centre of Nutrition, Biotechnology and Food Safety: 21, Kashirskoe road, Moscow, 115446, Russian Federation; Head of the Department of Gastroenterology and Nutrition, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation, ORCID iD 0000-0002-9900-4073.
Elena V. Pavlovskaya — Cand. of Sci. (Med), Leading Researcher of the Department of Pediatric Gastroenterology, Hepatology and Nutrition, Federal Research Centre of Nutrition, Biotechnology and Food Safety: 21, Kashirskoe road, Moscow, 115446, Russian Federation, ORCID iD 0000-0002-4505-397X.
Antonina V. Keleynikova — post-graduate student of the Department of Pediatric Gastroenterology, Hepatology and Nutrition, Federal Research Centre of Nutrition, Biotechnology and Food Safety: 21, Kashirskoe road, Moscow, 115446, Russian Federation, ORCID iD 0000-0003-0567-6643.
Irina A. Matinyan — Cand. of Sci. (Med), Researcher of the Department of Pediatric Gastroenterology, Hepatology and Nutrition, Federal Research Centre of Nutrition, Biotechnology and Food Safety: 21, Kashirskoe road, Moscow, 115446, Russian Federation, ORCID iD 0000-0002-5876-8472.
Contact information: Natalia N. Taran, e-mail: pknt@mail.ru Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 14.08.2020, revised 28.08.2020, accepted 11.09.2020.
.
Информация с rmj.ru






