Введение
Среди инфекций, передающихся при укусах клещей, в России преобладают клещевой энцефалит (КЭ), иксодовый клещевой боррелиоз (ИКБ) и клещевой риккетсиоз (КР) [1]. Последний, согласно формам федерального статистического наблюдения Росстата «Сведения об инфекционных и паразитарных заболеваниях», регистрируется как «сибирский клещевой тиф» (СКТ) [2]. В Сибири и на Дальнем Востоке циркулируют два возбудителя КР — Rickettsia sibirica и Rickettsia heilongjiangensis [3]. В Новосибирской области в 2021 г. зарегистрировано 84, а в 2022 г. — 179 случаев КР, при этом увеличилась заболеваемость среди детей [1].
В настоящее время в России диагностика КР базируется в основном на данных эпидемиологического анамнеза (пребывание на эндемичной территории, контакт с клещами во время эпидемического сезона), клинической манифестации (лихорадка, наличие первичного аффекта на месте присасывания клеща, регионарного лимфаденита, розеолезно-папулезной экзантемы, появляющейся в первые дни болезни). При отсутствии первичного аффекта и/или регионарного лимфаденита и тем более при отсутствии в анамнезе факта присасывания или наползания клеща КР трудно диагностировать [4]. Серологическая диагностика КР малодоступна для практических лабораторий. При этом серологические методы позволяют выявить антитела к возбудителям КР лишь через 7–15 дней от начала заболевания, что задерживает установление диагноза и начало адекватной антибактериальной терапии [5]. В настоящее время для диагностики клещевых инфекций, в том числе КР, успешно применяют полимеразную цепную реакцию (ПЦР) — высокочувствительный метод, позволяющий обнаружить генетический материал возбудителей данных заболеваний. Выявление ДНК риккетсий в крови и других клинических образцах (смыв с первичного аффекта, моча, аутопсийный материал) [6] позволяет подтвердить диагноз «клещевой риккетсиоз» [7].
У большинства пациентов КР протекает доброкачественно, с выздоровлением после лечения тетрациклином или доксициклином [8]. Однако в редких случаях КР может иметь злокачественное течение, связанное с развитием осложнений, приводящих к летальному исходу [9]. Доступность быстрых и точных методов лабораторной диагностики КР обеспечивает оптимальное ведение пациентов и своевременное выздоровление.
Представляем клиническое наблюдение КР с летальным исходом у жительницы Новосибирской области, диагностированного с использованием современных молекулярных методов в 2022 г.
Содержание статьи
Клиническое наблюдение
Пациентка К., 67 лет, проживавшая в поселке Голубой Залив Новосибирской области, поступила 22.07.2022 (на 5-й день заболевания) в ГБУЗ НСО «НОКИБ». Из данных эпидемиологического анамнеза известно, что с 04.07.2022 по 12.07.2022 находилась на отдыхе в Горном Алтае, присасывание или наползание клещей не отмечала, против КЭ не вакцинирована. Заболевание началось остро 17.07.2022 с резкого повышения температуры до 39 °C с ознобом, выраженной слабости, сонливости, которые сохранялись на 2-й день болезни. На 3-и сутки появились рвота 2 раза за сутки, головная боль, сохранялись лихорадка до 40 °C и слабость. С 4-го дня болезни самостоятельно начала принимать препарат амоксициллин + клавулановая кислота в дозе 875 мг + 125 мг 2 р/сут. В связи с отсутствием улучшения состояния госпитализирована.
При поступлении в стационар температура тела 38,3 °C, состояние тяжелое, выражена слабость, головная боль, гиперестезия. Пациентка была в сознании, на вопросы отвечала правильно. При осмотре кожные покровы чистые, первичного аффекта не обнаружено, периферические лимфатические узлы не пальпировались, частота дыхательных движений (ЧДД) 18 в 1 мин, артериальное давление (АД) 150/95 мм рт. ст., частота сердечных сокращений 86 в 1 мин, отмечалась сомнительная ригидность затылочных мышц.
На основании данных эпидемиологического анамнеза (пребывание летом на эндемичной по клещевым инфекциям территории), наличия фебрильной лихорадки в течение 5 дней, общемозговой симптоматики (головная боль, повторная рвота), сомнительных менингеальных знаков установлен предварительный диагноз: клещевой энцефалит, менингеальная форма, тяжелой степени тяжести. Сопутствующий диагноз: ишемическая болезнь сердца: постинфарктный кардиосклероз по данным электрокардиографии неизвестной давности. Гипертоническая болезнь 3-й стадии. Хроническая сердечная недостаточность 2Б, функциональный класс 3. Хроническая болезнь почек С 3а. Нефропатия сложного генеза (гипертонического, атеросклеротического). Ожирение (индекс массы тела 29,4 кг/м2).
По результатам общего анализа крови (ОАК) выявлены: лейкоцитоз 9,1×109/л со сдвигом формулы влево до палочкоядерных форм (21%); тромбоцитопения 95×109/л. Общий анализ мочи без изменений. При биохимическом анализе крови отмечены: гиперазотемия (мочевина 11,4 ммоль/л, креатинин 221 ммоль/л); синдром воспалительной реакции (С-реактивный белок (СРБ) 104,5 мг/л). По данным анализа цереброспинальной жидкости: плеоцитоз 18 кл/мкл, нейтрофилы 44,7%, лимфоциты 55,3%, белок 0,1 г/л; глюкоза 4,2 ммоль/л. По данным рентгенографии органов грудной клетки (ОГК) — без очаговых и инфильтративных изменений.
Проведен забор крови для исследования на клещевые трансмиссивные инфекции: КЭ, ИКБ, КР и Ку-лихорадку. Лечение включало трансфузию противоклещевой плазмы, дексаметазон 16 мг/сут внутривенно, инфузионную терапию для поддержания нормоволемии, антибактериальную терапию (цефтриаксон 4,0 г/сут внутримышечно). На 7-й день болезни на фоне проводимого лечения у пациентки отмечена отрицательная динамика в виде сохраняющегося интоксикационно-лихорадочного синдрома: лихорадка в вечернее время до 40 °C, трудно поддающаяся жаропонижающей терапии; прогрессирование менингеального симптомокомплекса (сохраняющаяся ригидность затылочных мышц, жалобы на чувство тошноты, рвоту однократно на фоне лихорадки, выраженную головную боль); появление экзантемы (множественной пятнисто-папулезной сыпи, полиморфной, с тенденцией к слиянию, без кожного зуда); увеличение подчелюстных, подмышечных лимфатических узлов размером до 1,0 см по короткой оси, безболезненных при пальпации.
По данным ПЦР в крови на 7-й день болезни обнаружена ДНК R. sibirica, проведена коррекция антибактериальной терапии: доксициклин 200 мг/сут внутривенно. На 9-е сутки болезни в вечернее время на фоне фебрильной температуры 38,5 °C, сохраняющейся экзантемы отмечена отрицательная динамика в виде прогрессирования неврологической симптоматики (сонливость, сенсорная, моторная и амнестическая афазия) и появления дыхательной недостаточности (одышка с ЧДД до 25 в 1 мин, снижение сатурации до 88%), в связи с чем пациентка переведена в отделение реанимации и интенсивной терапии (ОРИТ).
В ОРИТ вновь проведено лабораторное обследование. По данным ОАК: лейкоцитоз 27,6×109/л, сохранялся сдвиг лейкоцитарной формулы (палочкоядерные формы лейкоцитов до 16%); отмечена токсическая зернистость нейтрофилов (ТЗН) +++; прогрессировала тромбоцитопения до 20×109/л. Результаты биохимического исследования крови указывали на синдром цитолиза с преобладанием активности АСТ (АЛТ 40 МЕ/л, АСТ 104 МЕ/л); гипербилирубинемию с преобладанием прямой фракции (общий билирубин 27 ммоль/л, прямой билирубин 17,8 ммоль/л); гиперазотемию (мочевина 11,6 ммоль/л, креатинин 125 ммоль/л); гипопротеинемию, гипоальбуминемию (общий белок 50 г/л, альбумин 25 г/л); синдром воспалительной реакции (СРБ до 82,2 мг/л, прокальцитонин 2,8 нг/мл). Проведено бактериологическое исследование крови на стерильность, патогенные возбудители не обнаружены. При повторном исследовании ликвора сохранялся незначительный плеоцитоз до 15 кл/мкл, содержание нейтрофилов составило 41,8%, лимфоцитов — 58,2%, белка — 0,8 г/л; глюкозы — 4,7 ммоль/л. По данным рентгенографии ОГК — признаки двухсторонней полисегментарной пневмонии.
Несмотря на проведение интенсивной антибактериальной, гормональной, антитромботической, симптоматической терапии, на 10-й день болезни отмечено прогрессирование церебральной и дыхательной недостаточности. Пациентка была переведена на ИВЛ, и в тот же день наступил летальный исход.
По результатам патологоанатомического исследования был установлен диагноз: серозный менингит, двухсторонняя полисегментарная пневмония, интерстициальный гепатит, межуточный нефрит. Осложнения: отек и набухание головного мозга, отек легких, выраженные дистрофические изменения и застой во внутренних органах с формированием некрозов в почках и печени.
Гистологическое исследование
Головной мозг: периваскулярное и перицеллюлярное разрежение нейропиля; лимфоцитарно-плазмоцитарная рассеянная инфильтрация нейропиля, периваскулярная, в стенках сосудов; неравномерное полнокровие сосудов; присутствие клеток, нагруженных пигментом (рис. 1–4).
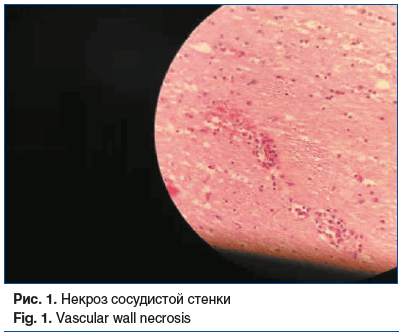
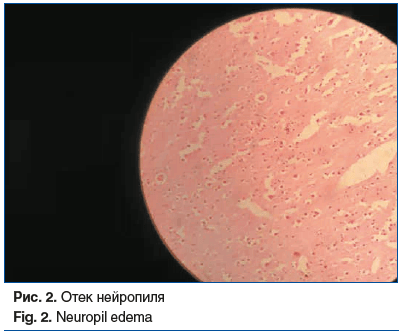
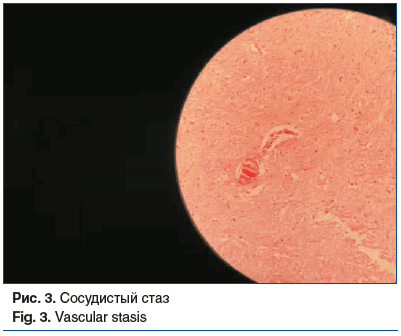

Миокард: кардиомиоциты увеличены в объеме; периваскулярно определяется избыточное содержание соединительной ткани с формированием широкополостных структур и футляров с замуровыванием кардиомиоцитов.
Почки: сосуды мелкого калибра с облитерацией просвета; канальцевый эпителий в состоянии гидропической дистрофии, неразличимого клеточного строения; в строме диффузно-очаговая лимфоцитарная инфильтрация.
Легкие: органная структура изменена; выраженное полнокровие сосудов венозного и артериального типов; альвеолы расширены, содержат лимфоциты и сегментоядерные лейкоциты; межальвеолярные перегородки утолщены.
Печень: органная структура изменена в силу плохо различимого клеточного строения гепатоцитов, диффузно-очаговой лимфоцитарной инфильтрации в портальных трактах и строме.
Аналитические данные лабораторных исследований
С целью установления этиологии заболевания при поступлении (на 5-й день заболевания) применен комплексный подход с использованием иммуноферментного анализа и ПЦР в режиме реального времени (ПЦР-РВ) для выявления в клинических образцах пациентки (моча, ликвор, кровь) серологических и генетических маркеров возбудителей инфекций, передаваемых клещами, циркулирующих в регионах Западной Сибири. По данным проведенных исследований, в сыворотке крови отсутствовали антитела (IgM и IgG) к вирусу КЭ, возбудителям ИКБ и Ку-лихорадки, а также РНК и ДНК этих возбудителей в образцах лейкоцитарной фракции крови (ЛФК), ликворе и образцах мочи. Дополнительные исследования при помощи ПЦР не выявили ДНК Borrelia miyamotoi, возбудителей гранулоцитарного анаплазмоза человека и моноцитарного эрлихиоза человека. При этом данные, полученные при ПЦР с помощью теста «РеалБест ДНК Rickettsia species» (АО «Вектор-Бест», Россия), свидетельствовали о наличии ДНК риккетсии в образце суммарной нуклеиновой кислоты (НК), выделенной из ЛФК. Нагрузка ДНК возбудителя в постановочном образце была довольно ощутимой. Так, при постановке ПЦР-РВ значения порогового цикла (Ct) варьировали в пределах 30–31 (рис. 5А), что соответствует разбросу количества генетического материала риккетсий (фрагмента гена gltA) от 1000 до 500 геномов на реакцию соответственно. Учитывая объем анализируемой цельной крови, используемый для получения ЛФК, объем элюции НК при выделении из пробы, а также используемый при постановке ПЦР-РВ объем выделенной НК, подсчитали, что в 1 мл крови лихорадящего пациента могло содержаться от 1750 до 3500 риккетсий. Несмотря на такую высокую концентрацию возбудителя в кровотоке, ДНК риккетсий не удалось детектировать в ликворе и моче. Отсутствие генетического материала возбудителя в моче может косвенно свидетельствовать о плохой элиминации его из организма.

Проведенное дальнейшее исследование с помощью набора реагентов «РеалБест ДНК Rickettsia sibirica / Rickettsia heilongjiangensis» (АО «Вектор-Бест», Россия), позволяющего с помощью ПЦР-РВ дифференцировать циркулирующие на территории Сибири и Дальнего Востока два патогенных вида риккетсий, установило наличие в крови пациентки ДНК R. sibirica, возбудителя СКТ.
Для анализа также получен секционный (аутопсийный) материал, образцы тканей мягкой оболочки головного мозга. Исследование, проведенное с помощью ПЦР-теста «РеалБест ДНК Rickettsia species» (АО «Вектор-Бест», Россия), также свидетельствовало о наличии в исследуемых образцах ткани ДНК риккетсий с высокой нагрузкой (Сt=23) (рис. 5В).
С целью подтверждения положительных результатов ПЦР-анализа проведена дополнительная амплификация ДНК риккетсий (выделенная из секционного материала) по 4 фрагментам генов: gltA (длиной 1180 п.н.), ompA (315 п.н.), ompB (810 п.н.), sca4 (582 п.н.), с использованием соответствующих комбинаций праймеров. Амплификаты соответствующей длины всех четырех исследуемых фрагментов генов были успешно наработаны (рис. 6), что подтверждало наличие ДНК риккетсии в тканях головного мозга умершей.
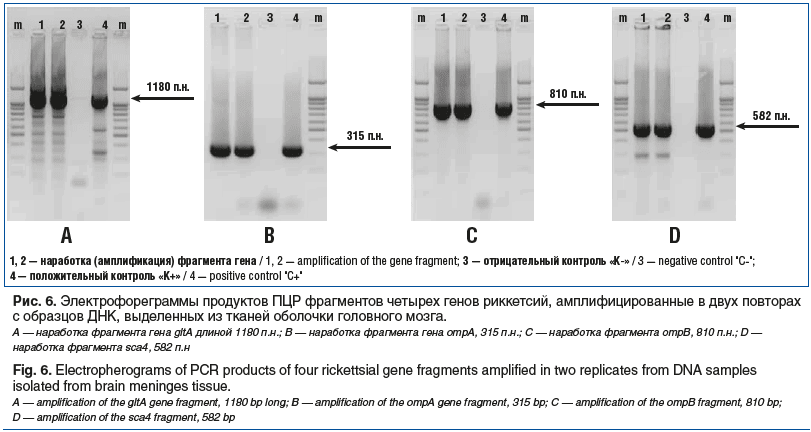
Далее полученные фрагменты указанных выше четырех генов, наработанные с образцов ДНК риккетсий, выделенных из образцов ткани оболочки мозга, были успешно секвенированы.
Результаты молекулярно-генетического анализа с использованием программы BLAST (URL: https://blast.ncbi.nlm.nih.gov/Blast.cgi) показали, что полученные нами последовательности соответствуют последовательностям ДНК R. sibirica, возбудителя КР.
Ранее было показано, что на территории Западной Сибири возбудителями клещевых риккетсиозов являются риккетсии R. sibirica, R. heilongjiangensis, R. helvetica, R. raoultii и Candidatus R. tarasevichiae [10], поэтому для дальнейшего анализа использовали фрагменты соответствующих генов данных видов риккетсий, выявленных в Западной Сибири, из базы данных GenBank (URL: https://www.ncbi.nlm.nih.gov/nucleotide/). Дендрограммы, построенные методом максимального правдоподобия на основании последовательностей фрагментов генов gltA, ompA, ompB и sca4, показали, что все исследуемые изоляты образуют кластеры на дендрограммах с Rickettsia sibirica.
Для дополнительного исследования секционный материал направлен в референс-центр мониторинга риккетсиозов ФБУН «Омский НИИ природно-очаговых инфекций» Роспотребнадзора. Сотрудниками референс-центра разработан комплексный молекулярно-биологический подход для верификации возбудителя, основанный на использовании ПЦР с праймерами к специфическим фрагментам генов различных видов риккетсий с последующим секвенированием полученных ампликонов. В тканях мозговых оболочек подтверждено наличие ДНК R. sibirica.
Все клинические образцы оказались отрицательными по данным ПЦР для выявления РНК возбудителя новой коронавирусной инфекции.
Обсуждение
Неблагоприятный исход при КР, вызванном R. sibirica, — исключительно редкое явление. Описанный выше случай КР с летальным исходом, подтвержденный молекулярно-биологическими методами, — второй в 2022 г., зарегистрированный на территории Западной Сибири. Первый описан у пациента, проживавшего в Минусинском районе Красноярского края, занимавшегося выпасом скота [9]. У пострадавшего в анамнезе зафиксирован факт присасывания клеща, отмечалось позднее поступление в стационар (на 10-е сутки болезни), а на следующий день — развитие осложнения в виде отека головного мозга. ДНК R. sibirica обнаружена во всех отделах головного мозга (кроме ствола), а также в легком, сердце, почках, селезенке, печени, что было ожидаемо при КР как генерализованной инфекции.
В случае со смертельным исходом у пациентки из Новосибирской области анализировался материал, полученный только из головного мозга. При этом в связи с высокой нагрузкой возбудителя в крови развились полисегментарная пневмония и серозный менингит. Неблагоприятному исходу заболевания могли способствовать позднее поступление в стационар (на 5-е сутки болезни) и соответственно этому запоздалое подтверждение КР (ДНК риккетсий методом ПЦР крови были обнаружены лишь на 7-е сутки болезни). В связи с этим отсутствовала адекватная антибактериальная терапия препаратами тетрациклинового ряда на ранних этапах болезни. В развитии летального исхода также важную роль сыграло наличие фоновой патологии: ишемической болезни сердца, постинфарктного кардиосклероза, гипертонической болезни, хронической сердечной недостаточности, хронической болезни почек, ожирения как известных факторов риска тяжелого течения инфекционных заболеваний.
Заключение
Летальные исходы КР регистрируются крайне редко и только в случаях отсутствия должной и своевременной диагностики. Отсутствие верификации этиологического фактора заболевания приводит к его гиподиагностике и, как следствие, позднему назначению соответствующего антибактериального препарата с внутриклеточным проникновением антибиотика, что требуется при данном заболевании. Полученные данные свидетельствуют о необходимости внедрения молекулярных методов диагностики в клиническую практику в эндемичных регионах. У пациентов с подозрением на инфекцию, передающуюся клещами, до установления этиологии заболевания целесообразно для стартовой антибактериальной терапии использовать препарат из группы тетрациклинов, обладающий высокой эффективностью в отношении внутриклеточных возбудителей.
Сведения об авторах:
Вяжевич Анна Николаевна — ассистент кафедры инфекционных болезней ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; врач-инфекционист ГБУЗ НСО «НОКИБ»; 630531, Россия, Новосибирская обл., м. р-н Новосибирский, с. п. Станционный сельсовет, пос. Садовый, тер. Ключевой жилмассив, ул. Березовая, д. 15; ORCID iD 0000-0002-6387-3939
Краснова Елена Игоревна — врач-инфекционист, д.м.н., профессор, заведующая кафедрой инфекционных болезней ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0003-2625-5442
Бондаренко Евгений Иванович — к.м.н., научный сотрудник лаборатории ПЦР, АО «Вектор-Бест»; 630559, Россия, Новосибирская обл., р. п. Кольцово, Научно-производственная зона, к. 36, ком. 211; ORCID iD 0000-0002-4699-9548
Позднякова Лариса Леонидовна — к.м.н., главный врач ГБУЗ НСО «НОКИБ»; 630531, Россия, Новосибирская обл., м. р-н Новосибирский, с. п. Станционный сельсовет, пос. Садовый, тер. Ключевой жилмассив, ул. Березовая, д. 15.
Проворова Вероника Валерьевна — врач-инфекционист, к.м.н., доцент кафедры инфекционных болезней ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0002-3475-9934
Шпынов Станислав Николаевич — д.м.н., главный научный сотрудник лаборатории зоонозных инфекций с группой клещевых риккетсиозов ФБУН «Омский НИИ природно-очаговых инфекций» Роспотребнадзора; 644050, Россия, г. Омск, пр-т Мира, д. 7; ORCID iD 0000-0002-4550-3459
Шишкова Ольга Михайловна — врач-патологоанатом ГБУЗ НСО «НОКИБ»; 630531, Россия, Новосибирская обл., м. р-н Новосибирский, с. п. Станционный сельсовет, пос. Садовый, тер. Ключевой жилмассив, ул. Березовая, д. 15.
Хохлова Наталья Игоревна — врач-инфекционист, к.м.н., доцент кафедры инфекционных болезней ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0003-4497-3173
Контактная информация: Вяжевич Анна Николаевна e-mail: dr.anna.oleynik@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 20.08.2025.
Поступила после рецензирования 12.09.2025.
Принята в печать 07.10.2025.
About the authors:
Anna N. Vyazhevich — Assistant Professor of the Department of Infectious Diseases, Novosibirsk State Medical University; 52, Krasny Ave, Novosibirsk, Novosibirsk Region, 630091, Russian Federation; infectious disease physician, Novosibirsk Regional Clinical Infectious Diseases Hospital; 15, Berezovaya str., Klyuchevoy Residential Area, Sadovy Settlement, Station Village Council, Novosibirsk Municipal District, Novosibirsk Region, 630531, Russian Federation; ORCID iD 0000-0002-6387-3939
Elena I. Krasnova — infectious disease physician, Dr. Sc. (Med.), Professor, Head of the Department of Infectious Diseases, Novosibirsk State Medical University; 52, Krasny Ave., Novosibirsk, Novosibirsk Region, 630091, Russian Federation; ORCID iD 0000-0003-2625-5442
Evgeniy I. Bondarenko — C. Sc. (Med.), Researcher, PCR Laboratory, «Vector-Best» JSC; office 211, build. 36, Research and Production Zone, Koltsovo Work Settlement, Novosibirsk Region, 630559, Russian Federation; ORCID iD 0000-0002-4699-9548
Larisa L. Pozdnyakova — C. Sc. (Med.), Chief Medical Officer of the Novosibirsk Regional Clinical Infectious Diseases Hospital; 15, Berezovaya str., Klyuchevoy Residential Area, Sadovy Settlement, Station Village Council, Novosibirsk
Municipal District, Novosibirsk Region, 630531, Russian Federation.
Veronika V. Provorova — Infectious Disease Physician, C. Sc. (Med.), Associate Professor, Department of Infectious Diseases, Novosibirsk State Medical University; 52, Krasny Ave., Novosibirsk, Novosibirsk Region, 630091, Russian Federation; ORCID iD 0000-0002-3475-9934
Stanislav N. Shpynov — Dr. Sc. (Med.), Chief Researcher, Laboratory of Zoonotic Infections with a Group for Tick-borne Rickettsioses, Omsk Research Institute of Natural Focal Infections of Rospotrebnadzor; 7, Mira Ave., Omsk, Omsk Region, 644050, Russian Federation; ORCID iD 0000-0002-4550-3459
Olga M. Shishkova — pathologist, Novosibirsk Regional Clinical Infectious Diseases Hospital; 15, Berezovaya str., Klyuchevoy Residential Area, Sadovy Settlement, Station Village Council, Novosibirsk Municipal District, Novosibirsk Region, 630531, Russian Federation.
Natalia I. Khokhlova — infectious disease physician, C. Sc. (Med.), Associate Professor of the Department of Infectious Diseases, Novosibirsk State Medical University; 52, Krasny Ave., Novosibirsk, Novosibirsk Region, 630091, Russian Federation; ORCID iD 0000-0003-4497-3173
Contact information: Anna N. Vyazhevich, e-mail: dr.anna.oleynik@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 20.08.2025.
Revised 12.09.2025.
Accepted 07.10.2025.
Информация с rmj.ru



