Введение
Высокая распространенность острой респираторной вирусной инфекции (ОРВИ) во взрослой и детской популяциях делает значимым выбор эффективного и безопасного препарата для ее профилактики и лечения [1]. При отсутствии единого подхода к лекарственной терапии и профилактике ОРВИ в мире и даже в разных академических школах внутри одной страны оптимальным представляется подбор терапии с позиций доказательной медицины. Универсальным инструментом оценки весомости доказательств эффективности и безопасности лекарственного препарата является систематический обзор с метаанализом. Именно данный вариант, в отличие от классической обзорной статьи, зачастую отражающей в большей степени мнение авторов, позволяет наиболее полно и надежно оценить методологический, статистический и доказательный аспекты, включая риск систематических ошибок. Необязательный, но широко распространенный и рекомендованный при проведении систематического обзора и метаанализа подход — использование положения PRISMA (Preferred reporting items for systematic reviews and meta-analyses — предпочтительные элементы отчетности для систематических обзоров и метаанализов), обновленного в 2020 г. и предполагающего обобщение и анализ данных рандомизированных клинических исследований (РКИ) [2].
В рутинной терапевтической и педиатрической практике верификация возбудителя при каждом эпизоде ОРВИ не проводится, поэтому наиболее удобны препараты широкого спектра противовирусного действия. Среди множества лекарственных средств обращают на себя внимание отечественные препараты на основе технологически обработанных (высокие разведения) аффинно очищенных антител (ТО АТ) к интерферону (ИФН) γ — Анаферон (ООО «НПФ «Материа Медика Холдинг», Россия), применяемый в терапевтической практике более 15 лет у пациентов старше 18 лет, и Анаферон детский (ООО «НПФ «Материа Медика Холдинг», Россия), активно используемый у детей в возрасте от 1 мес. уже более 20 лет в таблетках для рассасывания, а в течение последних 5 лет — и в каплях для приема внутрь у пациентов от 1 мес. до 3 лет включительно [3–5]. Стоит отметить, что многолетний опыт применения препаратов на основе ТО АТ к ИФН-γ накоплен не только в России, но и в странах СНГ, Юго-Восточной Азии, Мексике.
При профилактическом и лечебном применении препараты оказывают иммуномодулирующее и противовирусное действие [3–5]. Анаферон и Анаферон детский являются лекарственными препаратами регуляторного типа — они способны таргетно влиять на иммунопатогенез ОРВИ вне зависимости от этиологии. Универсальность иммуноопосредованного противовирусного действия при ОРВИ Анаферона и Анаферона детского реализуется благодаря влиянию на ИФН-γ с последующим вовлечением в механизм действия системы ИФН и сопряженных с ними цитокинов для оптимизации ответа иммунной системы на вирусную агрессию [3–7].
Эффективность Анаферона и Анаферона детского для лечения и профилактики ОРВИ при благоприятном профиле их безопасности продемонстрирована в клинических исследованиях (КИ), включая двойные слепые плацебо-контролируемые РКИ, с участием более 8500 пациентов [8–24]. Несмотря на обширную доказательную базу эффективности и безопасности Анаферона и Анаферона детского при ОРВИ/гриппе, обобщенный анализ результатов РКИ по препаратам ранее не проводился.
Цель исследования: оценка эффективности и безопасности применения препаратов Анаферон и Анаферон детский для профилактики и лечения ОРВИ с использованием метаанализа.
Основные клинические вопросы, ответы на которые даны в ходе выполнения обзора и метаанализа, — эффективен и безопасен ли Анаферон детский для лечения ОРВИ/гриппа, а также эффективно и безопасно ли применение препаратов Анаферон и Анаферон детский для профилактики ОРВИ/гриппа.
Содержание статьи
Материал и методы
Стратегия поиска и отбора данных
Проведен поиск информации о КИ в открытых источниках (в Интернете, медицинской библиотеке) с использованием ключевых слов «Анаферон» и «Анаферон детский». При проведении поиска не было ограничения результатов по языку, дате или статусу публикации. Стратегия поиска информации включала обращение к официальным сайтам — отечественным и зарубежным реестрам КИ и базам данных, электронным библиотекам, среди которых: Государственный реестр лекарственных средств (grls.ru); Национальная медицинская библиотека США ClinicalTrials.gov (clintrials.gov); Международная платформа для регистрации клинических испытаний (ICTRP — International Clinical Trials Registry Platform) ВОЗ (www.who.int/ictrp/search/en), PubMed, EMBASE, MEDLINE, Кокрейновская библиотека, научная электронная библиотека eLIBRARY.RU, Российская научная электронная библиотека КиберЛенинка (cyberleninka.ru). Для повышения репрезентативности данных по эффективности и безопасности (получение информации в рамках фармаконадзора) у компании-производителя были запрошены отчеты о результатах КИ.
Критерии отбора КИ для включения в метаанализ:
дизайн исследования: проспективное РКИ;
участники РКИ:
пациенты мужского и женского пола в возрасте от 1 мес. с диагнозом: ОРВИ/грипп/ОРИ (острая респираторная инфекция вирусного генеза) для Анаферона детского по показанию «лечение ОРВИ/гриппа»;
пациенты мужского и женского пола в возрасте от 1 мес. для Анаферона детского и от 18 лет для Анаферона по показанию «профилактика ОРВИ/гриппа»;
применение в РКИ препаратов Анаферон и Анаферон детский для профилактики и/или лечения ОРВИ/гриппа согласно инструкциям по их медицинскому применению [3–5];
использование в качестве одной из конечных точек /критерия эффективности в РКИ по изучению лечебной эффективности Анаферона детского при ОРВИ/гриппе длительности заболевания и/или длительности лихорадочного периода;
использование в качестве одной из конечных точек в РКИ по изучению профилактической эффективности Анаферона и Анаферона детского в отношении ОРВИ/гриппа доли незаболевших/заболевших пациентов.
В метаанализ не включали не соответствующие критериям включения РКИ, дублирующие публикации результатов РКИ и исследования с недостаточными для статистического анализа данными. Для оценки методологического качества РКИ проведен анализ риска предвзятости/смещения. В соответствии с рекомендациями Кокрейновского сотрудничества рассматривали следующие критерии: метод рандомизации, наличие ослепления в исследовании и его тип, соответствие результатов конечным точкам/
критериям эффективности и полнота представленности результатов с последующей оценкой риска смещения в исследовании в целом как низкого, среднего, высокого и неопределенного [26, 27].
Данный обзор включает:
метаанализ лечебной эффективности Анаферона детского при ОРВИ/гриппе/ОРИ по конечным точкам «длительность заболевания» и «длительность лихорадки». Дополнительно оценено влияние препарата на длительность интоксикации, катаральных симптомов (ринита и кашля) и динамику уровня ИФН-γ и ИФН-α;
метаанализ профилактической эффективности Анаферона и Анаферона детского при ОРВИ/гриппе по конечной точке «доля незаболевших пациентов» с расчетом коэффициента эффективности (КЭ) препарата.
Безопасность терапии оценивали с учетом количества и характера нежелательных явлений (НЯ), их связи с приемом препарата, отклонений лабораторных и жизненно важных показателей на фоне приема препаратов.
При подготовке обзора использованы модифицированные/адаптированные элементы из PRISMA 2020 Checklist (проверочный лист) и PRISMA 2020 flow diagram (блок-схема) для новых систематических обзоров, включающих поиск в базах данных, реестрах и других источниках [2, 25].
Статистическая методология
Для предварительной статистической обработки данных использованы методы описательной статистики. Сравнение непрерывных показателей (длительностей симптомов) в отдельных исследованиях проводилось с помощью критерия Стьюдента. При выполнении метаанализа непрерывных показателей с использованием объединенных оценок средних значений и стандартных отклонений применяли расчет Z-теста для средневзвешенного размера эффекта Hedges’ g,
построение для него 95% доверительного интервала (ДИ) и вычисление p-value для принятия/отвержения гипотезы равенства эффекта нулю. Рассчитывали 95% ДИ с помощью двух подходов: без учета разнородности результатов (модель фиксированных эффектов, МФЭ) и с учетом этого обстоятельства (модель случайных эффектов, МСЭ). Рассчитывали также кохрановскую Q-статистику (Cochran’s Q),
позволяющую с помощью проверки статистической гипотезы оценить степень однородности результатов исследований. Для оценки различий в частотных показателях отдельных исследований использовали точный критерий Фишера; для оценки совокупных частотных данных — критерий Кохрана — Мантеля — Хензеля (Cochran — Mantel —
Haenszel, CMH).
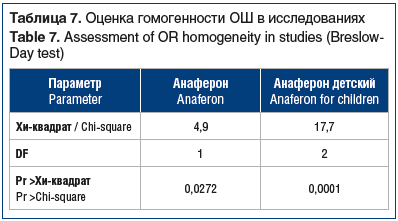
При анализе профилактической эффективности для сравнения долей незаболевших пациентов рассчитывали показатели относительного риска (ОР) и отношения шансов (ОШ). Результаты представлены в виде индивидуальных и обобщенных показателей (OШ и ОР), а также соответствующих 95% ДИ (препарат/плацебо или препарат/ группа сравнения). Оценку гомогенности данных при расчете частотных показателей проводили с помощью теста Бреслоу — Дэй (Breslow-Day Test).
Также рассчитывали КЭ (%) по формуле:
КЭ=100 × (б — а) / б,
где а — заболеваемость среди лиц, получавших препарат, б — заболеваемость среди лиц, не получавших препарат.
Результаты исследования
Отбор исследований
В открытых источниках по ключевым словам найдено 1297 публикаций, 2 публикации в печатном варианте, дополнительно 3 отчета о КИ были предоставлены компанией-спонсором. В метаанализ включены данные 11 РКИ (рис. 1).
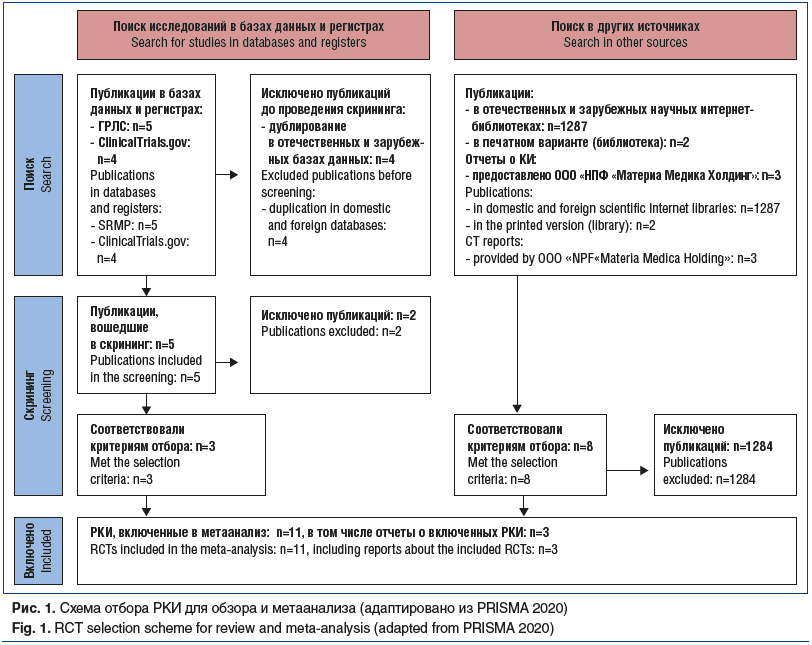
Оценка риска предвзятости/смещения в исследованиях
Данные по оценке риска предвзятости/смещения в исследованиях представлены в таблице 1.
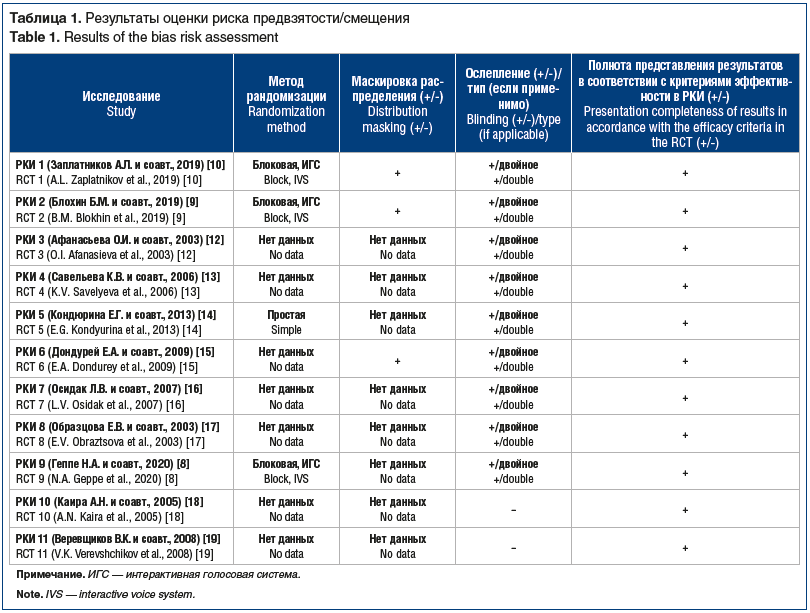
Метод рандомизации описан только в 4 РКИ, маскировка распределения была предусмотрена в 3 РКИ, где процедура рандомизации проводилась с использованием автоматизированной интерактивной голосовой системы, посредством способа плавающих блоков случайным образом распределяющей пациентов в 2 группы. Также в этих РКИ количество поставляемого в исследовательские центры исследуемого препарата превышало количество запланированных участников, что дополнительно маскировало распределение, так как исследователи не могли знать заранее, в какую именно из 2 групп будет распределен каждый конкретный пациент. В 9 исследованиях было использовано двойное ослепление (РКИ 1-9), 2 РКИ были открытыми. Во всех РКИ были представлены результаты в соответствии с заявленными критериями эффективности. В целом дизайн всех включенных в метаанализ исследований соответствовал заявленным целям, а риск предвзятости/смещения по рассмотренным критериям может быть оценен как низкий (РКИ 1, 2, 9), средний (РКИ 5, 6) и неопределенный (РКИ 3, 4, 7, 8, 10, 11) [27]. Результаты по оценке риска предвзятости как «неопределенного» в РКИ 3, 4, 7, 8 связаны в основном с отчетностью по дизайну исследования: отсутствие подробной информации о методе рандомизации и маскировке распределения, а в РКИ 10 и РКИ 11 — о методе ослепления.
Краткое описание включенных в метаанализ исследований
В метаанализ включены данные из 11 РКИ с участием 3079 пациентов в возрасте от 1 мес. до 69 лет, из них 1729 человек участвовали в исследованиях профилактической эффективности препаратов на основе ТО АТ к ИФН-γ и 1550 пациентов — лечебной эффективности этих препаратов. Девять РКИ были двойными слепыми плацебо-контролируемыми, 2 РКИ — открытого типа. Все исследования были проспективными, в параллельных группах. Четыре исследования (РКИ 1, 2, 4, 9) были многоцентровыми, 2 из них — международными: РКИ 1 проводилось в 3 странах (Российская Федерация (РФ), Республика Беларусь и Украина), РКИ 9 — в 2 странах (РФ, Республика Узбекистан) (табл. 2).
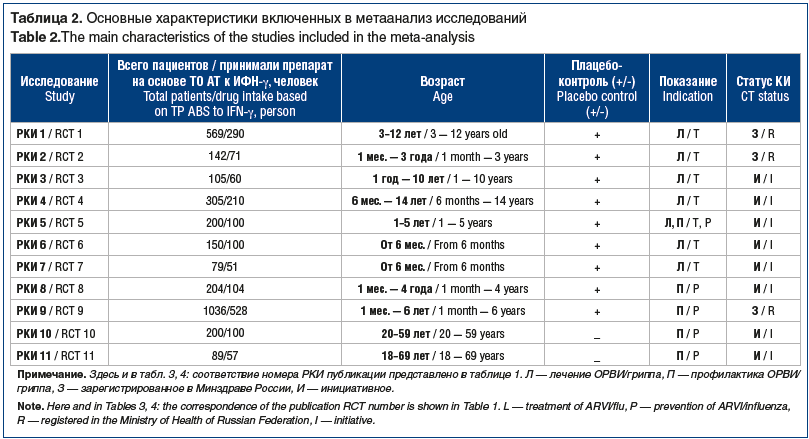
В РКИ 1, 3–11 использовалась таблетированная форма препаратов Анаферон и Анаферон детский, в РКИ 2 — жидкая лекарственная форма Анаферона детского. Режим дозирования препаратов в РКИ соответствовал актуальным инструкциям по их медицинскому применению: на один прием рекомендована 1 таблетка (или
10 капель для РКИ 2) [3–5]. Несмотря на различия в лекарственной форме препарата и целевой возрастной аудитории, специфика механизма действия препаратов на основе ТО АТ к ИФН-γ позволяет избежать необходимости подбора индивидуального режима дозирования в зависимости от возраста и массы тела пациента. С лечебной целью в РКИ 1–7 препараты применялись в первые 2 ч каждые 30 мин (всего 5 приемов), затем в течение первых суток — еще 3 приема через равные промежутки времени. Со 2-х суток и далее до выздоровления (или 5–14 дней в зависимости от выраженности клинической симптоматики) / до 5 суток в РКИ 2 — по 1 таблетке или 10 капель 3 р/сут. С профилактической целью в РКИ 5, 8–11 препараты применяли по 1 таблетке 1 р/сут в течение 3 мес./12 нед.
Из 11 включенных в метаанализ исследований 2 РКИ были проведены у пациентов с ОРИ, 1 РКИ — у пациентов с гриппом, в 6 РКИ оценивалась эффективность и безопасность препаратов на основе ТО АТ к ИФН-γ в отношении ОРВИ/гриппа и в 2 исследованиях — при ОРИ/ОРВИ с гастроинтестинальным синдромом (ГИС), одно из которых включало пациентов только с коронавирусной этиологией заболевания (табл. 3).
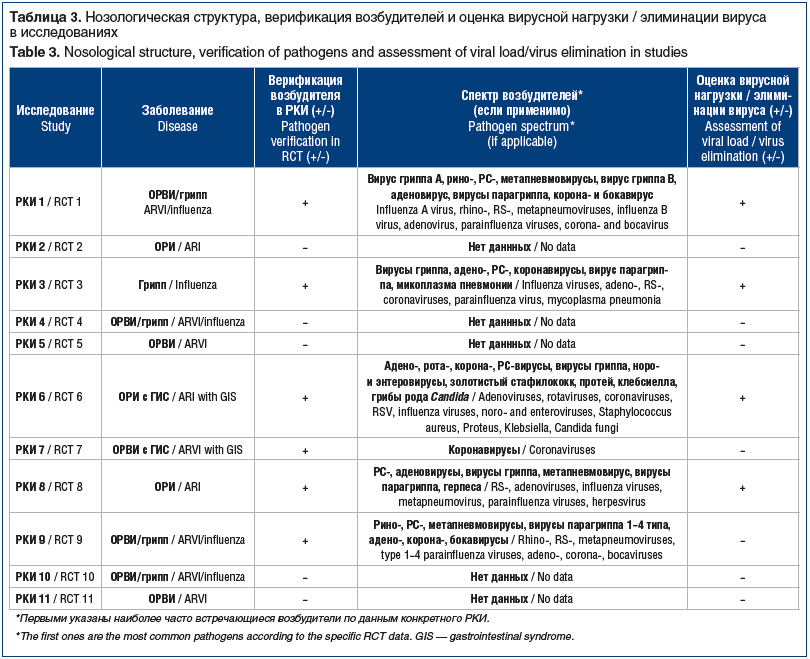
В 6 РКИ с участием 2143 пациентов проводилась верификация возбудителя (ПЦР-диагностика, иммуноферментный анализ, иммунофлуоресценция, реакция непрямой гемагглютинации и просвечивающая электронная микроскопия) [8, 10, 12, 15–17]. Среди возбудителей ОРВИ в РКИ 1 и 3 преобладали вирусы гриппа, в РКИ 6 — адено-, рота-, коронавирусы, в РКИ 7 — коронавирусы, в РКИ 8 и 9 — риновирус и респираторно-синцитиальный (РС) вирус. В РКИ 9 эпизоды корона- и бокавирусной инфекции были отмечены только в группе пациентов, получавших плацебо [8]. В 4 исследованиях с участием 903 пациентов оценивалась динамика вирусной нагрузки/элиминации возбудителя, 2 других РКИ были посвящены оценке профилактического действия препарата, и данный параметр в них не оценивался. В остальных РКИ диагноз ставили на основании клинических данных.
Ряд РКИ был посвящен изучению действия препаратов на основе ТО АТ к ИФН-γ в особых группах пациентов. Так, в РКИ 5 и РКИ 11 профилактическая и лечебная эффективность Анаферона и Анаферона детского соответственно оценивалась у лиц с хроническими заболеваниями органов дыхания. В РКИ 5 были включены пациенты с легким или среднетяжелым течением бронхиальной астмы (БА), а в РКИ 11 — больные с бронхолегочной патологией (БА, хронический бронхит, хроническая обструктивная болезнь легких) [14, 19]. Более 45% пациентов, включенных в РКИ 8, посвященное оценке профилактической эффективности Анаферона детского, относились к группе часто болеющих детей (ЧБД) [17].
Помимо длительности заболевания (РКИ 1–3, 5–7), длительности лихорадки (РКИ 2–7) и доли незаболевших пациентов (РКИ 5, 8–11), в качестве конечных точек были использованы длительность интоксикации (РКИ 3–7), средняя длительность эпизода ОРВИ/гриппа при его возникновении на фоне профилактического приема исследуемых препаратов (РКИ 8, 10, 11) и ряд других параметров (табл. 4).
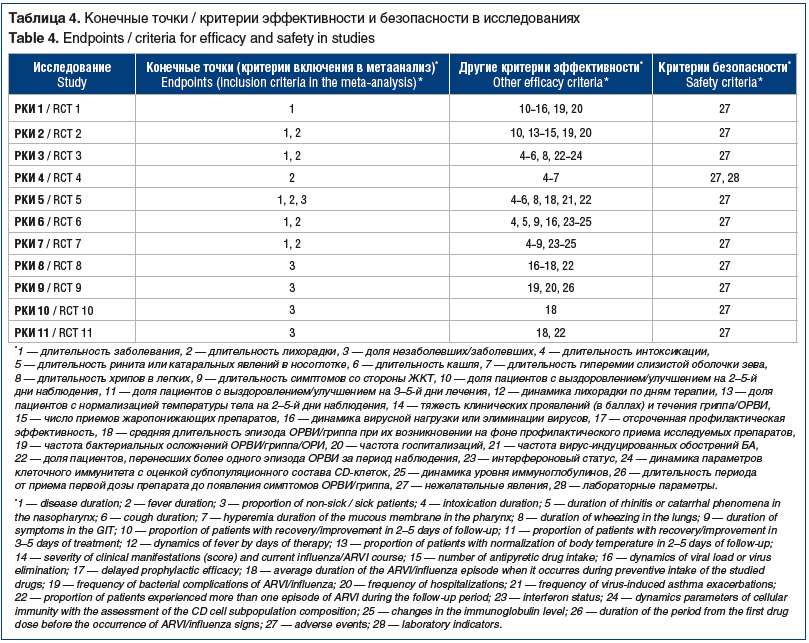
В РКИ 8 и 10 рассчитывался КЭ препарата при гриппе и ОРВИ [17, 18].
Оценка безопасности
В качестве критериев безопасности чаще всего оценивались НЯ (см. табл. 4). Общее количество репортированных НЯ составило 114 при приеме препаратов на основе ТО АТ к ИФН-γ и 117 — при приеме плацебо. В РКИ 1, 2, 8 и 9 статистически значимые различия между группой исследуемого препарата и группой плацебо по НЯ отсутствовали [8–10, 17]. В остальных РКИ на фоне приема Анаферона и Анаферона детского ни одного НЯ зарегистрировано не было. В ходе обобщенной оценки безопасности установлено, что с момента регистрации препаратов по май 2021 г. всего было выявлено 156 НЯ и нежелательных реакций (НР). Большинство зафиксированных при применении препаратов Анаферон и Анаферон детский НР/НЯ — проявления повышенной индивидуальной чувствительности, информация о возможности появления которых содержится в инструкциях по медицинскому применению препаратов [3–5]. Остальные НР/НЯ являются единичными, относятся к разным классам систем и органов MedDRA (Medical Dictionary for Regulatory Activities — Медицинский словарь для регуляторной деятельности), имеют низкий уровень причинно-следственной связи с приемом препарата. За весь период обращения препаратов на рынке сигналов безопасности или других проблем безопасности в связи с препаратами на основе ТО АТ к ИФН-γ не выявлено, соотношение «польза/риск» для препаратов остается положительным.
Результаты метаанализа РКИ эффективности Анаферона детского в лечении ОРВИ/гриппа
Метаанализ эффективности Анаферона детского для лечения ОРВИ/гриппа проведен на основе данных 7 двойных слепых плацебо-контролируемых РКИ (РКИ 1–7) с участием 1550 пациентов в возрасте от 1 мес. Пациенты включались в РКИ 1, 2, 5 в первые 24 ч от начала заболевания, в РКИ 3 и РКИ 4 — в 1–2-е сутки, по РКИ 6 и РКИ 7 данных не найдено. Во всех РКИ Анаферон детский и плацебо применялись на фоне стандартной терапии ОРВИ, включавшей в том числе прием жаропонижающих препаратов.
Для анализа показателя «длительность заболевания» были взяты данные 1245 пациентов из 6 РКИ (РКИ 1–3, 5–7), «длительность лихорадки» — данные 981 пациента из 6 РКИ (РКИ 2–7). Дополнительно оценены критерии «длительность интоксикации» (РКИ 3–7), «длительность ринита» и «длительность кашля» (РКИ 3–5, 7).
В среднем длительность ОРВИ/гриппа при приеме Анаферона детского была в 1,4 раза короче, чем при приеме плацебо, и составляла 4,71±2,53 дня против 6,37±6,23 дня (p<0,001). Средняя длительность лихорадки при приеме Анаферона детского — 2,19±1,21 дня против 3,22±1,81 дня на фоне плацебо (p<0,001). Средняя длительность интоксикации по всем исследованиям составляла в группе Анаферона детского 2,76±1,28 дня против 4,23±3,14 дня в группе плацебо, ринита — 3,87±1,44 дня и 5,12±2,73 дня, кашля — 3,71±3,10 дня и 7,02±6,33 дня соответственно (p<0,001).
Несмотря на гетерогенность данных по рассматриваемым критериям при проверке на гомогенность и предпочтительность использования МСЭ для всех критериев, кроме критерия «длительность кашля», для полноты представления далее приведены результаты, полученные и с использованием МФЭ (табл. 5).
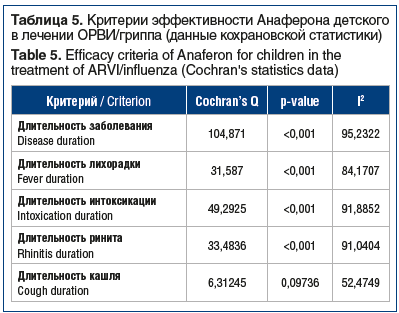
По результатам метаанализа Анаферон детский продемонстрировал значимое превосходство во влиянии на продолжительность ОРВИ/гриппа и лихорадочного синдрома над плацебо в виде достоверного уменьшения продолжительности как заболевания, так и лихорадочного синдрома. Размер эффекта, отражающий сравнительный эффект, нормированный на стандартную ошибку данных, по критерию «длительность заболевания» был максимальным в РКИ 7 и РКИ 6 — 2,63 и 1,88 соответственно и наименьшим — в РКИ 1 (рис. 2A). Размер эффекта по критерию «длительность лихорадки» был максимальным в РКИ 3, 6 и 7, составив 1,52, 1,38 и 1,27 соответственно, и наименьшим — в РКИ 2 (рис. 2B).
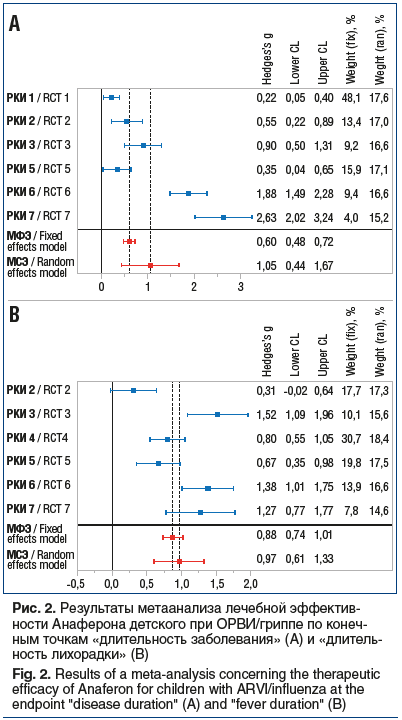
При оценке дополнительных критериев эффективности показано достоверное преимущество применения Анаферона детского в лечении ОРВИ/гриппа для более быстрого купирования как симптомов интоксикации с максимальным размером эффекта в РКИ 6 и 7, так и катарального синдрома (ринита и кашля) с максимальным размером эффекта в РКИ 7 (табл. 6).

Таким образом, в ходе метаанализа лечебной эффективности Анаферона детского при ОРВИ/гриппе получены убедительные доказательства более высокой эффективности по сравнению с плацебо по всем рассмотренным критериям.
Отдельно проанализирован интерфероновый статус по данным 334 пациентов из 3 исследований (РКИ 3, 6, 7). На фоне терапии ОРВИ/гриппа у 105 пациентов в РКИ 3 исследовались уровни индуцированной продукции ИФН-α и ИНФ-γ, суммарный ИФН в сыворотке, спонтанный ИФН. У 229 пациентов в РКИ 6 и 7 дополнительно определялся уровень сывороточного ИФН-α и ИФН-γ.
В метаанализе показано достоверное влияние Анаферона детского на уровень индуцированных ИФН-α и ИФН-γ на 2–3-й дни лечения с сохранением эффекта к окончанию терапии. Средневзвешенный размер эффекта для индуцированной продукции ИФН-γ на 2–3-й день терапии в МФЭ составил 0,99 [95% ДИ 0,66; 1,33] (р<0,001, двусторонний Z-тест), в МСЭ — 1,27 [95% ДИ 0,06; 2,48] (р=0,039, двусторонний Z-тест).
Результаты метаанализа РКИ эффективности Анаферона и Анаферона детского для профилактики ОРВИ/гриппа
Метаанализ профилактической эффективности Анаферона и Анаферона детского при ОРВИ/гриппе проведен на основе данных 5 РКИ с участием 1729 пациентов в возрасте от 1 мес. (для Анаферона детского в таблетках для рассасывания) и от 18 лет (для Анаферона). Три РКИ — двойные слепые плацебо-контролируемые (РКИ 5, 8, 9),
2 исследования — открытого типа (РКИ 10, 11). В РКИ 5, 8, 10, 11 дополнительно оценивалась продолжительность заболевания/симптомов при возникновении эпизода ОРВИ/гриппа на фоне профилактического вмешательства.
В целом доля пациентов, не заболевших ОРВИ/гриппом на фоне приема Анаферона детского, составила 70,3% против 56,3% при приеме плацебо (CMH=38,8; p<0,0001) при совокупном КЭ 32%. При приеме Анаферона в среднем доля не заболевших ОРВИ/гриппом пациентов составила 60% против 7,6% в группе сравнения (CMH=81,5; p<0,0001) с КЭ 56,7%.
Проведенный метаанализ данных РКИ по критерию «доля незаболевших пациентов» продемонстрировал превосходство профилактической эффективности препаратов на основе ТО АТ к ИФН-γ. Суммарный ОР для Анаферона детского составил 1,25 [95% ДИ 1,2; 1,3] при ОШ 2,2 [95% ДИ 1,7; 2,9], для Анаферона соответствующие показатели составили 6,7 [95% ДИ 3,8; 11,8] и 20,1 [95% ДИ 9,2; 44,0] (рис. 3 и 4).
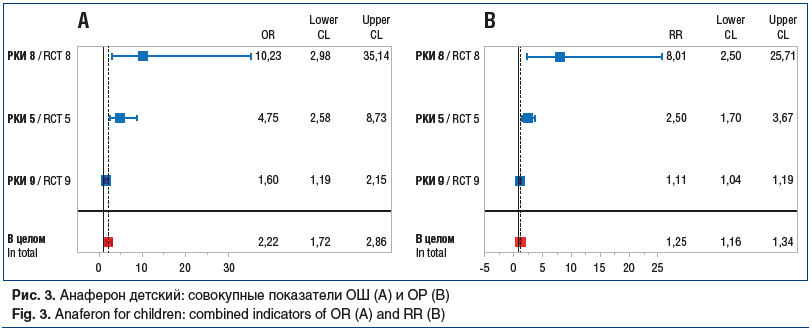
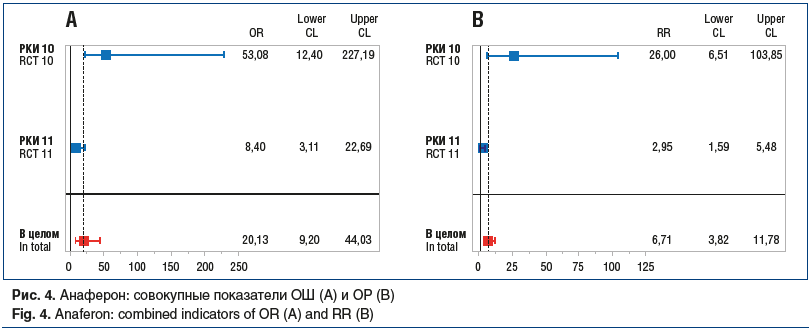
Результаты оценки гомогенности ОШ в исследованиях Анаферона и Анаферона детского с помощью теста Бреслоу — Дэй представлены в таблице 7.
Таким образом, результаты метаанализа профилактической эффективности Анаферона и Анаферона детского показали существенное превосходство их применения для профилактики гриппа и других ОРВИ по сравнению с плацебо и отсутствием профилактического вмешательства.
Обсуждение
В основе рационального применения лекарственных препаратов для лечения и профилактики ОРВИ/гриппа лежит предпочтительное использование средств с весомой доказательной базой. В данном метаанализе продемонстрированы убедительные преимущества эффективности и безопасности применения препаратов Анаферон и Анаферон детский для профилактики и лечения ОРВИ.
Метаанализ лечебной эффективности Анаферона детского при ОРВИ/гриппе по критериям «длительность заболевания» и «длительность лихорадки» с дополнительной оценкой влияния препарата на длительность интоксикации, катаральных симптомов (ринита и кашля) и динамику уровня ИФН-γ и ИФН-α показал достоверное уменьшение сроков заболевания и продолжительности отдельных симптомов. Анаферон детский продемонстрировал статистически значимо лучшую эффективность по сравнению с плацебо по всем рассмотренным показателям. Так, по одной из ключевых конечных точек — «длительность заболевания» — средневзвешенный размер эффекта составил 1,05 [95% ДИ 0,44; 1,67], по другой — «длительность лихорадки» — 0,97 [95% ДИ 0,61; 1,33] (p<0,001, p-value двустороннего Z-теста; МСЭ). Лечебная эффективность Анаферона детского не зависела ни от возбудителя ОРВИ, ни от клинической картины, включая ОРВИ с сочетанным поражением респираторного тракта и ГИС, ни от наличия коморбидности (БА). Полученные данные по влиянию Анаферона детского на уровень индуцированной продукции ИФН-γ и ИФН-α свидетельствуют о его способности активировать ключевые цитокины иммунной системы — ИФН, что позволяет естественным факторам противовирусной иммунной защиты более полноценно реализовать свой потенциал на фоне приема препарата.
Не вызывающим сомнения профилактическим вмешательством при гриппе является вакцинация. Согласно данным Центра по контролю заболеваний и профилактики США эффективность вакцинации против гриппа для всех типов вакцин в сезон 2019/2020 у пациентов старше 18 лет составила 26–45% [28]. КЭ в отношении ОРВИ/гриппа составил 32% для Анаферона детского и 56,7% для Анаферона. Метаанализ профилактической эффективности Анаферона детского и Анаферона при ОРВИ/гриппе по критерию «доля незаболевших пациентов» продемонстрировал значимую профилактическую эффективность препаратов — для Анаферона детского ОР составил 1,2 [95% ДИ 1,2; 1,3] при ОШ 2,2 [95% ДИ 1,7; 2,9],
для Анаферона — 6,7 [95% ДИ 3,8; 11,8] и 20,1 [95% ДИ 9,2; 44,0] соответственно. При этом доля не заболевших ОРВИ/гриппом при приеме Анаферона пациентов превышала таковую при отсутствии профилактического вмешательства почти в 8 раз, а при приеме Анаферона детского — в 1,3 раза по сравнению с плацебо. Профилактическая эффективность препаратов не зависела от наличия сопутствующей бронхолегочной патологии или принадлежности ребенка к группе ЧБД.
Оценка безопасности применения Анаферона и Анаферона детского с учетом количества и характера НЯ, их связи с приемом препарата, отклонений лабораторных и жизненно важных показателей на фоне приема препаратов подтвердила их благоприятный профиль безопасности.
Отдельно следует остановиться на ограничениях и сильных сторонах данного метаанализа. Безусловно сильными сторонами проведенного анализа является отсутствие ограничений по полу, возрасту и сопутствующей ОРВИ/гриппу патологии, позволяющее максимально интерполировать расчетные данные на условия реальной клинической практики.
К ограничениям метаанализа в части лечения ОРВИ/гриппа можно отнести оценку эффективности исследуемого препарата на фоне использования базовой терапии, включавшей применение жаропонижающих препаратов. Однако данная проблема в любых РКИ носит этический характер. Относительным ограничением можно считать неоднородность РКИ по критериям эффективности, не противоречащую при этом критериям включения в метаанализ — только по 6 РКИ из 7 проанализированы длительность заболевания и длительность лихорадки. Данные по дополнительным критериям были представлены в 5 исследованиях — по длительности интоксикации и в 4 РКИ — по длительности ринита и кашля.
Сильной стороной метаанализа эффективности Анаферона детского для лечения ОРВИ/гриппа, безусловно, является дизайн РКИ — все исследования, включенные в анализ, были двойными слепыми плацебо-контролируемыми. Однако в одном РКИ группа плацебо-контроля была менее 30 человек и при оценке риска смещения, ряд РКИ в силу недостаточной представленности сведений о процедуре рандомизации и маскировке распределения были отнесены к РКИ с неопределенным риском, что также может быть отнесено к ограничениям данного метаанализа и несколько снижать качество доказательств.
Частичное отсутствие информации в РКИ о вакцинации против гриппа, которая могла дополнительно повлиять на результаты профилактического применения Анаферона и Анаферона детского, а также открытый дизайн РКИ 10 и РКИ 11 являются ограничениями метаанализа, посвященного оценке профилактической эффективности препаратов. Кроме того, часть данных взята не только из двойных слепых плацебо-контролируемых исследований, но также и из сравнительных (noninferiority) исследований.
Выводы
Проведенный на основании 11 РКИ с участием 3079 пациентов в возрасте от 1 мес. до 69 лет обзор и метаанализ эффективности и безопасности Анаферона и Анаферона детского для лечения и профилактики гриппа и других ОРВИ позволяет заключить, что:
Анаферон детский эффективен и безопасен для лечения гриппа и других ОРВИ вне зависимости от возбудителя и наличия коморбидности (БА);
Анаферон и Анаферон детский эффективны и безопасны для профилактики ОРВИ/гриппа, включая пациентов с сопутствующей бронхолегочной патологией и ЧБД.
Сведения об авторах:
Геппе Наталья Анатольевна — д.м.н., профессор, заведующая кафедрой детских болезней Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119435, Россия, г. Москва, ул. Большая Пироговская, д. 19; ORCID iD 0000-0003-0547-3686.
Заплатников Андрей Леонидович — д.м.н., заведующий кафедрой неонатологии им. проф. В.В. Гаврюшова, проректор по учебной работе ФГБОУ ДПО РМАНПО Минздрава России; 123836, Россия, г. Москва, ул. Баррикадная, д. 2/1; ORCID iD 0000-0003-1303-8318.
Кондюрина Елена Геннадиевна — д.м.н., профессор, заведующая кафедрой педиатрии факультета повышения квалификации и профессиональной переподготовки врачей, проректор по постдипломному образованию ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-кт, д. 52; ORCID iD 0000-0003-3250-3107.
Афанасьева Ольга Ивановна — д.м.н., заведующая отделением респираторных вирусных инфекций у детей ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России; 197376, Россия, г. Санкт-Петербург, ул. Профессора Попова, д. 15/17; ORCID iD 0000-0002-1229-171X.
Пшеничная Наталья Юрьевна — д.м.н., профессор, заместитель директора по клинико-аналитической работе ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3а; ORCID iD 0000-0003-2570-711X.
Блохин Борис Моисеевич — д.м.н., профессор, заведующий кафедрой поликлинической и неотложной педиатрии, руководитель научно-образовательного инновационного центра «Неотложные состояния в педиатрии» ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-4762-5975.
Каира Алла Николаевна — д.м.н., ведущий научный сотрудник и заведующая лабораторией эпиданализа и мониторинга за инфекционной заболеваемостью ФГБНУ НИИВС им. И.И. Мечникова; 105064, Россия, г. Москва, Малый Казенный пер., д. 5а; профессор кафедры эпидемиологии ФГБОУ ДПО РМАНПО Минздрава России; 123836, Россия, г. Москва, ул. Баррикадная, д. 2/1; ORCID iD 0000-0002-9378-6414.
Дондурей Елена Александровна — к.м.н., заведующая инфекционным отделением СПб ГБУЗ «ДГКБ № 5 им. Н.Ф. Филатова»; 192289, Россия, г. Санкт-Петербург, ул. Бухарестская, д. 134; старший научный сотрудник отделения респираторных вирусных инфекций у детей ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России; 197376, Россия, г. Санкт-Петербург, ул. Профессора Попова, д. 15/17; главный внештатный специалист по инфекционным болезням у детей Комитета по здравоохранению Правительства Санкт-Петербурга; ORCID iD 0000-0003-2382-9172.
Контактная информация: Заплатников Андрей Леонидович, e-mail: zaplatnikov@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов: Анаферон и Анаферон детский — коммерческие препараты, производимые и реализуемые ООО «НПФ «Материа Медика Холдинг». На территории РФ действуют патенты, защищающие Анаферон и Анаферон детский и принадлежащие в настоящее время ООО «НПФ «Материа Медика Холдинг». Н.А. Геппе, А.Л. Заплатников, Е.Г. Кондюрина, Б.М. Блохин получали гранты исследователя от ООО «НПФ «Материа Медика Холдинг» на проведение клинических исследований. Авторы данной статьи подтвердили отсутствие иного возможного конфликта интересов, о котором необходимо сообщить.
Статья поступила 15.06.2021.
Поступила после рецензирования 08.07.2021.
Принята в печать 02.08.2021.
About the authors:
Natalia A. Geppe — Dr. Sc. (Med.), Professor, Head of the Department of Children’s Diseases, Clinical Institute of Children’s Health named after N.F. Filatov, I.M.Sechenov First Moscow State Medical University (Sechenov University); 19, Bolshaya Pirogovskaya str., Moscow, 119435, Russian Federation; ORCID iD 0000-0003-0547-3686.
Andrey L. Zaplatnikov — Dr. Sc. (Med.), Professor, Head of the Department of Neonatology named after prof. V.V. Gavryushov, Vice-rector for Academic Affairs, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya, Moscow, 123836, Russian Federation; ORCID iD 0000-0003-1303-8318.
Elena G. Kondyurina — Dr. Sc. (Med.), Professor, Head of the Department of Pediatrics of the Faculty of Continuing Medical Education and Professional Development, Vice-Rector for Postgraduate Education, Novosibirsk State Medical University; 52 Krasny аve., Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0003-3250-3107.
Olga I. Afanasieva — Dr. Sc. (Med.), Head of the Department of Respiratory Viral Infections, Smorodintsev Research Institute of Influenza; 15/17, Professor Popov str., St. Petersburg, 197376, Russian Federation; ORCID iD 0000-0002-1229-171X.
Natalia Yu. Pshenichnaya — Dr. Sc. (Med.), Professor, Deputy Director for Clinical and Analytical Work, Central Research Institute of Epidemiology; 3a, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0003-2570-711X.
Boris M. Blokhin — Dr. Sc. (Med.), Professor, Head of the Department of Outpatient and Emergency Pediatrics, Head of the Research and Educational Innovation Center «Urgent Conditions in Pediatrics», Pirogov Russian National Research Medical University; 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-4762-5975.
Alla N. Kaira — Dr. Sc. (Med.), Leading Researcher and Head of the Laboratory of Epidemiological Analysis and Monitoring of Infectious Morbidity, I.I. Mechnikov Scientific Research Institute of Vaccines and Serums; 5a, Malyi Kazennyi Lane, Moscow, 105064, Russian Federation; Professor of the Department of Epidemiology, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya, Moscow, 123836, Russian Federation; ORCID iD 0000-0002-9378-6414.
Elena A. Dondurey — C. Sc. (Med.), Head of the Department of the Infectious Diseases, Children City Clinical Hospital No. 5 named after N.F. Filatov; 134, Bukharestskaya str.,
St. Petersburg, 192289, Russian Federation; Senior Researcher of the Department of Respiratory Viral Infections in Children, Smorodintsev Research Institute of Influenza; 15/17, Professor Popov str., St. Petersburg, 197376, Russian Federation; Chief External Expert of Infectious Diseases in Children, Health Committee of St. Petersburg; ORCID iD 0000-0003-2382-9172.
Contact information: Andrey L. Zaplatnikov, e-mail: zaplatnikov@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
Conflict of interests: Anaferon and Anaferon for Children are commercial drugs produced and sold by OOO «NPF «Materia Medica Holding». In the Russian Federation, there are patents protecting Anaferon and Anaferon for children and currently owned by OOO «NPF «Materia Medica Holding». N.A. Geppe, A.L. Zaplatnikov, E.G. Kondyurina, B.M. Blokhin received research grants from OOO «NPF «Materia Medica Holding» for conducting clinical trials. The authors of this article confirmed that there is no other possible conflict of interest that needs to declare.
Received 15.06.2021.
Revised 08.07.2021.
Accepted 02.08.2021.
.
Информация с rmj.ru

