Введение
Хроническая обструктивная болезнь легких (ХОБЛ) — заболевание, характеризующееся прогрессирующим снижением легочной функции, приводящим к развитию дыхательной недостаточности [1]. При ХОБЛ развиваются легочная гипертензия и недостаточность правого желудочка (ПЖ), в последующем, даже при отсутствии клинически выраженной сердечно-сосудистой патологии, присоединяется левожелудочковая недостаточность [2], что может сопровождаться увеличением концентрации натрий-уретического пептида (NT-proBNP). NT-proBNP используется преимущественно как неинвазивный маркер левожелудочковой сердечной недостаточности [3]. Однако его концентрация может повышаться при дисфункции ПЖ и повышении систолического давления в легочной артерии (СДЛА) [4].
В ряде исследований были обнаружены корреляционные связи между NT-proBNP и показателями, характеризующими вентиляционную функцию легких (ОФВ1 — объем форсированного выдоха за 1-ю с, ЖЕЛ — жизненная емкость легких, ОЕЛ — общая емкость легких), а также раО2 (парциальное напряжение кислорода в артериальной крови) [5], что позволяет предположить, что NT-proBNP является перспективным маркером для мониторинга течения и прогрессирования ХОБЛ [6].
У больных ХОБЛ в состоянии ремиссии отмечается повышенное содержание NT-proBNP по сравнению со здоровыми субъектами [7]. Пациенты с высокими концентрациями NT-proBNP имеют повышенный риск развития обострения и последующей госпитализации [8]. Повышение NT-pro-BNP при обострении ХОБЛ является неблагоприятным прогностическим фактором, увеличивающим риск потребности в интенсивной терапии в условиях отделения реанимации и интенсивной терапии и возможного летального исхода [9].
Несмотря на то, что прогрессирование ХОБЛ сопровождается повышением концентрации NT-proBNP, в литературе отсутствуют исследования, определяющие динамику этого показателя по мере развития гипоксемической хронической дыхательной недостаточности. Кроме того, отсутствует информация о влиянии длительной кислородотерапии (ДКТ) на концентрацию NT-proBNP в крови, а следовательно, о возможности использования NT-proBNP в качестве маркера эффективности проводимой респираторной терапии.
Проведенное исследование имело цель определить диагностическое значение NT-proBNP у больных ХОБЛ с хронической гипоксемической дыхательной недостаточностью
Материал и методы
Исследование проводилось на базе НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России, СПб ГБУЗ «Введенская больница». Было обследовано 60 больных ХОБЛ в период ремиссии заболевания, средний возраст составил 64,78±6,9 года. В исследование включались пациенты с ХОБЛ, относящиеся к группе GOLD III и IV стадии (группа D, смешанный фенотип: эмфизематозно-бронхитический) [10]. К критериям исключения относились клинически значимая сопутствующая патология, перенесенные хирургические вмешательства на органах грудной клетки, острый инфаркт миокарда, острые нарушения мозгового кровообращения в анамнезе. Все пациенты получали базисную терапию, согласно Федеральным клиническим рекомендациям по диагностике и лечению ХОБЛ, включающую в себя комбинированный препарат, содержащий ингаляционный глюкокортикостероид и β2-адреномиметик (будесонид/формотерол 400 мкг/12 мкг 2 р./сут) и длительно действующий М-холинолитик (тиотропия бромид 2,5 мкг, 2 ингаляции 1 р./сут) [11]. Пациенты включались в исследование только после подписания информированного согласия.
Было выделено 3 группы пациентов: группа 1 — больные ХОБЛ с гипоксемией, получающие ДКТ (n=20); группа 2 — больные ХОБЛ с гипоксемией, не получающие ДКТ (n=20); группа 3 — больные ХОБЛ с нормоксемией (n=20). После первичного обследования пациентам из группы 1 назначалась ДКТ на дому с помощью кислородных концентраторов INVACARE perfecto 2 (INVACARE, Германия), продолжительность — 16 ч в сутки ежедневно в течение 1 года. Пациенты из групп 2 и 3 не получали ДКТ. Через 12 мес. больные обследовались повторно.
Тяжесть одышки оценивалась по шкале модифицированного вопросника Британского медицинского исследовательского совета (Modified Medical Research Counsil questionnaire, mMRC).
Всем пациентам проводилась пульсоксиметрия (SpO2) и анализ газового состава артериальной крови, полученной путем катетеризации лучевой артерии, с определением величины парциального напряжения кислорода и углекислого газа (paO2, paCO2).
Спирометрия проводилась на приборе для комплексного исследования функциональных показателей легких Masterscreen (Erich Jaeger GmbH, Германия). Определялись следующие показатели: ЖЕЛ, форсированная жизненная емкость легких (ФЖЕЛ), ОФВ1, индекс Тиффно (ИТ).
Концентрацию сывороточного NT-proBNP определяли с помощью тест-систем Elecsys proBNP II (Roche Diagnostics, Германия) методом электрохемилюминисцентного иммуноанализа ECLIA.
Состояние центральной гемодинамики оценивалось с помощью эхокардиографии, которая проводилась с использованием ультразвуковой диагностической системы экспертного класса GEVIVID 7 Dimension (General Electrics, США) и матриксного мультичастотного датчика 2–4 МГц. Рассчитывались показатели, характеризующие глобальную систолическую функцию левого желудочка (ЛЖ): конечный диастолический размер (КДР), фракция выброса (ФВ), индекс массы миокарда (ИММ) ЛЖ. Оценка состояния правых отделов сердца проводилась путем измерения конечного диастолического размера ПЖ, толщины миокарда передней стенки ПЖ в диастолу. Оценка СДЛА происходила путем использования непрерывно-волновой допплерографии.
Математическая обработка результатов исследования проводилась с помощью пакета прикладных статистических программ Statistica for Windows v.7.0. Предварительно оценивалось соответствие исследуемых выборок закону нормального распределения с помощью критерия Шапиро — Уилка. Если распределение признаков в группах соответствовало нормальному закону распределения, для сравнения групповых средних использовался параметрический t-критерий Стьюдента. В противном случае использовались непараметрические методы. Определение числовых характеристик переменных с вычислением средней арифметической и средней квадратической ошибки было проведено с помощью описательной статистики.
Результаты исследования
Анализируемые группы существенно не различались по возрасту, полу и стажу курения (табл. 1). Длительность заболевания в соответствии с анамнезом и число обострений в год были достоверно больше у больных ХОБЛ с гипоксемией (группа 1). У пациентов из групп 1 и 2 исходно определялись низкие показатели paO2 и сатурации крови кислородом, в то время как у пациентов из группы 3 эти показатели находились в пределах нормы (табл. 1). Все обследованные больные предъявляли жалобы на одышку, которая была выражена в большей степени у пациентов с гипоксемией, чем у пациентов с нормоксемией.
Пациенты 3 групп существенно не различались по параметрам вентиляционной функции легких, прежде всего по показателям ОФВ1 и раСО2.
На фоне базисной терапии комбинацией будесонид/формотерол 400 мкг/12 мкг 2 р./сут в сочетании с тиотропия бромидом 2,5 мкг, 2 ингаляции 1 р./сут, за весь период наблюдения не было зарегистрировано серьезных нежелательных явлений.
Следует отметить, что, по данным эхокардиографии, ФВ ЛЖ, ИММ и КДР ЛЖ не различались в группах и не выходили за пределы нормы (табл. 2). В отличие от левых, нарушения со стороны правых камер сердца наблюдались преимущественно у пациентов групп 1 и 2. У больных ХОБЛ с гипоксемией были увеличены средняя величина размера ПЖ и толщина миокарда его передней стенки в диастолу, что указывало на наличие гипертрофии и дилатации ПЖ и формирование хронического «легочного сердца» (табл. 2).

Помимо этого, у пациентов с гипоксемией отмечен повышенный уровень СДЛА, достоверно отличавшийся от такового у больных с нормоксемией.
Показатели, характеризующие диастолическую функцию ЛЖ и ПЖ, были снижены у всех больных, причем пиковая скорость раннего и позднего диастолического наполнения (Е/А) ЛЖ была достоверно ниже у пациентов с гипоксемией.
Повышение содержания NT-proBNP было выявлено у всех пациентов с гипоксемией и только у 21% больных с нормоксемией.
Установлены корреляционные связи между NT-proBNP и раО2 (r= -0,71, p<0,05), NT-proBNP и СДЛА (r=0,61, p<0,05), NT-proBNP и Е/А ПЖ (r= -0,52, p<0,05).
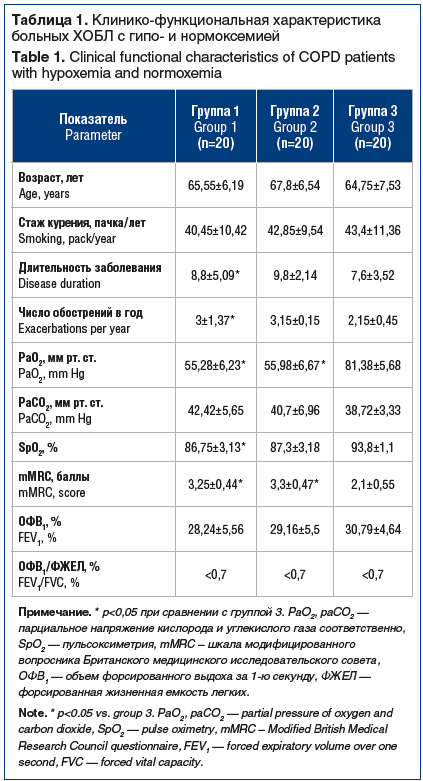
Анализ ROC-кривой для NT-proBNP определил чувствительность и специфичность его определения у больных ХОБЛ с разной степенью дыхательной недостаточности (рис. 1). Площадь под ROC-кривой для NT-proBNP у больных ХОБЛ составила 0,900 (р<0,05; 95% доверительный интервал (ДИ) 0,795–0,962). NT-proBNP имел чувствительность и специфичность 92,5% и 75% соответственно.
При повторном обследовании через 1 год пациенты с гипоксемией, получавшие ДКТ, продемонстрировали в динамике стабилизацию показателей, характеризующих состояние левых камер сердца (улучшение диастолической функции ЛЖ), уменьшение СДЛА (табл. 2) и тенденцию к улучшению диастолической функции ПЖ. В то же время у пациентов из группы 2 состояние левых камер сердца прогрессивно ухудшалось: увеличивался ИММ, отмечалась тенденция к снижению ФВ. Со стороны правых камер также отмечалась отрицательная динамика — тенденция к увеличению КДР ПЖ. СДЛА достоверно увеличилось по сравнению с первоначальным результатом. Выявлена тенденция к усугублению диастолической дисфункции ПЖ и ЛЖ.
У пациентов с нормоксемией в динамике при исследовании через 1 год существенных изменений со стороны гемодинамических показателей и концентрации NT-proBNP выявлено не было.
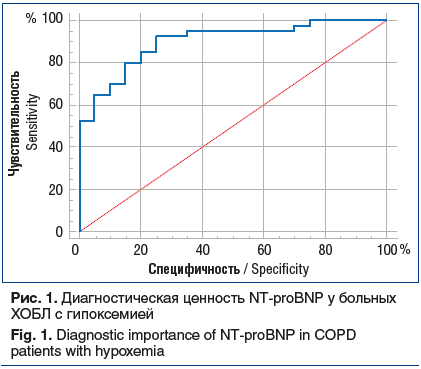
На фоне ДКТ у пациентов из группы 1 отмечалось достоверное снижение концентрации NT-proBNP (рис. 2), а у пациентов в группе 2, напротив, выявлена тенденция к повышению содержания NT-proBNP.
Обсуждение
В ходе проведенного исследования у всех обследованных больных ХОБЛ с гипоксемической хронической дыхательной недостаточностью было выявлено повышение концентрации NT-proBNP. В то время как среди больных с нормоксемией оно было зафиксировано лишь у 21% обследованных пациентов, имевших признаки хронического «легочного сердца» по данным эхокардиографии. Несмотря на то, что NT-proBNP широко используется как маркер левожелудочковой недостаточности, пациенты 3 групп достоверно не различались по показателям, характеризующим состояние левых камер сердца. Однако у больных с гипоксемией отмечались более выраженные нарушения диастолической функции обоих желудочков и легочная гипертензия. Кроме того, установлены корреляционные связи между NT-proBNP и СДЛА (r=0,61, p <0,05), Е/А ПЖ (r= -0,52, p<0,05), что неоднократно было продемонстрировано в предыдущих исследованиях [12]. Полученные результаты еще раз подтверждают участие ПЖ в повышении продукции натрий-уретического пептида. NT-proBNP вырабатывается преимущественно в миокарде желудочков в ответ на повышение конечного диастолического давления и объема. В меньшем количестве он синтезируется в миокарде предсердий. Ряд авторов связывает повышение концентрации NT-proBNP у больных ХОБЛ с гемодинамическим ответом на развитие легочной гипертензии [13] в результате спазма легочных сосудов вследствие гипоксии.
В качестве альтернативных причин, способствующих повышению концентрации NT-proBNP при ХОБЛ, рассматриваются механическое сдавление извне стенки ЛЖ вследствие гиперинфляции и повышения внутригрудного давления [14]. При обострении ХОБЛ содержание NT-proBNP достоверно повышается, что может быть обусловлено в большей степени преходящими гемодинамическими нарушениями, включающими в себя транзиторное повышение СДЛА, присоединение или усугубление правожелудочковой недостаточности [15]. Литературные данные относительно концентрации NT-proBNP у больных ХОБЛ, находящихся в состоянии ремиссии, многочисленны, но содержат противоречивые результаты. Так, в исследовании К. Nishimura et al. не было выявлено повышения концентрации BNP у больных ХОБЛ, независимо от степени обструктивных нарушений [16]. В то время как в других исследованиях были обнаружены противоположные результаты, свидетельствующие о повышении NT-proBNP пропорционально степени обструктивных нарушений при стабильном течении заболевания [17]. В проведенном исследовании выявлено, что при развитии гипоксемической хронической дыхательной недостаточности концентрация натрий-уретического пептида увеличивается. Кроме того, была выявлена корреляция между NT-proBNP и раО2 (r= -0,71, p<0,05).
При повторном проведении эхокардиографии через 1 год у пациентов, получавших ДКТ, отмечалась стабилизация гемодинамического состояния правых и левых отделов сердца, уменьшение СДЛА, опосредованное снижением легочной вазоконстрикции и легочного сосудистого сопротивления. Кроме того, в проведенном исследовании концентрация NT-proBNP на фоне ДКТ достоверно уменьшалась, что, по всей вероятности, является следствием положительных гемодинамических изменений. Напротив, у пациентов с гипоксемией, не получавших ДКТ, была выявлена тенденция к увеличению содержания NT-proBNP, что может быть обусловлено дальнейшим ухудшением состояния легочно-сердечного кровообращения на фоне прогрессирования ХОБЛ.
Выводы
По мере прогрессирования гипоксемической хронической дыхательной недостаточности у больных ХОБЛ отмечается повышение концентрации натрий-уретического пептида, который можно рассматривать как потенциальный динамический маркер не только прогрессирования легочной гипертензии, но и гипоксемии.
ДКТ способствует не только снижению СДЛА и улучшению состояния правых камер сердца, но и снижению концентрации натрий-уретического пептида, что позволяет рекомендовать использовать NT-proBNP для мониторирования эффективности проводимой терапии.
Сведения об авторах:
Кузубова Наталия Анатольевна — д.м.н., зам. директора по научной работе, НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России, 197022, Россия, г. Санкт-Петербург, ул. Рентгена, д. 12, к. 44; ORCID iD 0000-0002-1166-9717.
Титова Ольга Николаевна — д.м.н., профессор, директор, НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России, 197022, Россия, г. Санкт-Петербург, ул. Рентгена, д. 12, к. 44; ORCID iD 0000-0003-4678-3904.
Волчков Владимир Анатольевич — д.м.н., профессор, заведующий кафедрой анестезиологии и реаниматологии медицинского факультета, ФГБОУ ВО СПбГУ, 199034, Россия, г. Санкт-Петербург, Университетская наб., д. 7/9; ORCID iD 0000-0002-5664-7386.
Склярова Дарья Борисовна — к.м.н., младший научный сотрудник, НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России, 197022, Россия, г. Санкт-Петербург, ул. Рентгена, д. 12, к. 44; ORCID iD 0000-0001-7052-6903.
Контактная информация: Кузубова Наталия Анатольевна, e-mail: kuzubova@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 06.07.2020, поступила после рецензирования 19.07.2020, принята в печать 02.08.2020.
About the authors:
Nataliya A. Kuzubova — MD, PhD, Deputy Director for Scientific Work, Research Institute of Pulmonology of the I.P. Pavlov First St. Petersburg State Medical University, 12, Roentgen str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-1166-9717.
Olga N. Titova — MD, PhD, Professor, Director, Research Institute of Pulmonology of the I.P. Pavlov First St. Petersburg State Medical University, 12, Roentgen str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-4678-3904.
Vladimir A. Volchkov — MD, PhD, Professor, Head of the Department of Anesthesiology and Resuscitation of the Medical Faculty, St. Petersburg State University, 7/9, Universitetskaya Emb., St. Petersburg, 199034, Russian Federation; ORCID iD 0000-0002-5664-7386.
Dar’ya B. Sklyarova — MD, PhD, junior researcher, Research Institute of Pulmonology of the I.P. Pavlov First St. Petersburg State Medical University, 12, Roentgen str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0001-7052-6903.
Contact information: Nataliya A. Kuzubova, e-mail: kuzubova@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 06.07.2020, revised 19.07.2020, accepted 02.08.2020.
.
Информация с rmj.ru






